PNAS发表全面的小鼠耳蜗单细胞转录组图谱,为遗传性耳聋靶向治疗提供参考
2023-07-11 测序中国 测序中国 发表于上海
通过将单细胞、单核RNA测序(scRNAseq和snRNAseq)与广泛的RNA原位杂交检测(RNA scope)相结合,表征了几乎所有耳蜗细胞类型的转录组学特征。
听觉系统在哺乳动物感觉系统非常独特,其具有极致的生物物理性能。遗传性耳聋是最常见的感音神经性疾病,也是典型的单基因病,具有高度的遗传异质性,分为非综合征和综合征两大类,分别占80%和20%左右。迄今为止,已确定约125个基因与非综合征型相关,约300个基因与综合征型相关。此外,遗传性耳聋的一些致病基因在一种特定的耳蜗细胞类型中起关键作用。
耳蜗细胞,特别是听觉毛细胞的数量非常少(在人类的耳蜗中少于15,000个),这为人们破译该器官发育和生理基础的分子机制带来了阻碍。近年来,通过耳蜗基因、细胞疗法以及一些深入的转录组学研究,人们已经分析了特定的耳蜗细胞类型,但目前还未有针对所有耳蜗细胞类型的全面标准化转录组图谱,能够涵盖该感觉器官的整个分化过程,直至其完全成熟。
近期,法国巴黎西岱大学巴斯德研究所的研究团队利用小鼠模型,分析了超120,000个细胞,共涵盖耳蜗发育分化的三个关键阶段:P8(听力产生前)、,P12(听力产生时)和P20(耳蜗基本成形),绘制了全面的小鼠耳蜗单细胞转录组图谱。通过将单细胞、单核RNA测序(scRNAseq和snRNAseq)与广泛的RNA原位杂交检测(RNA scope)相结合,表征了几乎所有耳蜗细胞类型的转录组学特征。此外,研究团队还鉴定了三种先前未知的细胞类型,为破译基底膜生物物理特性的异位组织的分子机制奠定了基础。相关研究发表在PNAS期刊上,文章题为“Single-cell transcriptomic profiling of the mouse cochlea: An atlas for targeted therapies”

文章发表在PNAS
为建立一个完整、捕获所有细胞类型的小鼠耳蜗综合转录组图谱,研究人员优化了单细胞悬液和细胞核悬液的制备,以便对出生后三个关键时间段(P8、P12和P20)的小鼠耳蜗细胞进行检测(图1)。通过scRNAseq和snRNAseq技术,分别从P8、P12和P20耳蜗样本中获得22,827、26,169和39,010个细胞,从P8耳蜗样本中获得28,822个细胞核。基于不同细胞类型之间差异最大的基因以及已知标志物的分析,将转录组图谱中的细胞划分出37种细胞类型,然后通过RNAscope检测对差异表达最显著的转录本进行分析,以确定不同细胞类型的比例。
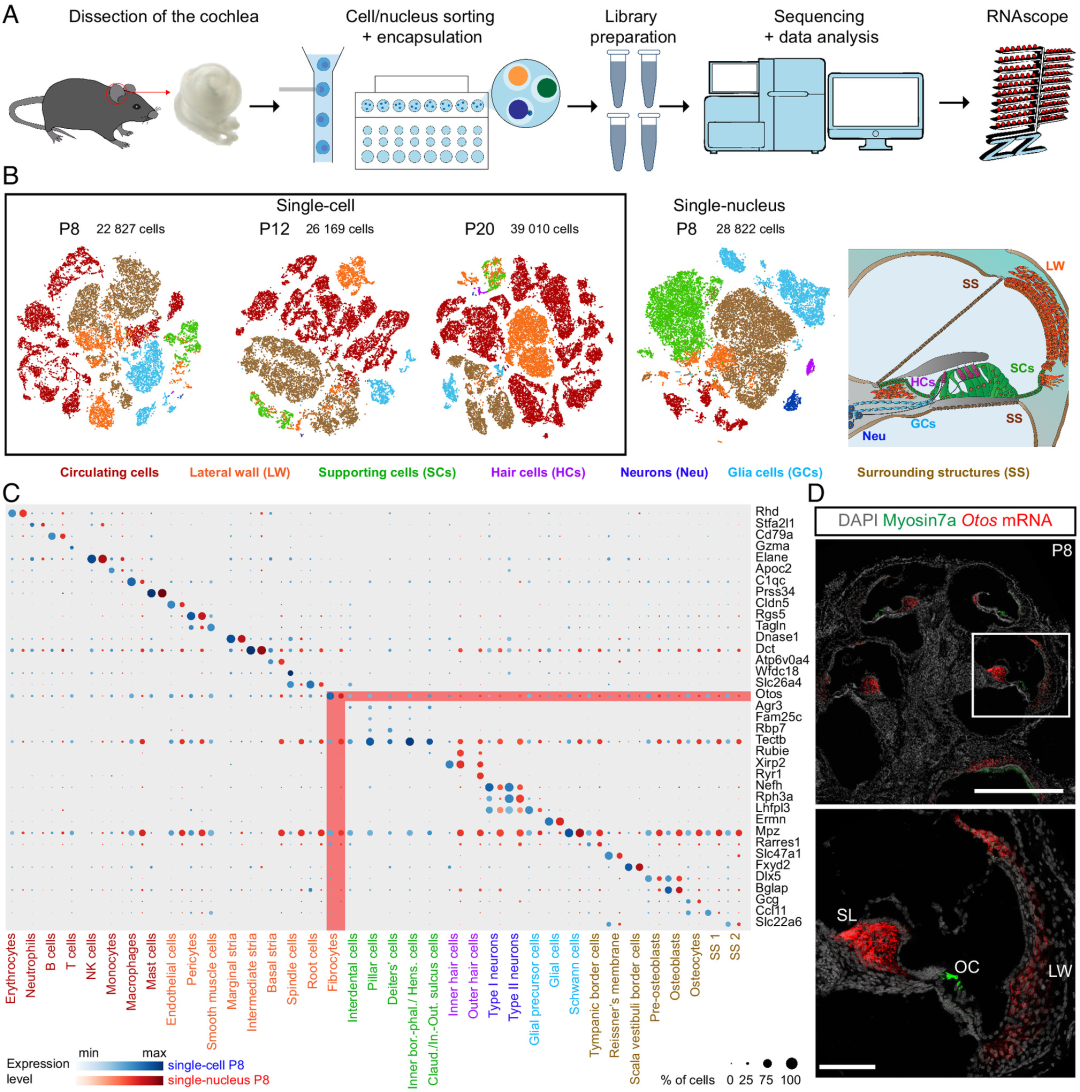
图1. 耳蜗细胞类型的转录组学表征。来源:PNAS
研究团队整合了来自三个分化阶段的单细胞转录组数据,将数据集分成两个主要集合:循环细胞(主要是血细胞)和非循环细胞,后者进一步分化为软质和软骨/骨质耳蜗组织的细胞。根据典型标记物表达对循环细胞进行人工表征。非循环细胞类型可根据其来源的耳蜗亚区细分成六个主要的细胞群,即侧壁细胞群、神经感觉上皮的细胞群和螺旋神经节细胞群,剩余三种耳蜗细胞类型可统一归为“周围结构”细胞群。
研究团队首先对表达骨功能相关基因的耳蜗细胞进行分类,确定了组成骨细胞的三个不同的成熟阶段。通过分析参与成骨细胞分化的Dlx5和Runx2的表达来鉴定耳蜗成骨前细胞、成骨细胞和骨细胞。其中,骨细胞约占总骨细胞群的90%-95%。
除上述三种已知的细胞类型外,研究人员还鉴定出对应两种未知的细胞类型的细胞簇,以下称为周围结构1和2细胞(SS1, SS2)。SS1特异表达基因是Osr2和Chrdl1,SS2特异表达基因是Bmp6和Col1a1。GO分析显示,上述基因涉及成骨细胞分化、骨化、软骨发育、牙发生和骨骼系统发育的生物学过程。综上,除了三种经典骨细胞外,研究团队还揭示了两种转录组学上不同的细胞类型,其定位于海绵状骨结构,并具有骨细胞样转录组学谱,但与成骨细胞前、成骨细胞和骨细胞不同。
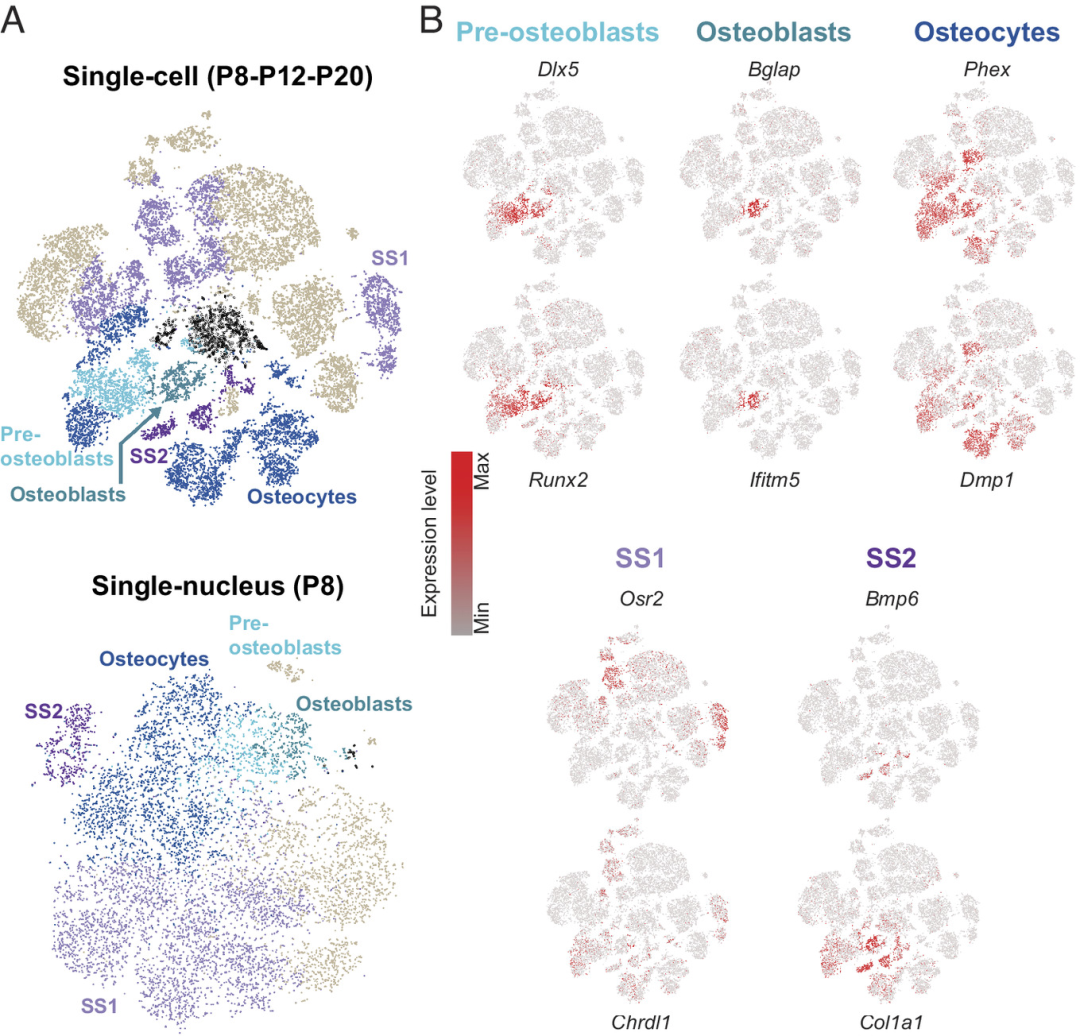
图2. 骨细胞类型及新细胞群的转录组学表征。来源:PNAS
在周围结构中,研究团队确定了3个与骨骼无关的细胞簇,第一个差异表达Slc26a7,主要存在于Reissner膜的上皮细胞(RM)中;第二个细胞簇差异共表达编码Fxyd2和钾离子通道Kcnk2的基因;第三个细胞簇显示强烈、特异性的Emilin2表达,其可编码基底膜的主要细胞外基质糖蛋白。研究团队将上述非骨细胞命名为前庭阶边缘细胞(SVB),其具有与其他已知耳蜗细胞不同的独特转录组学特征。
基于扫描电子显微镜和RNAscope分析,研究团队发现SVB细胞在软骨壳细胞空泡化过程中可能维持薄层RM的结构,促进前庭阶腔管化,并在后期阶段,将会有一小簇细胞持续存在于RM的基部。
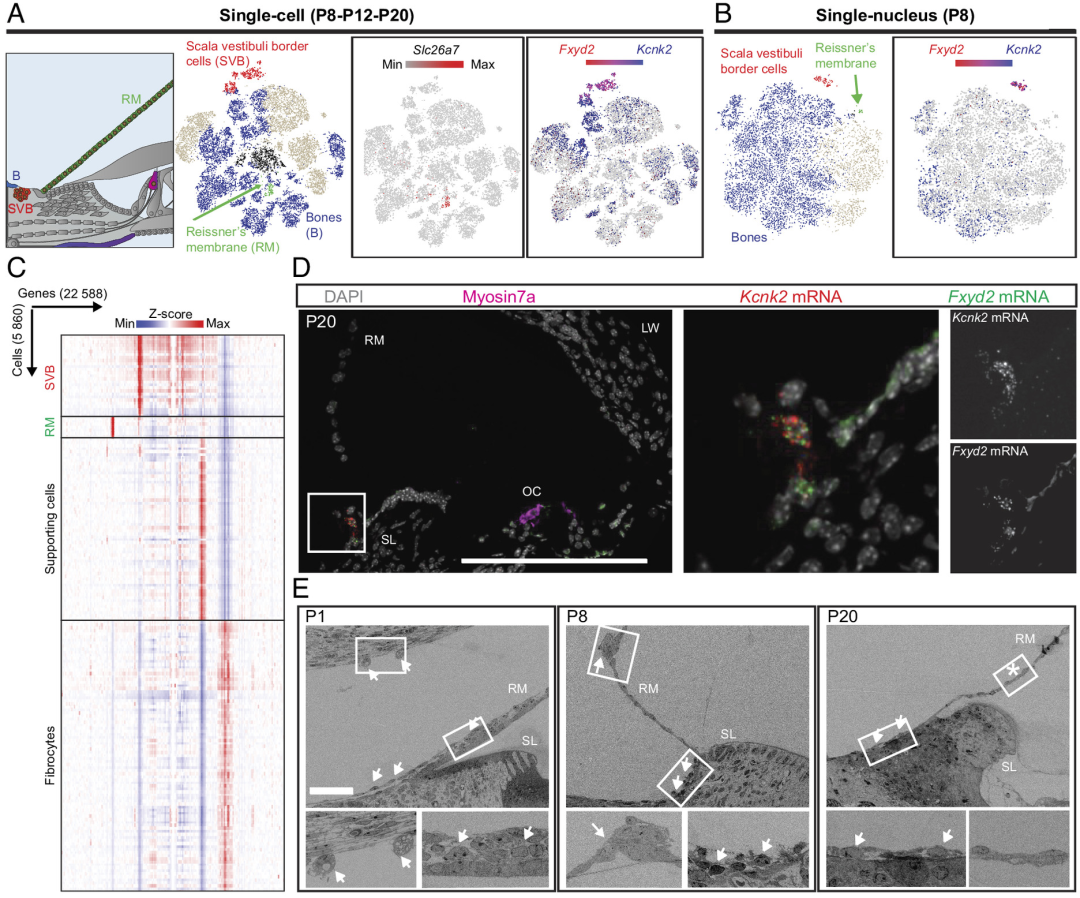
图3. 新细胞群SVB的鉴定与定位。来源:PNAS
研究团队分析了P8和P20之间,每种耳蜗细胞类型的基因表达的变化,以评估其个体和相对成熟过程。结果显示,在P8和P20之间,SVB细胞、RM细胞和成骨细胞等基因表达出现轻微至中度的变化;纤维细胞、骨细胞、SS1和SS2细胞等细胞类型显示出重大变化;纤维细胞的变化最为显著。
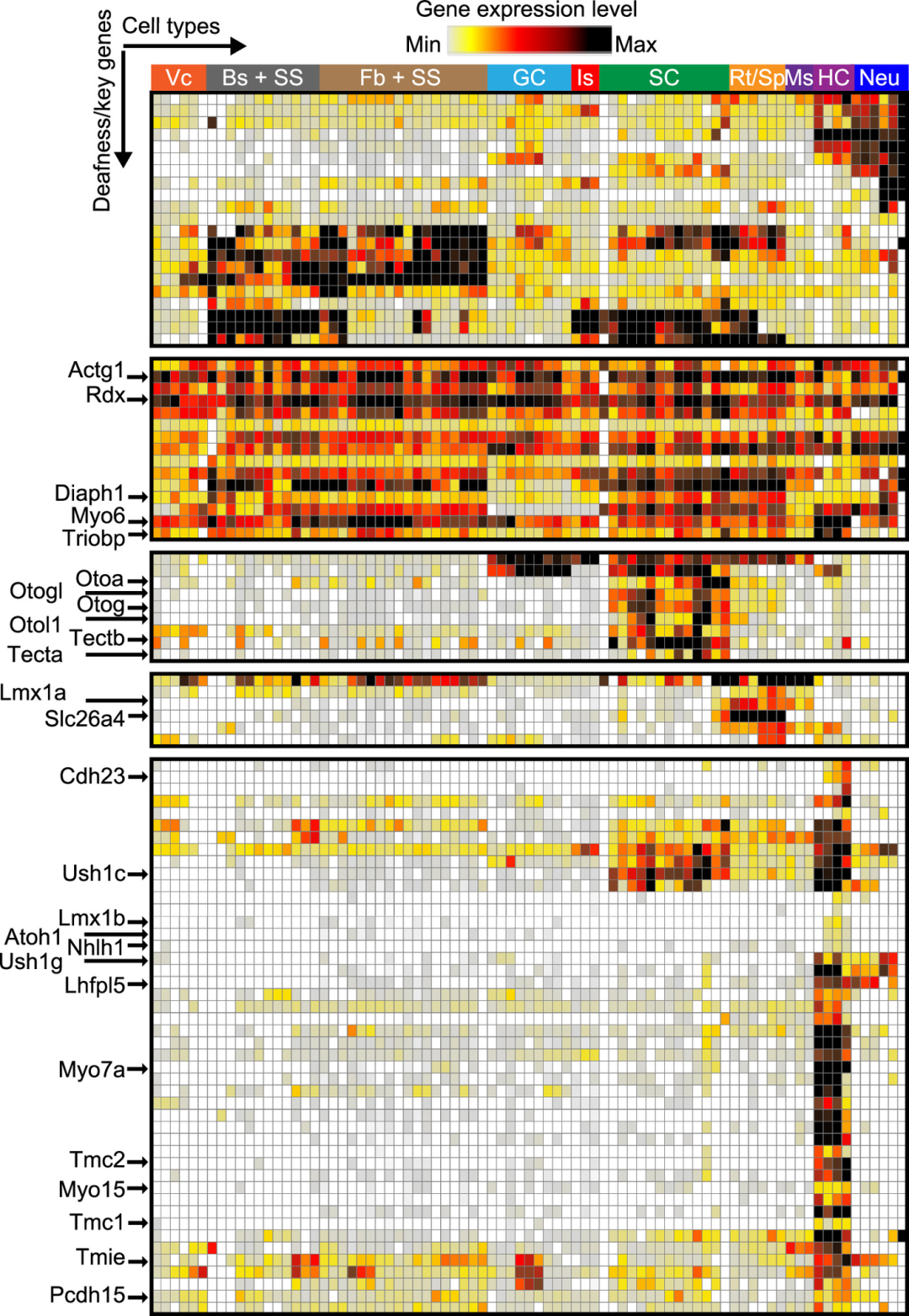
图4. 非综合征性耳聋基因的耳蜗细胞表达模式。来源:PNAS
综上所述,该研究提供了耳蜗发育过程中的全面的单细胞图谱的展示,揭示了在出生后发育的不同时间点,耳蜗细胞具有最强差异表达的基因;并同时提供了多种耳蜗细胞类型的详细转录组学数据,为了解遗传性耳聋的致病机理提供了基础。综上,这一详细的基因表达图谱为破译控制耳蜗细胞分化和成熟的基因调控网络铺平了道路,对开发有效的靶向治疗方法至关重要。
参考文献
Jean, P., Wong Jun Tai, F., Singh-Estivalet, A., et al. Single-cell transcriptomic profiling of the mouse cochlea: An atlas for targeted therapies. PNAS, 120(26), e2221744120.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











