NBT:突破!刘如谦团队首次实现体内多器官高效先导编辑
2023-05-09 iNature iNature 发表于上海
该研究开发了一种优化的双AAV递送系统,实现了小鼠大脑、肝脏和心脏中高效的先导编辑。
精确校正致病突变或在生命系统中安装保护性突变的能力具有巨大的治疗潜力。要想在遗传疾病研究和治疗中实现基因编辑的预期构想,则需要在体内提供高效的先导编辑(PEs)方法。
2023年5月4日,博德研究所刘如谦团队在 Nature Biotechnology在线发表题为“Efficient prime editing in mouse brain, liver and heart with dual AAVs”的研究论文,该研究开发了一种优化的双AAV递送系统,实现了小鼠大脑、肝脏和心脏中高效的先导编辑。该研究描述了腺相关病毒(AAV)介导的体内先导编辑瓶颈的鉴定,以及具有增加PE表达、先导编辑引导RNA稳定性和调节DNA修复的AAV-PE载体的开发。
由此产生的双AAV系统,v1em和v3em PE-AAV,能够在小鼠大脑(皮层的效率高达42%)、肝脏(高达46%)和心脏(高达11%)中进行治疗相关的先导编辑。该研究在体内为星形胶质细胞中的阿尔茨海默病和肝细胞中的冠状动脉疾病安装假定的保护性突变。用v3em PE-AAV进行的体内先导编辑没有引起可检测的脱靶效应或肝酶与组织学的显著变化。优化的PE-AAV系统支持迄今为止报道的最高水平的体内先导编辑,有助于潜在遗传成分疾病的研究和治疗。
2023年4月17日,博德研究所刘如谦及圣裘德儿童研究医院Jonathan S. Yen共同通讯在Nature Biomedical Engineering在线发表题为“Ex vivo prime editing of patient haematopoietic stem cells rescues sickle-cell disease phenotypes after engraftment in mice”的研究论文,该研究表明患者造血干细胞的体外先导编辑在小鼠移植后挽救镰状细胞病表型。该研究结果支持一次性先导编辑SCD治疗的可行性,该治疗将HBBS纠正为HBBA,不需要任何病毒或非病毒DNA模板,并最大限度地减少DNA双链断裂的不良后果。
2023年3月30日,博德研究所刘如谦团队在Science 在线发表题为“Base editing rescue of spinal muscular atrophy in cells and in mice”的研究论文,该研究描述了SMN2的基因组编辑,一个含有C6>T突变的SMN1的不足副本,以永久恢复SMN蛋白水平并挽救SMA表型。该研究使用核酸酶或碱基编辑器修饰五个SMN2调控区。碱基编辑转化SMN2 T6>C,使SMN蛋白水平恢复到野生型。在Δ7SMA小鼠中,AAV9介导的碱基编辑器的递送平均产生87%的T6>C转换,改善运动功能,并延长平均寿命,一次性碱基编辑器+nusinersen联合用药增强了这一效果(111天,而未治疗的小鼠为17天)。这些发现证明了一次性碱基编辑治疗SMA的潜力。
先导编辑(PEs)是一种精确的基因编辑剂,几乎可以在活细胞的靶DNA位点进行任何取代、小缺失和小插入。PEs不依赖于双链断裂,最大限度地减少与核酸酶相关的不必要结果,如不受控制的插入和缺失(indels)、大缺失、染色体异常或p53 DNA损伤反应的诱导。PEs包括与工程逆转录酶(RT)融合的可编程镍酶。先导编辑引导RNA(pegRNA)包含一个将PEs引导到靶DNA位点的间隔区,以及一个编码所需编辑的3′延伸区。PEs使用缺口靶DNA链作为引物将pegRNA延伸直接逆转录到基因组中,导致基因组DNA发生永久性变化,副产物相对较少。PEs不需要供体DNA模板,已在许多哺乳动物细胞系统中广泛使用,包括有丝分裂细胞和有丝分裂后细胞。
在将PEs转化为临床环境之前,需要能够靶向治疗相关组织类型的安全有效的递送方法。腺相关病毒(AAVs)经过临床验证,并经FDA批准用于体内基因治疗和基因编辑应用。尽管并非没有潜在风险,但AAV仍然是为数不多的用于各种非肝器官和组织类型的有效且经临床验证的体内递送载体之一。然而,在编码DNA序列的~6.3千碱基(kb)处,PE目前太大,不适合AAV的约4.7-kb负载物大小限制。
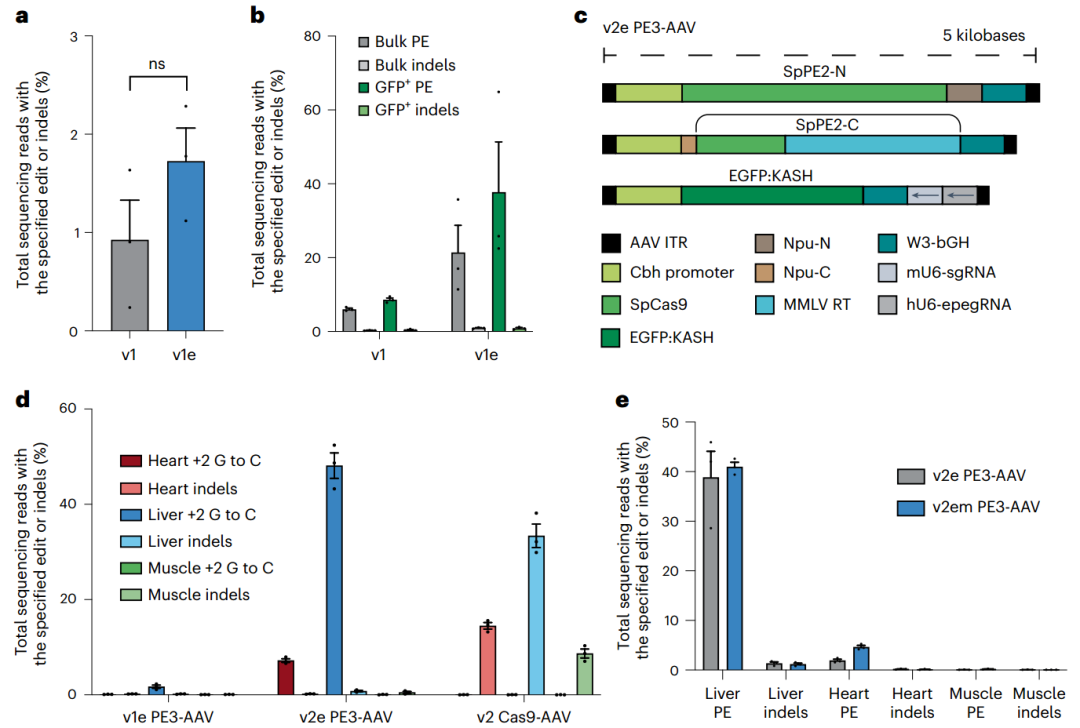
限制系统先导编辑效率的因素评估(图源自Nature Biotechnology )
作者和其他实验室已经解决了AAV的包装能力,通过将其分成两半,每个两半融合到一个快速剪接的内含子中来容纳大型基因组编辑剂。两种AAVs的共同转导通过分裂的内含子融合蛋白的结合或结合和剪接来重建编辑剂。到目前为止,在没有编辑细胞生存优势的情况下,现有的体内PE递送策略,通过肠内分裂AAV或流体动力学DNA注射,在出生后的动物中产生了适度的体内编辑效率,实现了对应于1.7-13.5%编辑体积肝脏或视网膜的最大效率。
最近的研究证明,通过PE-SpRY的双重AAV递送,在富集的退化性视网膜色素变性小鼠视网膜中进行有效的体内先导编辑。在最高剂量下,腺病毒转导在新生动物中产生了迄今为止报道的最有效的体内先导编辑,但由于腺病毒的免疫原性和毒性,临床应用可能仍具有挑战性。因此,使用AAV将PE有效地体内递送到治疗相关细胞中仍然是将主先导编辑用于动物研究和治疗应用的主要瓶颈。
该研究报道了在多个小鼠器官中介导高效体内先导编辑的内含子分裂PE-AAV的开发、优化和应用。作者系统地优化了PE蛋白、pegRNA和AAV基因组元件,从而产生了优化的“v3em PE-AAV”递送策略,使小鼠大脑(42%)、肝脏(46%)和心脏(11%)的先导编辑达到治疗相关水平。该研究结果提高了先导编辑在基础研究和治疗应用中的潜力,并建立了优化的PE-AAV系统作为一种有效的体内PE递送方法。
原文链接:
https://www.nature.com/articles/s41587-023-01758-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







