Sci Adv 陆瑶/徐清波教授团队发现内皮RIPK1调控搭桥动脉重构的重要机制
2023-09-01 论道心血管 论道心血管 发表于上海
该研究首次发现抑制内皮-平滑肌细胞激活的Sonic hedgehog信号通路可能是预防搭桥动脉粥样硬化及再狭窄的新方法,为靶向预防和改善血管重构提供了全新见解。
搭桥动脉粥样硬化及再狭窄是冠状动脉旁路移植术(Coronary Artery Bypass Grafting, CABG)后的主要并发症,严重制约冠心病患者的远期生存率,因此迫切需要有效的措施改善或延缓搭桥血管狭窄的形成,进而减少缺血事件的再发生。寻找直接靶向内皮细胞死亡和炎症的调控因子,有望在内皮功能损伤早期进行干预,突破当前动脉搭桥慢性血管重构防治的瓶颈。
2023年8月30日,中南大学湘雅三医院陆瑶教授和浙江大学医学院附属第一医院徐清波教授合作,在Science Advances在线发表了题为“Endothelial RIPK1 Protects Artery Bypass Graft Against Arteriosclerosis by Regulating SMC Growth”的研究论文,揭示了内皮RIPK1 (Receptor-interacting protein kinase 1)通过Ser26位点磷酸化EEF1AKMT3 (Eukaryotic translation elongation factor 1 lysine methyltransferase 3)并调节Sonic hedgehog信号蛋白N-Shh合成分泌,继而通过内皮-平滑肌细胞通讯调控平滑肌细胞异常增殖和搭桥血管重构。该研究首次发现抑制内皮-平滑肌细胞激活的Sonic hedgehog信号通路可能是预防搭桥动脉粥样硬化及再狭窄的新方法,为靶向预防和改善血管重构提供了全新见解。

在本研究中,作者首次揭示了小鼠自体动脉搭桥过程中的病理改变图谱,并利用内皮细胞特异性RIPK1敲除小鼠,证实内皮细胞RIPK1在调节平滑肌细胞增殖和搭桥动脉病理重构中起重要作用。
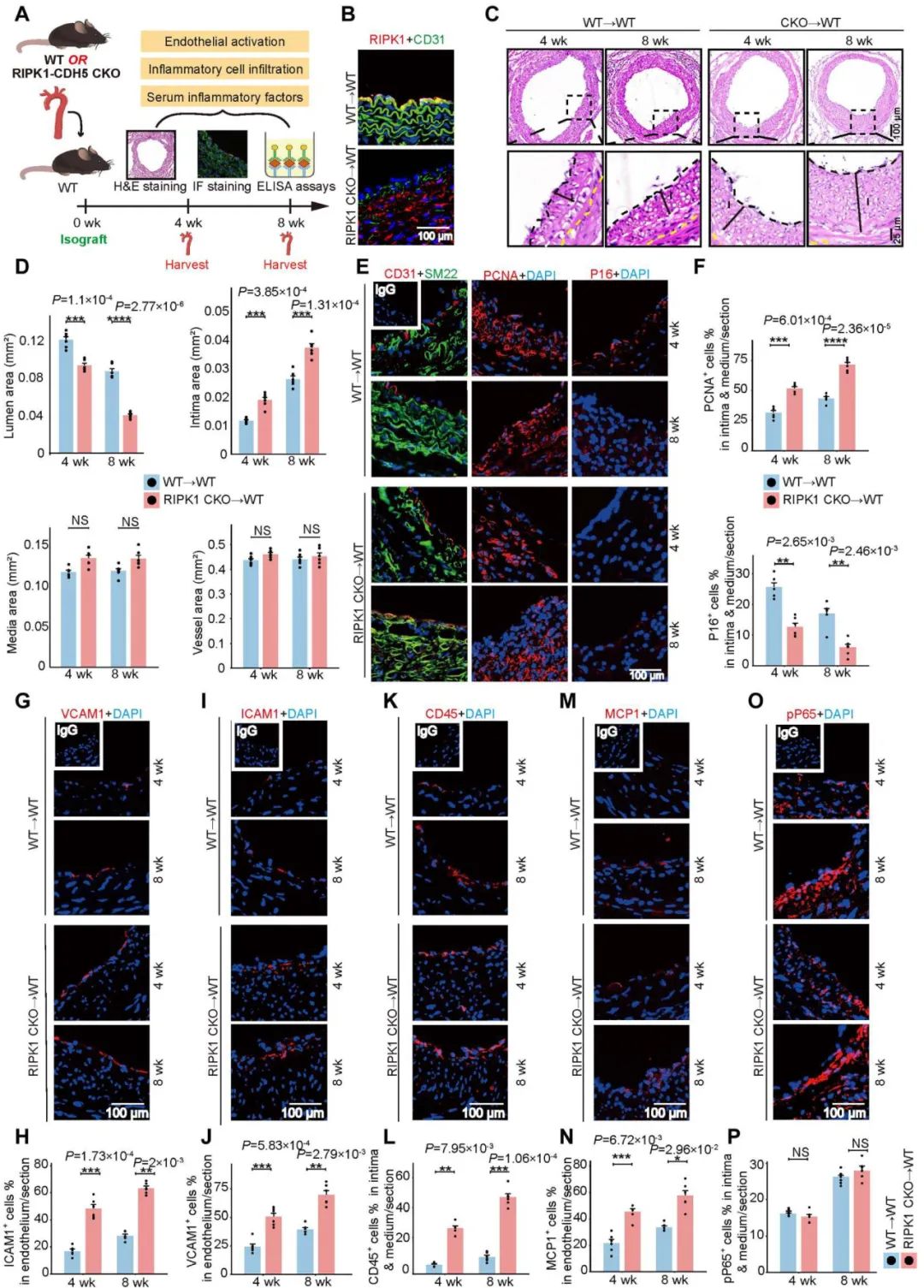
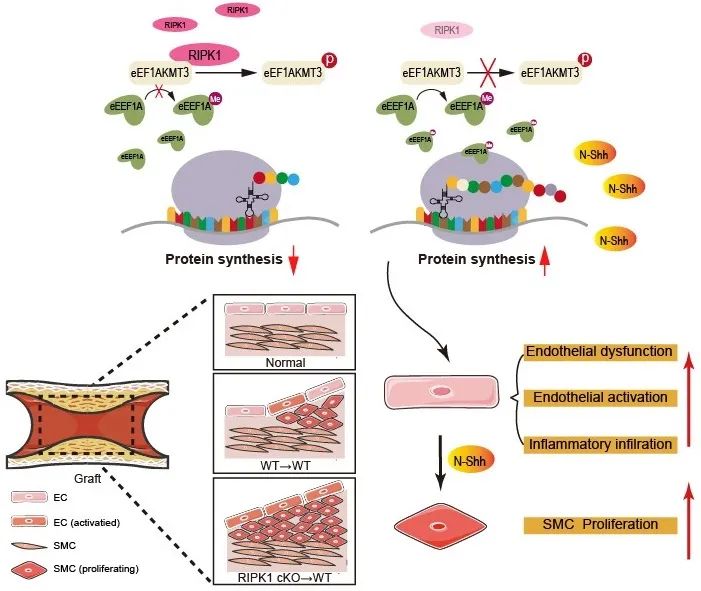
机制上,作者利用Co-IP、质谱等实验发现,RIPK1直接结合并磷酸化EEF1AKMT3 (Ser26位点),从而抑制翻译相关蛋白EEF1A的K165甲基化,由此抑制核糖体蛋白的合成和N-Shh分泌以及平滑肌细胞增殖。因此,内皮细胞RIPK1-EEF1AKMT3 S26 - EEF1A K165信号轴通过精细调节核糖体蛋白合成功能,干预N-Shh分泌并参与内皮-平滑肌细胞通讯,共同调控搭桥动脉重构。
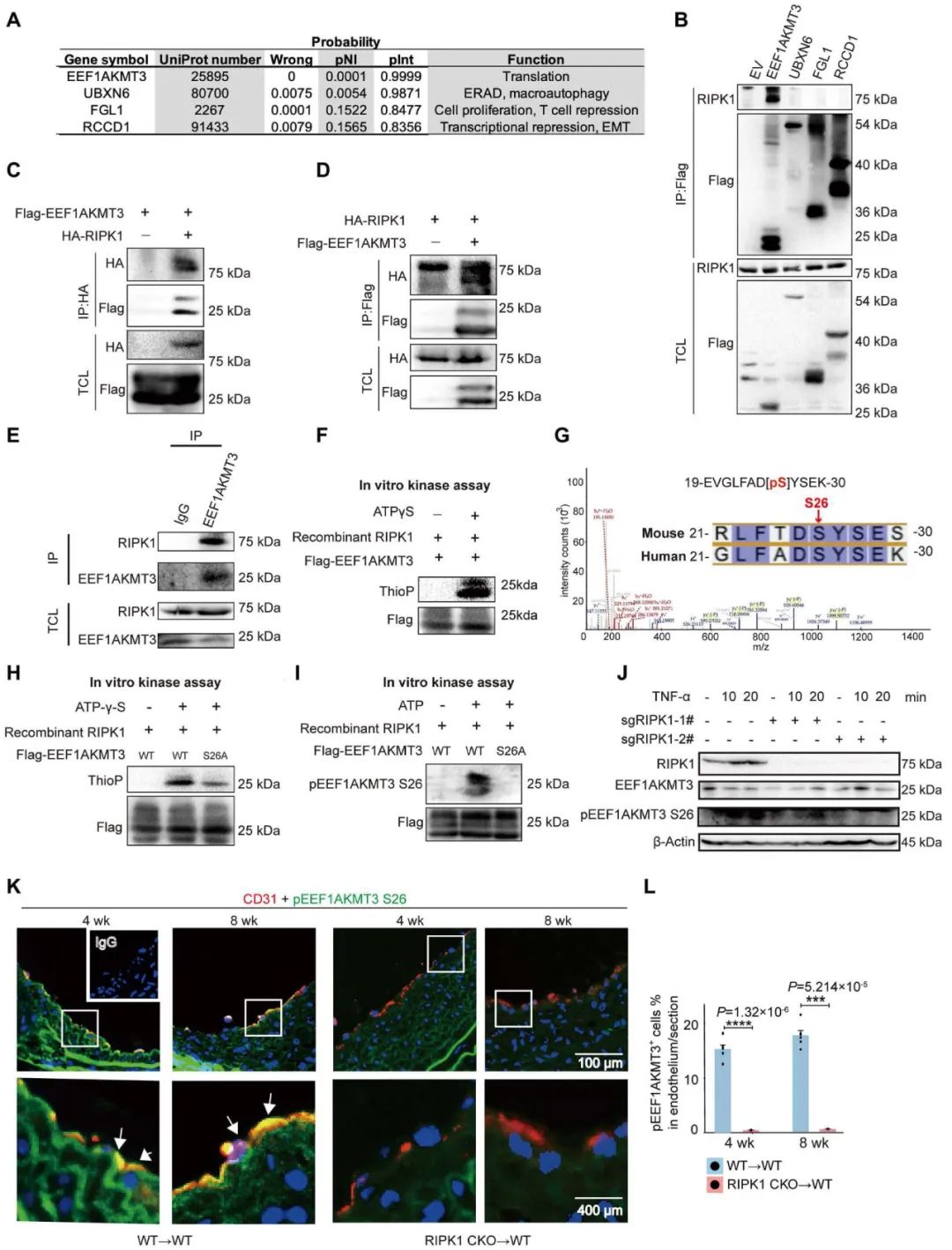
综上,本研究鉴定了RIPK1调控的内皮细胞和平滑肌细胞在动脉搭桥中相互作用的全新分子生物学机制,靶向RIPK1介导的Hedgehog信号通路激活有望改善搭桥动脉重构,为CABG干预提供新策略。
中南大学湘雅三医院陆瑶教授、浙江大学医学院附属第一医院徐清波教授、湘雅医院翁良教授为本文的共同通讯作者,陆瑶教授团队冷一铭博士为并列第一作者。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adh8939
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言