早期内皮祖细胞向巨噬细胞转换在肺动脉高压丛样病变发展中的潜在贡献
2022-10-30 刘少飞 MedSci原创
该研究检测了早期祖先内皮细胞(eEPCs)在慢性炎症环境下分化为巨噬细胞而促进丛状病变发展的假说。
研究背景:
丛状病变在结构和细胞组成上具有动态外观,是人类严重肺动脉高压的组织学标志。病变发展的发病机制在很大程度上仍然是未知的,尽管它可能与早期祖先内皮细胞(eEPCs)的局部炎症和功能障碍有关。该研究检测了eEPCs在慢性炎症环境下分化为巨噬细胞而促进丛状病变发展的假说。
研究方法:
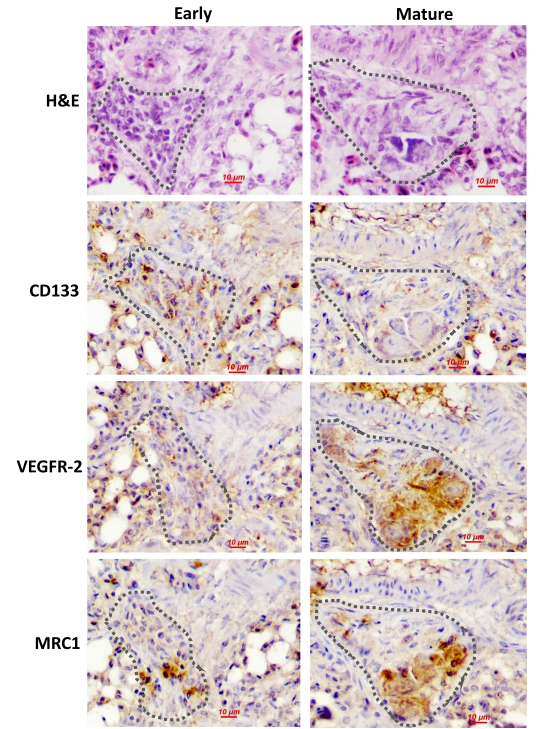
用免疫组化法测定肉鸡模型中丛膜病变的eEPC标记物CD133和VEGFR-2、巨噬细胞系标记物甘露糖受体C型1(MRC1)、TNFα和核因子红细胞相关因子2(Nrf2)。将来自外周血单核细胞的eEPC暴露于TNFα,分别用吞噬和Matrigel塞实验评估细胞的巨噬分化和血管生成能力。还评估了Nrf2在eEPC向巨噬细胞转变以及MRC1表达中的作用。通过气管内安装TNFα来确定局部炎症对丛状病变形成的影响。
研究结果:
组成早期病变的细胞具有典型的eEPC表型,而更成熟的病变中的细胞则显示出巨噬细胞的分子和形态学特征。随着病变的发展,观察到丛状病变中TNFα的产生增加。体外研究显示,慢性TNFα将诱导eEPCs向巨噬细胞分化,同时伴随着Nrf2的过度激活,Nrf2是一种应激反应的转录因子。Nrf2的激活(Keap1敲除)导致CD133的明显下调,但MRC1的mRNA上调。双重荧光素酶报告试验表明,Nrf2与MRC1的启动子结合以触发其表达。与体外观察很一致的是,TNFα暴露诱导了Matrigel塞子中eEPC的巨噬细胞分化,导致塞子中的新生血管减少。气管内安装TNFα导致丛状病变密度明显增加。
研究结论:
这项工作提供的证据表明,慢性炎症刺激导致的eEPCs的巨噬细胞分化有助于丛状病变的发展。鉴于Nrf2在eEPCs向巨噬细胞的表型转换中的关键作用,靶向该分子可能有利于干预丛状病变。
参考文献:
Shao FJ, Guo XL, Xu JX, Liu R, Li DY, Li QH, Zhou T, Fang C, Tan X. Potential contribution of early endothelial progenitor cell (eEPC)-to-macrophage switching in the development of pulmonary plexogenic lesion. Respir Res. 2022 Oct 23;23(1):290. doi: 10.1186/s12931-022-02210-7. PMID: 36274148.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












