读书报告 | 晚期食道鳞癌对化疗联合PD1抗体治疗应答的免疫和癌基因特征
2023-11-10 iCombo iCombo 发表于上海
EGIC有望指导个体化治疗策略,并为晚期ESCC患者化疗联合抗PD-1治疗的生物标志物研究提供信息。
导读
近年来免疫检查点抑制剂(ICIs)在化疗难治性晚期食管鳞状细胞癌(ESCC)中取得了很好的治疗效果。多项临床研究证明,化疗联合抗PD-1比单纯化疗可显著改善晚期ESCC患者的OS,从而使化疗联合抗PD-1成为晚期ESCC新的标准一线治疗方案。然而,患者对于化疗联合抗PD-1的反应各不相同,因此确定预测性标记物以指导患者选择和发现新的治疗靶点至关重要。
PD-L1被广泛用于预测多种类型癌症的抗PD-1治疗的疗效。然而,先前的研究显示,在预测ESCC化疗联合抗PD-1疗效方面,PD-L1表达水平并不能够有效的预测预后。一项荟萃分析显示,低PD-L1表达的ESCC患者仍然可以从化疗联合抗PD-1治疗中获益。此外,很少有研究探索抗PD-1治疗在ESCC中的相关生物标志物,如肿瘤突变负荷(tumor mutational burden, TMB)和肿瘤浸润免疫细胞。并且大多数ICIs的生物标志物研究没有采用对照组,因此难以确定所鉴定的生物标志物仅仅是预后还是预测治疗。
中山大学肿瘤防治中心徐瑞华教授团队对来自JUPITER-06研究的486名患者的肿瘤样本进行了全外显子组测序,并通过总结CNA早期突变、无CAN突变和杂合性缺失突变(LOH)的数量,开发了一种经过CNA校正的TMB(ccTMB),作为一种改进的克隆TMB指标。该指标能更准确地描述免疫原性并预测化疗联合抗PD-1疗效。研究进一步确定了与化疗联合抗PD-1疗效相关的其他几个免疫原性特征(HLA-I/II多样性和b62-non-1501超型)和和致癌风险改变(即PIK3CA突变、TET2突变、22q11.21高水平扩增和1q21.3高水平扩增)。最终结合这些免疫原性特征和致癌改变建立了一种基于基因组学的食管癌免疫肿瘤学分类(EGIC)方案。化疗联合抗PD-1在EGIC1组(免疫原性特征有利和致癌改变阴性)和EGIC2组(免疫原性特征有利或致癌改变阴性)亚组中获得显著的生存改善,但在EGIC3组(免疫原性特征不利和致癌改变阳性)中没有明显的生存获益。因此,EGIC有望指导个体化治疗策略,并为晚期ESCC患者化疗联合抗PD-1治疗的生物标志物研究提供信息(Cancer Cell.2023 Apr 4; S1535-6108 (23) 00089-2. doi: 10.1016/j.ccell.2023.03.016)。
前言
近年来,免疫检查点抑制剂(ICIs)在化疗难治性晚期食管鳞状细胞癌(ESCC)中取得了很好的治疗效果。多项临床研究证明,化疗+抗PD-1比单纯化疗可显著改善晚期ESCC患者的OS,从而使化疗+抗PD-1成为晚期ESCC新的标准一线治疗方案。然而,患者对于化疗+抗PD-1的反应各不相同,因此确定预测性标记物以指导患者选择和发现新的治疗靶点至关重要。
PD-L1被广泛用于预测多种类型癌症的抗PD-1治疗的疗效。然而,先前的研究显示,在预测ESCC化疗+抗PD-1疗效方面,PD-L1表达水平并不能够有效的预测预后。一项荟萃分析显示,低PD-L1表达的ESCC患者仍然可以从化疗+抗PD-1治疗中获益。此外,很少有研究探索抗PD-1治疗在ESCC中的相关生物标志物,如肿瘤突变负荷(tumor mutational burden, TMB)和肿瘤浸润免疫细胞。并且大多数ICIs的生物标志物研究没有采用对照组,因此难以确定所鉴定的生物标志物仅仅是预后还是预测治疗。
JUPITER-06研究是一项多中心3期试验,其中514名未经治疗的晚期ESCC患者被随机分配接受toripalimab(人源化IgG 4K抗PD-1抗体)加化疗或单独化疗。它为抗PD-1作为晚期ESCC一线治疗提供了可靠证据。
利用随机对照设置,JUPITER-06前瞻性设计了一项生物标志物研究,并从486(95%)名参与者中收集了治疗前肿瘤标本。使用全外显子组测序(WES)鉴定了预测化疗+抗PD-1疗效效的免疫原性和致癌性特征,并将其纳入基于食管癌基因组的免疫肿瘤学分类(EGIC)方案中,以指导晚期ESCC一线化疗中抗PD-1治疗的患者选择。
结果
1、JUPITER-06 ESCC队列的基因组特征
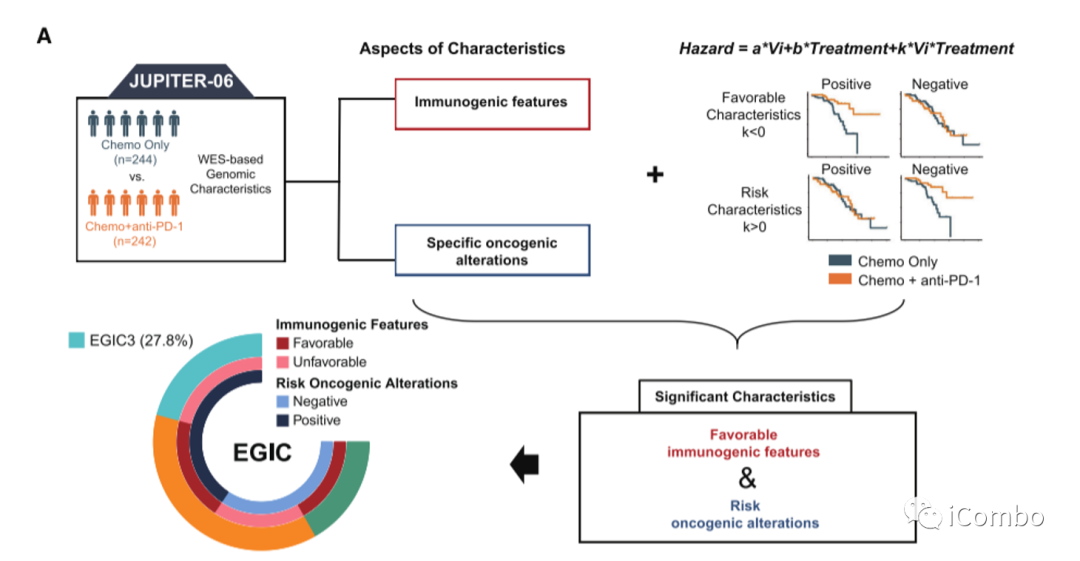
整体设计流程图
1A. 系统地评估了与免疫原性和特异性改变事件相关的基因组特征,应用Cox回归分析和一个相互作用项来评估化疗+抗PD-1与单独化疗的相对疗效是否根据给定的基因组特征而变化。
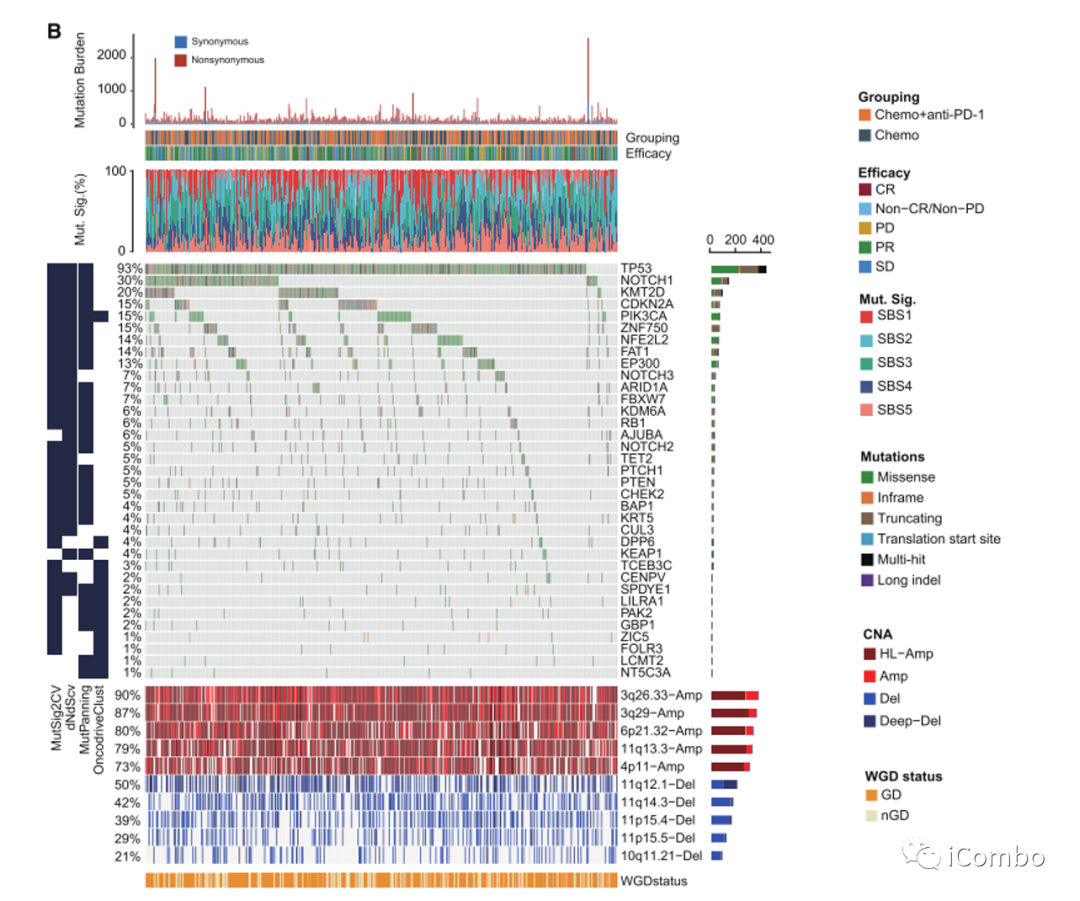
使用了四种方法来鉴定显著突变基因(SMGs):基于突变复发的MutSig2CV,基于阳性选择的dNdScv,基于核苷酸上下文的Mutpanning和基于突变聚类的OncodriveClust。
与之前的大规模测序研究类似,ESCC中最可能的SMGs是TP53(93%)、NOTCH1(31%)、KMT2D(20%)、CDKN2A(15%)和PIK3CA。
进一步在ESCC中发现了许多复发性体细胞拷贝数改变(CNA)事件,其中染色体3q26.33、3q29和6p21.32最常被扩增,而染色体11q12.2、11q14.3和11p15.4最常被删除。
从单碱基取代(SBS)中鉴定出5个突变特征:SBS1、SBS2、SBS3、SBS4和SBS5。
2、经CNA校正的TMB可预测ESCC患者接受化疗加抗pd-1治疗的预后
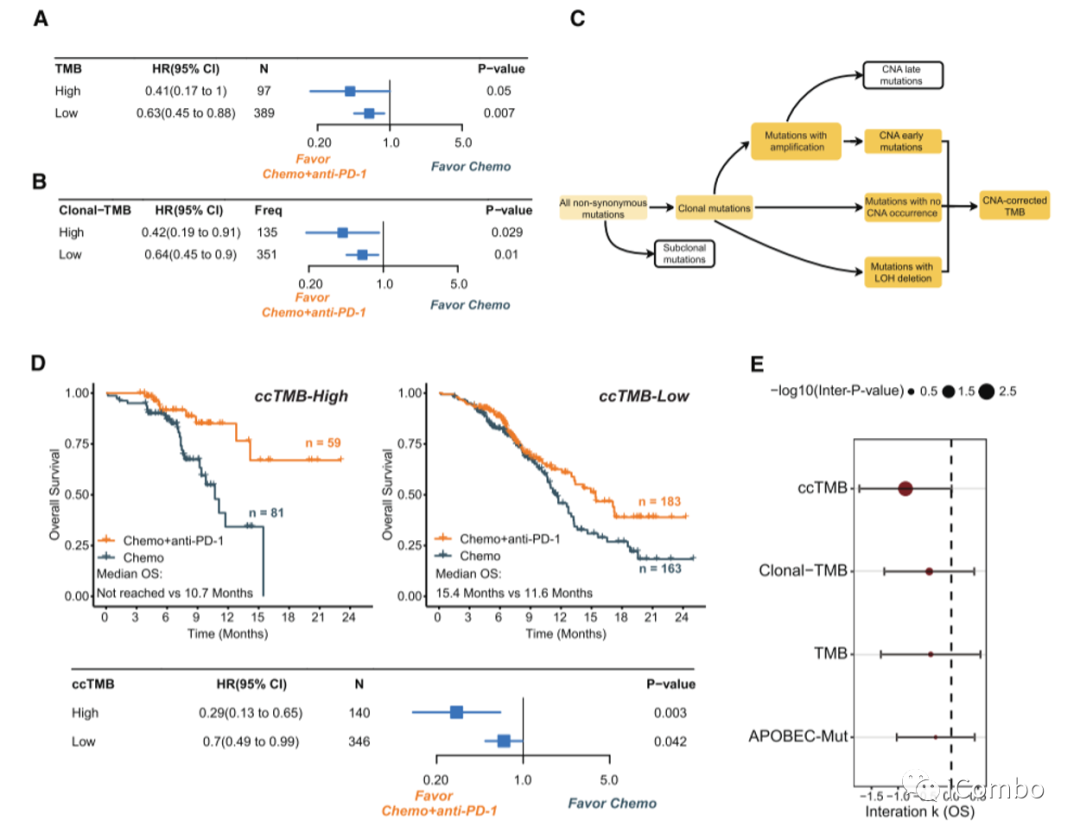
A,B:TMB-High和TMB-Low ESCC患者中,化疗+抗PD-1与单独化疗的相对疗效在OS和PFS方面没有差异。同样,较高的克隆TMB和较高的apobec相关突变负担与化疗+抗PD-1与单独化疗的疗效无关。
C:通过总结CNA早期突变、无CAN突变和杂合性缺失突变(LOH)的数量,开发了一种经过CNA校正的TMB(ccTMB),作为一种改进的克隆TMB指标。
D:在ccTMB高的患者中,化疗+抗PD-1治疗对OS的改善比单独化疗更显著(风险比[HR] 0.29 vs. 0.70)。
E:ccTMB是预测化疗+抗pd -1优于单独化疗的OS和PFS获益的最佳标记。
3. HLA基因型与ESCC患者化疗加PD-1阻断的预后相关

A,B:HLA-1的种系或体细胞杂合性降低,HLA-II的种系杂合性降低分别发生在85%和32.1%的患者中,这两者都与化疗+抗PD-1的PFS和OS益处降低有关。
C:将HLA -1与HLA-A、HLA-B和HLA-C分别检测时,发现HLA-B杂合性降低对化疗+抗PD-1疗效的影响最为显著。
D,E:在HLA-A和HLA-B超型之后,发现在所有超型中,B62超型的存在是化疗+抗PD-1对OS和PFS获益的最强预测因子。
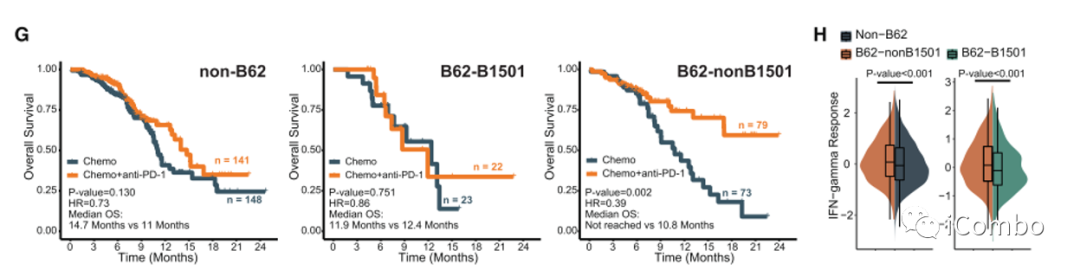
F:进一步将B62超型ESCC患者分为B62- b1501和B62-非b1501亚组。
G:B62-B1501与化疗+抗PD-1的OS和PFS获益较小相关,而b62non - b1501预测该方案的预后更有利。
4. 致癌改变与化疗加PD-1阻断的获益较少相关
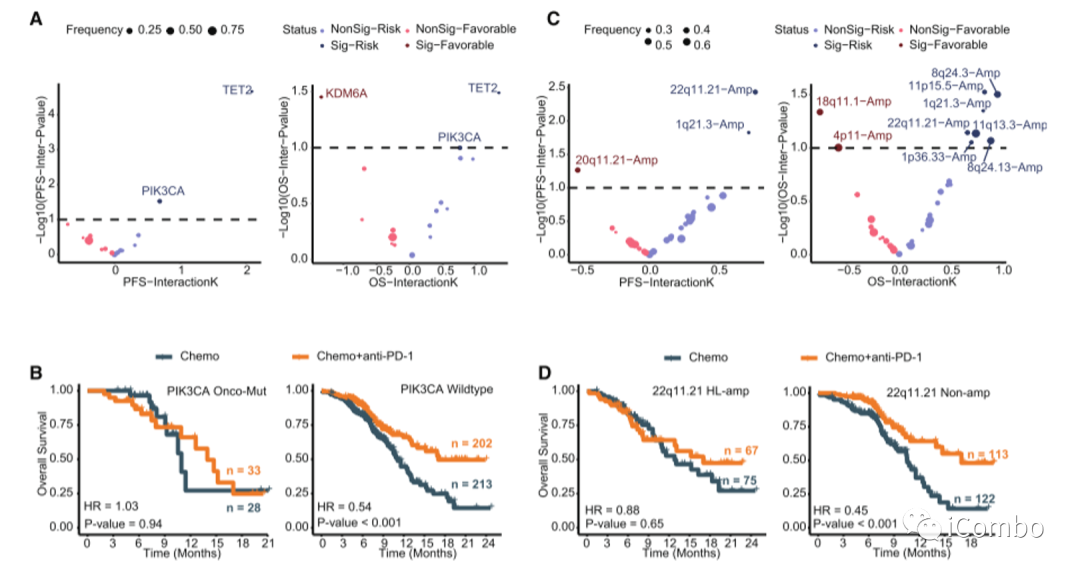
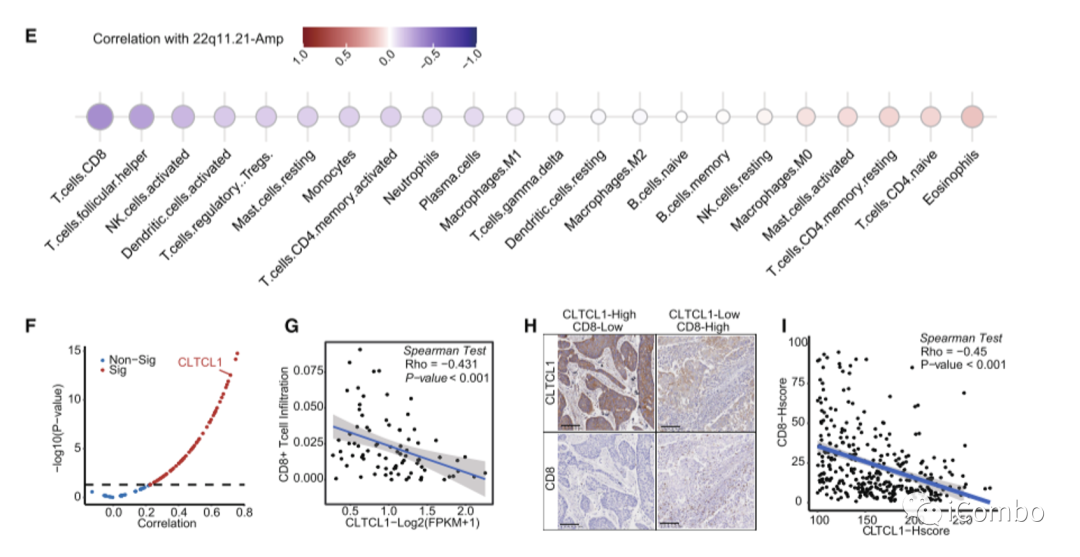
5. EGIC:一种基于免疫致癌特征的方案,用于区分化疗加PD-1阻断的结果
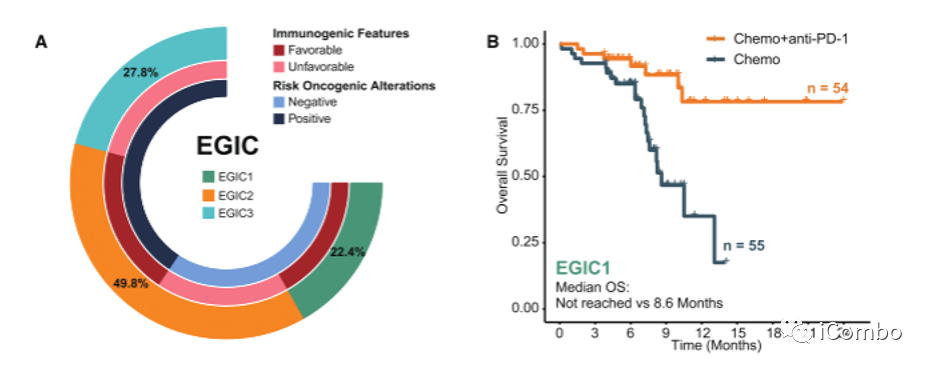
免疫原性特征(即ccTMB-high、HLA-I/II多样性和b62 -non - 1501超型)和致癌风险改变(即PIK3CA突变、TET2突变、22q11.21高水平扩增和1q21.3高水平扩增)是调节ESCC患者化疗+抗PD-1疗效的两个独立方面。
建立EGIC方案,将ESCC患者分为三组:EGIC1(免疫原性特征有利和风险事件阴性),EGIC2(免疫原性特征有利或风险事件阴性)和EGIC3(免疫原性特征不利或风险事件阳性)。
结论
经CNA校正的TMB(ccTMB)有效地辨认了将从化疗+抗PD-1联合治疗中获得更大益处的ESCC患者,并且优于其他常规的TMB改进版本。这种改进的免疫原性指标可预测PD-I阻断的功效(无论是否联合化疗化疗)。将HLA特征与ccTMB联合使用能进一步提高预测效能。研究团队就此提出了EGIC分型中三项提示免疫原性有利的特征(高ccTMB、HLA-B异质性/HLA-IIβ多样性、非HLA-B1501的HLA-B62超型)。
研究团队对显著突变基因(SMGs)和染色体拷贝数变异进行全面筛选,发现TET2、PIK3CA突变,染色体1q21.3、22q11.21区段扩增四条特征,与患者接受免疫+化疗联合治疗无获益相关。
研究团队提出的EGIC分型法可以指导未来的个体化治疗策略,并为晚期ESCC患者的化疗+抗PD-1治疗的机制生物标志物研究提供信息。研究结果显示,EGIC免疫分型为1型(EGIC-1,免疫原性特征有利+无风险基因变异)和2型(EGIC-2,免疫原性特征有利或无风险基因变异)的晚期ESCC患者,一线接受免疫+化疗联合治疗,可实现显著的生存获益,这有望推动临床实践中ESCC的精准化、个体化免疫治疗,并进一步指导后续生物标志物方面的探索。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







