Science Advances:华中科技大学朱铃强/鲁友明等合作发现阿尔茨海默病中神经元和胶质细胞的细胞通讯障碍新机制
2023-04-27 iNature iNature 发表于上海
神经元-胶质细胞相互作用对大脑内稳态至关重要,在神经退行性疾病中其稳态平衡被打破。
神经元-胶质细胞相互作用对大脑内稳态至关重要,在神经退行性疾病中其稳态平衡被打破。在病理条件下,如阿尔茨海默病(AD)中,过度磷酸化tau如何调控神经元-星形胶质细胞相互作用,仍不清楚。
2023年4月21日,华中科技大学朱铃强、鲁友明和辛辛那提儿童医院Guo Ziyuan 共同通讯在Science Advances 在线发表了题为“Tau pathology epigenetically remodels the neuron-glial cross-talk in Alzheimer’s disease”的研究论文,该研究在3×Tg小鼠、MAPT P301L (rTg4510)小鼠、AD患者和AD来源的iPSC中检测到腺苷受体1 (Adora1或A1R)异常升高。该研究结果表明,病理性Tau通过A1R促进神经元分泌Lcn2,激活星形胶质细胞,重塑神经元-胶质相互作用,导致学习记忆障碍和突触损伤。靶向A1R可能是治疗AD的潜在靶点。

阿尔茨海默病(AD)是老年人最常见的神经退行性疾病之一。AD的病理特征是细胞外β-淀粉样蛋白(Aβ)的积累和细胞内聚集磷酸化Tau蛋白(缠结)在大脑中的形成,并伴有突触功能障碍和神经元丢失。在临床上,AD最重要的表现是进行性认知能力下降。尽管许多实验研究表明,在AD发病过程中,Aβ和磷酸化Tau蛋白起着关键作用,迄今为止,AD的认知和突触功能障碍的详细机制尚不清楚。因此,探索阿尔茨海默病中病理性Tau蛋白对认知能力的影响,针对这些潜在分子途径开发药物,可能有助于阿尔茨海默病的治疗。
在中枢神经系统中,神经元被不同类型的非神经元细胞包围,如星形胶质细胞、小胶质细胞和少突胶质细胞。神经元和非神经元细胞之间的相互作用在协调大脑生理功能中起着至关重要的作用,并参与了多种神经系统疾病(如AD)的发病机制。Aβ增加星形胶质细胞的葡萄糖摄取和谷氨酸释放,然后诱导氧化应激和NMDA受体过度激活,导致突触紊乱。同时,Aβ刺激增加星形胶质细胞促炎因子的释放,随后引发神经炎症和神经元死亡。
最近的一项研究报道,星形胶质细胞衍生的载脂蛋白E颗粒通过转载并递送miRNAs特异性地抑制神经元中胆固醇的生物合成。所有这些证据都表明星形胶质细胞通过改变神经元-胶质相互作用在阿尔茨海默病的疾病进展中起关键作用。然而,神经元功能障碍,如tau病理,是否会干扰星形细胞稳态并参与阿尔茨海默病的神经退行性病变尚不清楚。
近年来,一些研究揭示了腺苷及其受体在多种神经系统疾病中发挥重要的调节作用。目前已鉴定出四种腺苷G蛋白偶联受体A1、A2A、A2B和A3,它们广泛分布于大脑,高度参与脑功能的许多方面,如学习记忆,神经元的损伤和变性。腺苷受体A1 (A1R)是一种在大脑中高水平表达的抑制性腺苷受体。生理条件下,A1R通过神经-小胶质串扰积极维持突触稳态,调节神经元活动。A1R的激活不仅会降低海马突触的可塑性,还会损害学习记忆能力。
在AD大脑中,检测到A1R蛋白增加,并伴有AD特异性病理改变。在恐惧记忆受损的5×FAD小鼠海马体中也观察到A1R的上调。A1R激活可导致神经元死亡,A1R拮抗剂可减轻tau ΔK280小鼠的轴突病变,这表明A1R在AD发病过程中起关键作用。咖啡因(一种非选择性A1R拮抗剂)对AD有保护作用,高咖啡摄入量可能通过减少病理性淀粉样蛋白沉积来改善AD患者的认知功能障碍。并且敲除A1R表达可以改善老年小鼠的炎症反应,这表明A1R的激活/上调在AD患者的神经元-胶质相互作用中起着至关重要的作用。
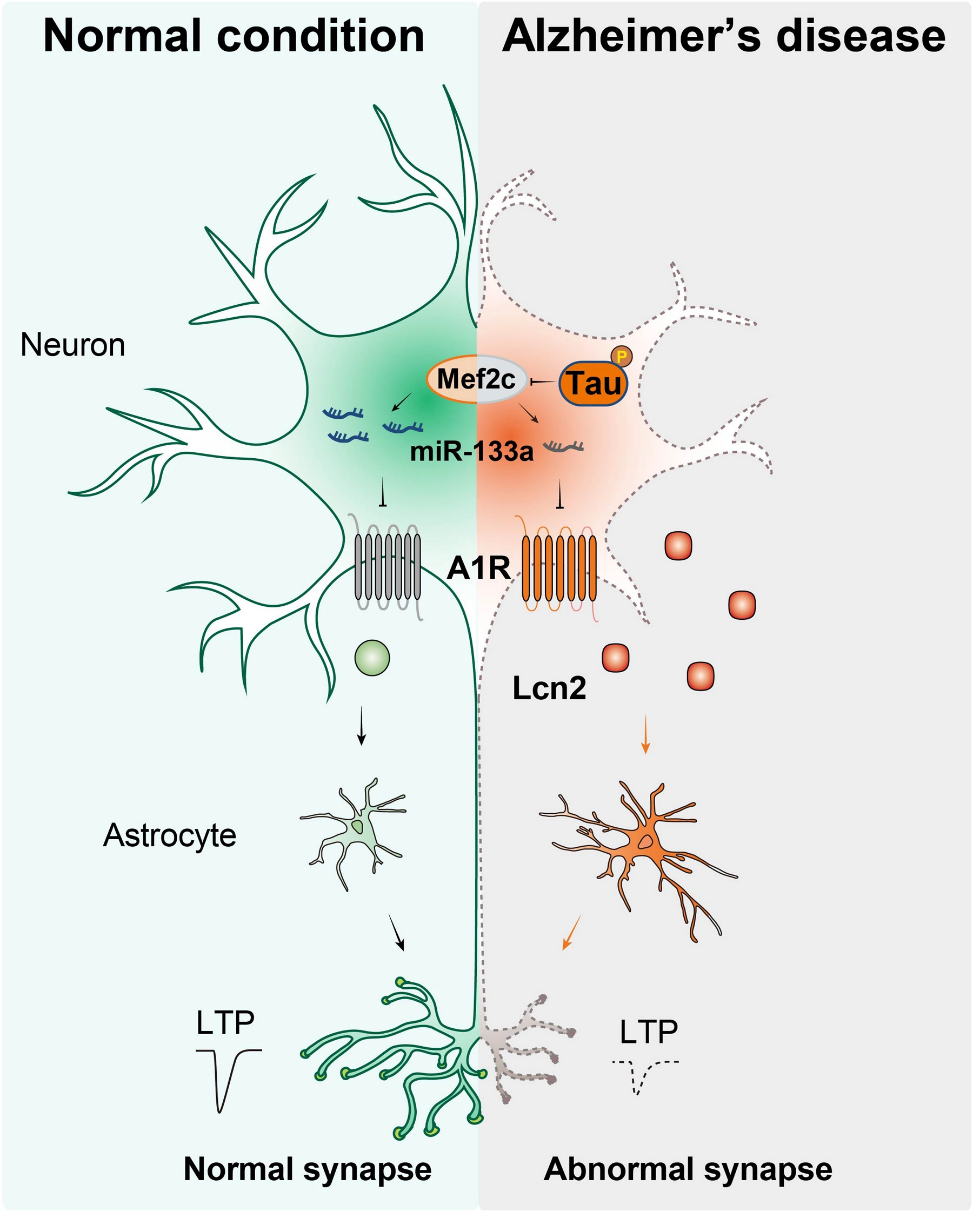
Tau蛋白导致阿尔茨海默病的潜在通路(图源自Science Advances )
该研究发现3×Tg小鼠海马、MAPT P301L (rTg4510)小鼠、AD患者大脑以及诱导多能干细胞(iPSC)衍生的AD神经元中A1R蛋白水平上调。但其mRNA表达在AD中并无改变,进一步通过体内外实验,表明Tau通过Mef2c/miR-133a-3p在转录后水平调控A1R表达。该研究结果显示,A1R过表达的神经元的培养基刺激星形胶质细胞活化和炎症反应,这与AD大脑中观察到的现象相吻合。
在3×Tg小鼠中,通过shRNA沉默神经元A1R可显著减少星形胶质细胞的激活和促炎因子的表达,改善突触功能损伤和记忆障碍。通过对激光捕获技术分离的海马CA3神经元进行RNA测序(RNA-seq),发现A1R敲除(AKO)降低了神经元中脂质运载蛋白2 (Lcn2)的表达。最后,在3×Tg小鼠中,敲低神经元中Lcn2可有效抑制星形胶质细胞激活和炎症反应,缓解突触紊乱和认知功能障碍。该研究结果表明,A1R或Lcn2可能是AD治疗的潜在的药物靶点。
参考消息:
https://www.science.org/doi/10.1126/sciadv.abq7105
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言