Nature Metabolism:中国科技大学张智等团队发现压力大引起胃病的潜在机理
2023-08-23 iNature iNature 发表于上海
该研究发现胃直接接受迷走神经背动核(AChDMV)的乙酰胆碱能输入,该输入由中缝背核(5-HTDRN)中的血清素能神经元支配。
心理和生理压力源与人类胃部疾病有关。脑与胃之间的耦合机制是应激性胃功能障碍的根本原因。
2023年8月17日,中国科技大学张智及安徽医科大学陶文娟共同通讯在Nature Metabolism 在线发表题为“Brain regulation of gastric dysfunction induced by stress”的研究论文,该研究发现胃直接接受迷走神经背动核(AChDMV)的乙酰胆碱能输入,该输入由中缝背核(5-HTDRN)中的血清素能神经元支配。
显微内镜钙显像和多电极电生理记录显示,慢性应激伴胃功能减退,5-HTDRN→AChDMV→胃回路受到抑制。在雄性和雌性小鼠中,人工激活该回路可逆转由慢性应激引起的胃功能障碍。该研究表明,这条5-HTDRN→AChDMV→胃轴驱动与应激相关的胃功能障碍,从而为大脑调节胃的回路基础提供了见解。

日常生活压力的积累往往会导致胃肠功能障碍。功能性磁共振成像(fMRI)显示,与应激相关的功能性消化不良和肠易激综合征患者的脑活动异常,表明慢性应激(CS)状态下脑和胃之间存在串扰。然而,目前尚不清楚这是如何工作的。
先前的研究在胃中使用霍乱毒素或小麦胚芽凝集素-辣根过氧化物酶神经示踪剂,并发现胃和脑干之间的解剖联系。此外,药理学实验显示,几种不同的神经递质参与调节胃功能。值得注意的是,靶向操纵胃突神经元的追踪工具和策略的局限性阻碍了对脑-胃轴的精确细胞类型特异性组织及其潜在应激性胃功能障碍的功能的清晰理解。
该研究定义了5-HTDRN→AChDMV→胃回路,CS或AS通过该回路诱发胃功能障碍。这些过程的核心是涉及来自5-HT异常输入的回路机制DRN神经元到胃部投射的AChDMV处于应激状态的神经元。作者发现5-HTDRN输入减少会影响AChDMV神经元的活性,从而导致CS状态下的胃功能减退。根据这些累积证据,5-HTDRN神经元可以调节AChDMV神经元的活动,将应激反应传递到胃,从而导致胃功能障碍。
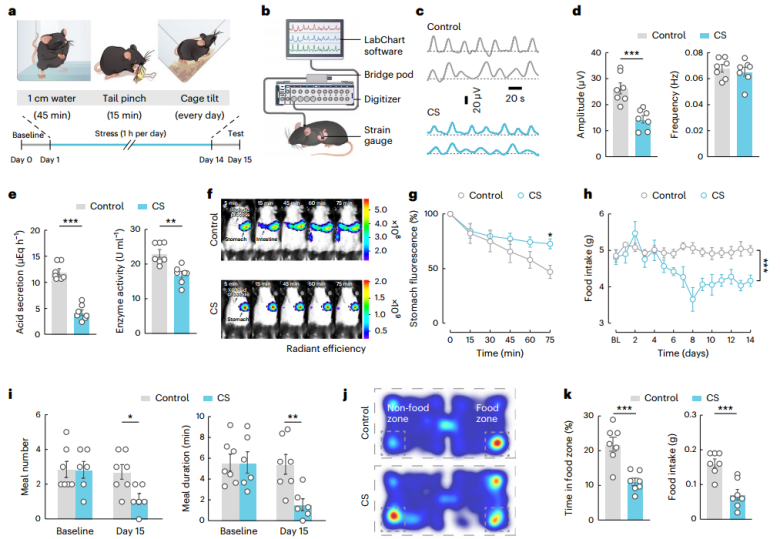
CS诱导的雄性小鼠胃功能障碍(图源自Nature Metabolism)
虽然尚未探究AS与CS如何差异调节5-HTDRN→AChDMV→胃回路的机制,但之前的一些发现值得考虑。先前的研究报道,AS导致去甲肾上腺素释放爆发,这已被证明可以激活5-HTDRN神经元中的Gαq偶联α1-肾上腺素能受体,从而增加其活性。相反,在CS中,下丘脑-垂体-肾上腺轴的持续激活会导致应激激素(如糖皮质激素)的过度释放。长期暴露于糖皮质激素可抑制神经发生,导致大脑树突萎缩和突触丧。因此,有理由推测,CS下小鼠糖皮质激素水平升高可能有助于降低该回路的活性。总之,该研究提供了一条新的脑-胃通路,该通路涉及应激对胃功能的负面影响,并可能加快后续脑和内脏器官之间联系的研究。
原文链接:
https://www.nature.com/articles/s42255-023-00866-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言