J Ethnopharmacol:西黄丸通过改善粘膜屏障损伤,抑制炎症细胞滤过,改善小鼠结肠炎
2023-11-23 网络 网络 发表于威斯康星
结肠炎的患病率正在上升,目前缺乏有效的治疗方案。西黄丸(XHP)及其主要成分已被证明具有对抗结肠炎的抗炎特性,然而,XHP治疗结肠炎的具体作用和潜在机制尚不清楚。本研究旨在研究XHP对结肠炎的潜在影响
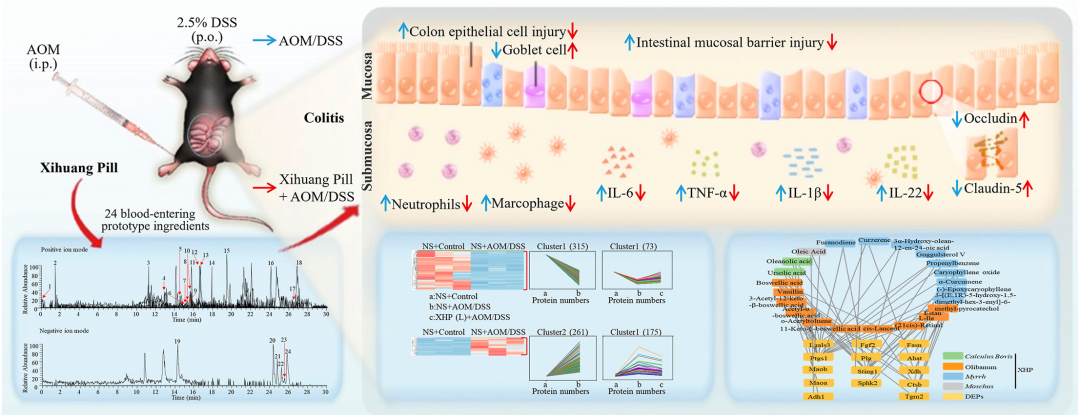
结肠炎的患病率正在上升,目前缺乏有效的治疗方案。西黄丸(XHP)及其主要成分已被证明具有对抗结肠炎的抗炎特性,然而,XHP治疗结肠炎的具体作用和潜在机制尚不清楚。本研究旨在研究XHP对结肠炎的潜在影响,并揭示相关的潜在机制。我们在C57BL/6N小鼠中建立了急性结肠炎模型,研究了模型对结肠组织中体重减轻、结肠长度、结肠黏膜屏障通透性、Claudin-5和Occludin表达、浸润MPO阳性细胞和CD68阳性细胞数量以及促炎细胞因子(IL-6、IL-22、IL-1β和TNF-α)含量的影响。在两周内通过灌胃低、中、高剂量(0.45、0.9和1.8 g/kg/天)的XHP进行小鼠给药。此外,通过定量蛋白质组学技术分析了对照组、结肠炎组和XHP低剂量给药组小鼠结肠组织中的蛋白质表达水平。采用HPLC/Q-TOF-MS技术对小鼠口服XHP后血液中吸收成分进行了全面的分析和表征,并将入血成分与蛋白质组学相结合,揭示了XHP抑制肠炎的机制。我们的研究结果表明,XHP缓解了结肠炎小鼠的体重减轻和结肠缩短。此外,XHP降低了结肠粘膜屏障通透性的增加并降低了Claudin-5和Occludin的表达,同时显著减少结肠组织中浸润的MPO阳性细胞和CD68阳性细胞的数量。我们发现XHP降低了结肠组织中促炎细胞因子的产生,包括IL-6、IL-22、IL-1β和TNF-α。药代动力学分析表明,XHP含有24种进入血液的原型成分,这些成分通过调节与粘膜屏障损伤和炎症相关的各种蛋白质(如Ctsb、Sting1和Abat)来改善结肠炎。XHP通过多种靶点和途径改善了肠粘膜屏障损伤,减少了MPO阳性细胞和CD68阳性细胞的浸润,为XHP作为一种潜在结肠炎治疗方法提供了支持。
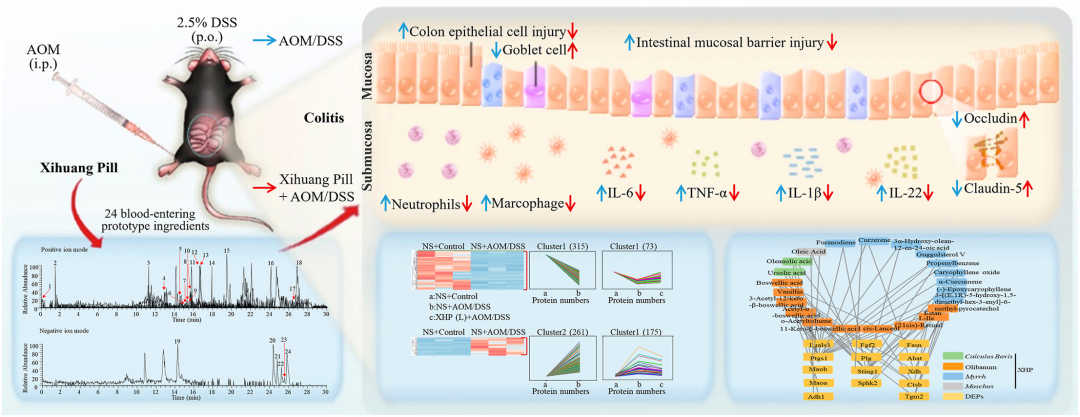



实验结果
1. XHP改善氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)诱导的结肠炎
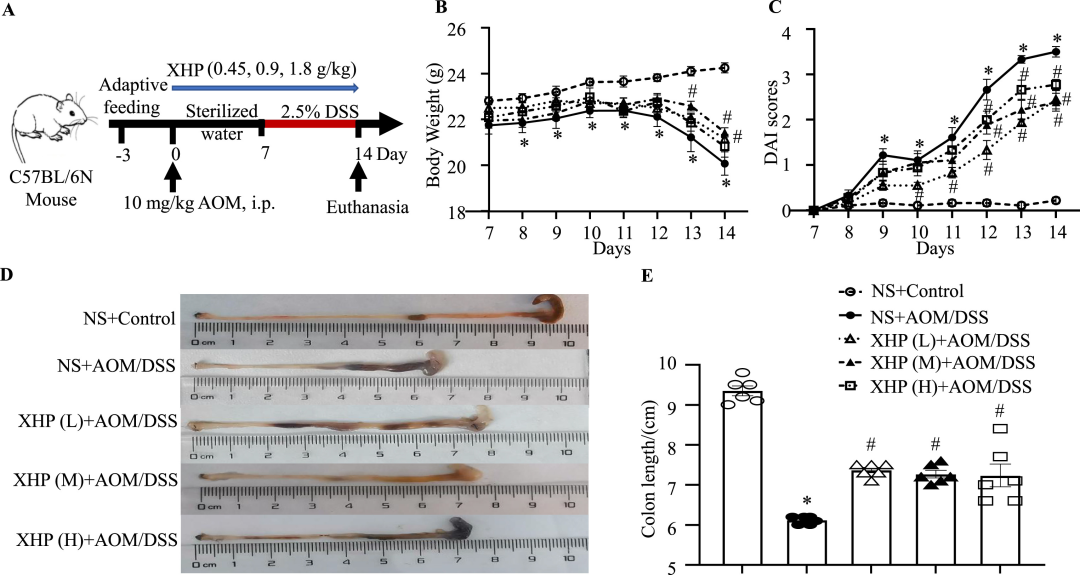

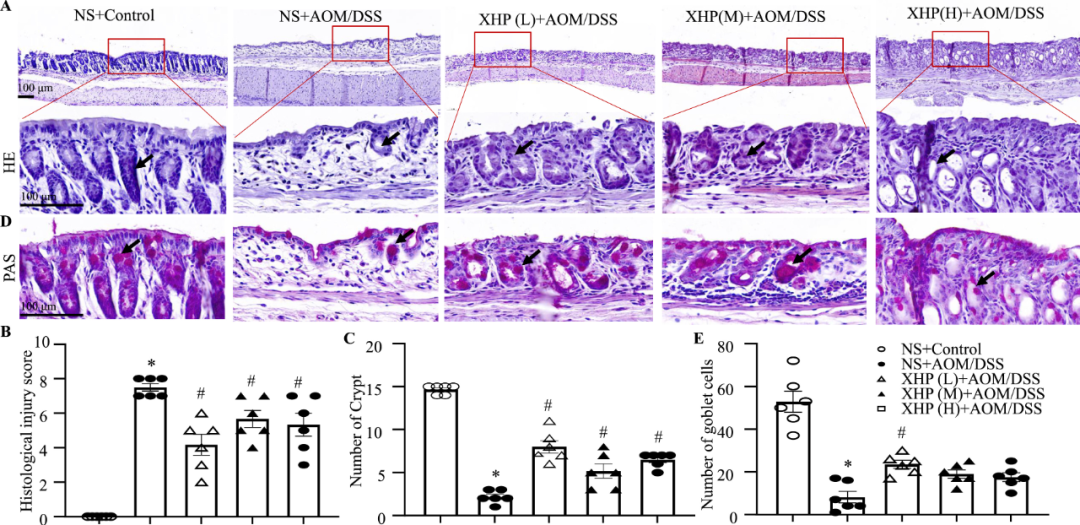

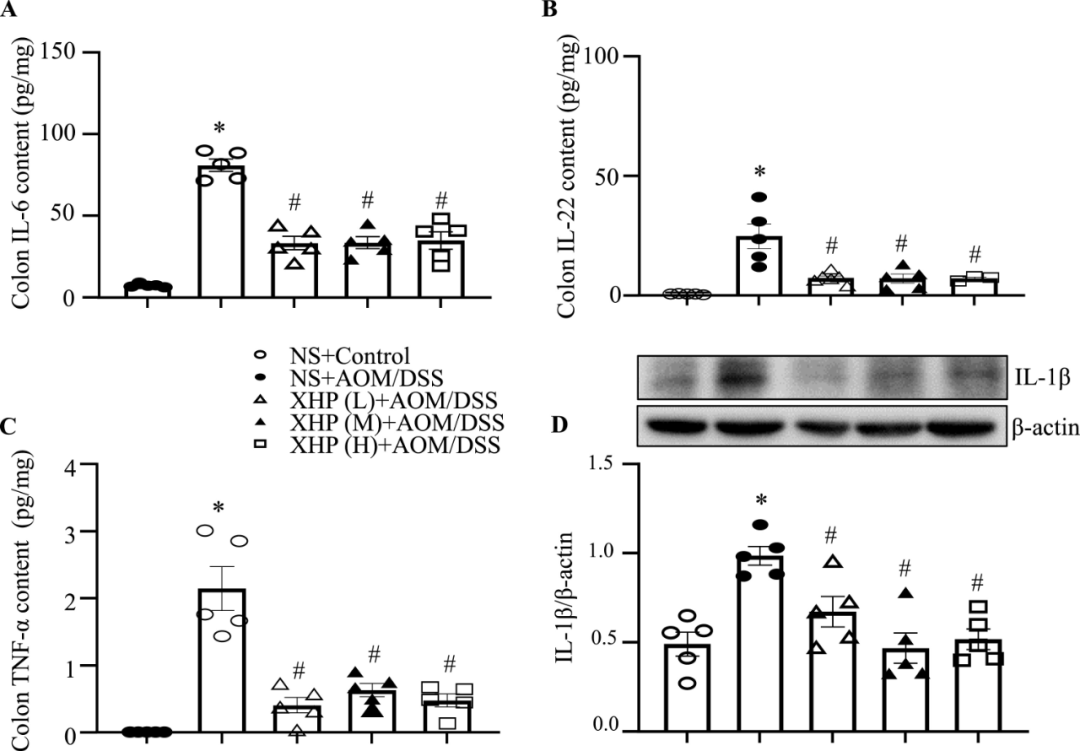
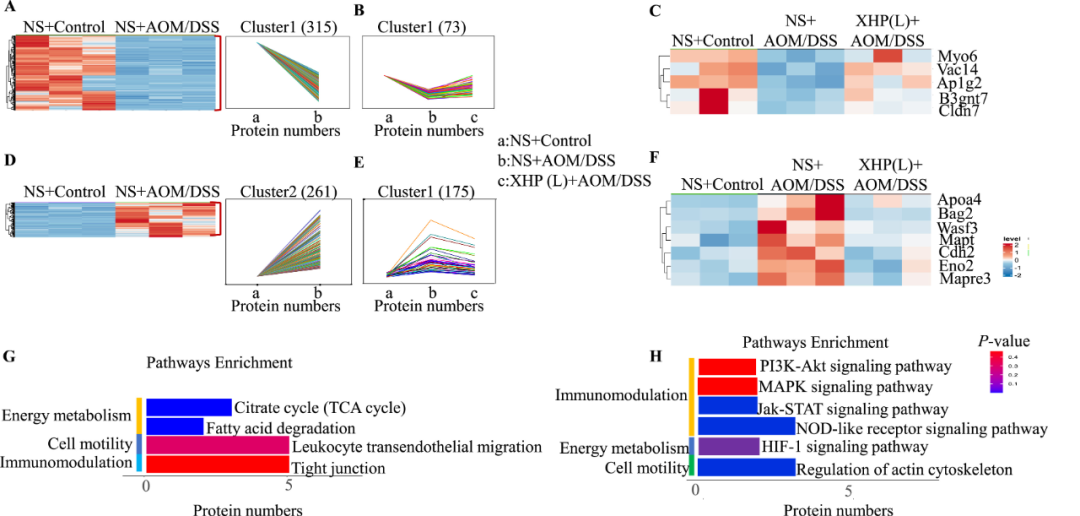
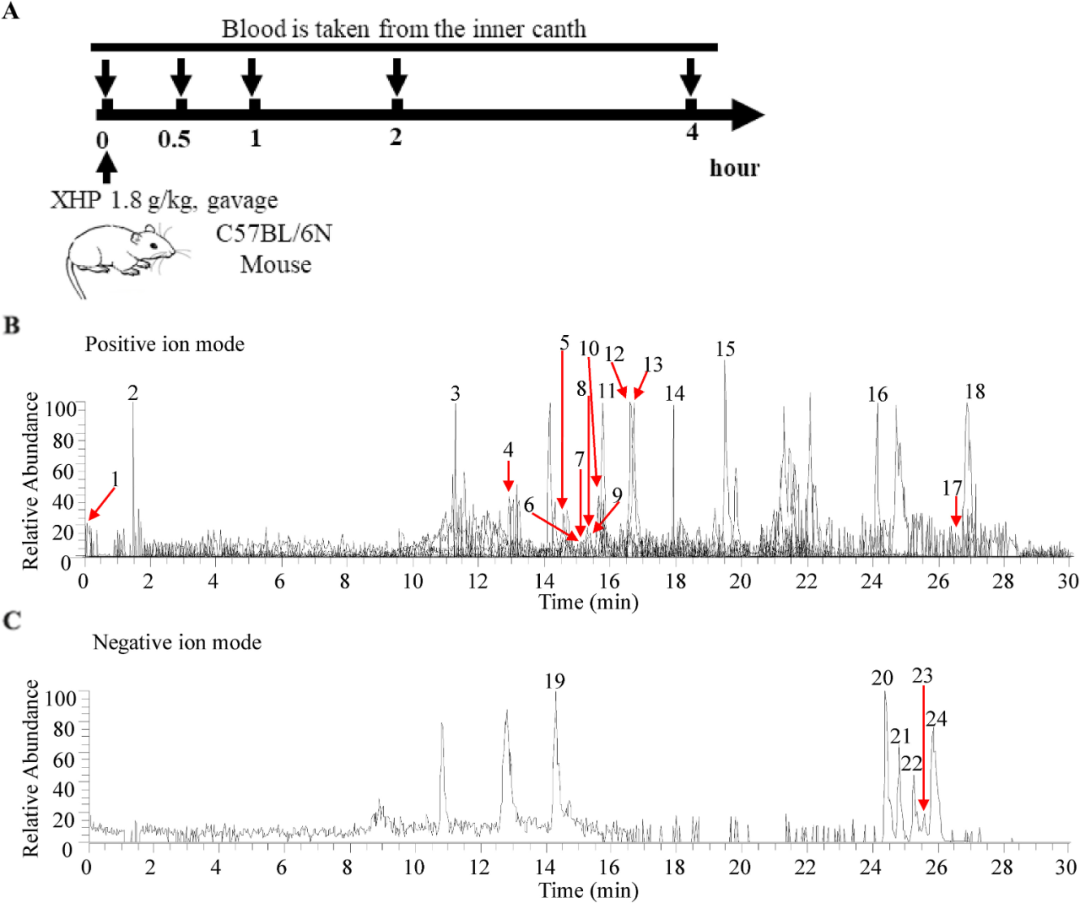
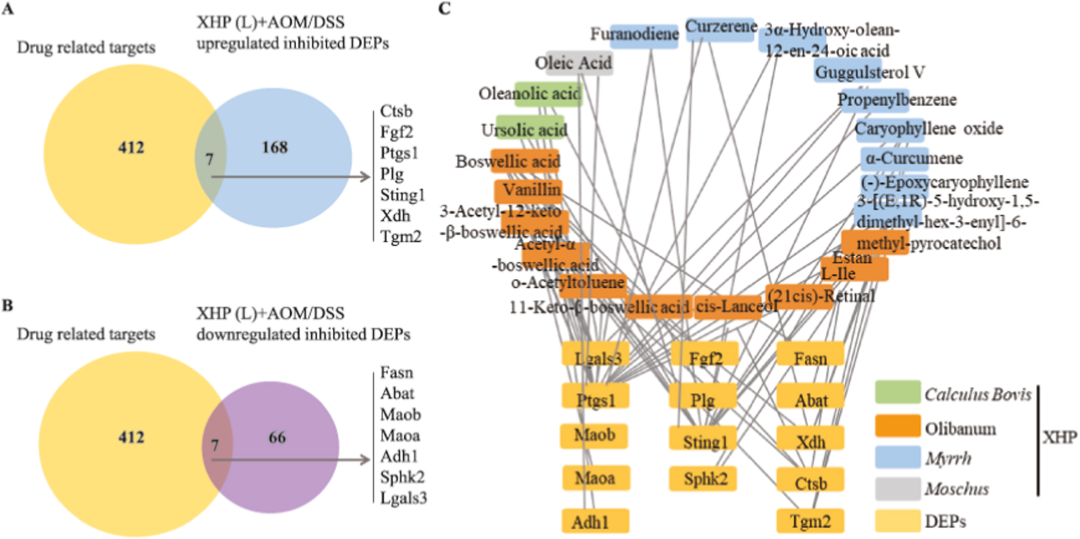
讨论
结论
https://www.sciencedirect.com/science/article/pii/S0378874123009662?via%3Dihub
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#结肠炎# #西黄丸# #粘膜屏障#
36