Cell Discovery:新突破:改良Cas13d实现高效的胞浆RNA靶向治疗
2024-04-16 生物探索 生物探索 发表于上海
该系统能够将核内的CRISPR RNA (crRNA)转移到胞质中,实现对胞质RNA的高效靶向。
引言
在现代生物技术领域,CRISPR/Cas系统已成为基因编辑的重要工具之一。特别是针对RNA的编辑,CRISPR/Cas13系统显示出巨大的潜力。Cas13家族中,Cas13d被认为是哺乳动物细胞中最活跃的亚型。然而,Cas13d在哺乳动物细胞的胞质(cytosol)中的活性不足,这限制了其在程序化抗病毒治疗等应用中的效率。由于大多数RNA病毒仅在胞质中复制,现有基于Cas13d的抗病毒方法的效果受限于核酸的不受控制泄漏。为了解决这一限制,4月12日发表于Cell Discovery的研究“Engineered, nucleocytoplasmic shuttling Cas13d enables highly efficient cytosolic RNA targeting”设计并开发了一种核质转运Cas13d (nucleocytoplasmic shuttling Cas13d, 简称Cas13d-NCS),该系统能够将核内的CRISPR RNA (crRNA)转移到胞质中,实现对胞质RNA的高效靶向。
通过对各种设计的穿梭蛋白(shuttling proteins)进行筛选和多种设计参数的评估,研究团队发现Cas13d-NCS在降解信使RNA(mRNA)和来自委内瑞拉马脑炎(Venezuelan equine encephalitis, VEE) RNA病毒的自复制RNA方面表现出色。进一步的实验证实,Cas13d-NCS能够完全阻断不同SARS-CoV-2株的复制。因此,Cas13d-NCS不仅为CRISPR系统提供了一种精确控制亚细胞定位的新策略,还为开发针对胞质RNA病毒的新型程序化疗法提供了可能。
该研究的成功在于对Cas13d进行的精确分子改造,通过在其结构上加入核定位序列(nuclear localization sequence, NLS)和核输出序列(nuclear export sequence, NES),实现了其在核与胞质之间的自由转移。此外,通过系统地研究不同的NLS/NES比例,研究团队优化了Cas13d-NCS的设计,使其在保证足够的核内导入以结合crRNA的同时,也能有效地将其导出到胞质中,以提高靶向主要位于胞质的mRNA的效率。
总之,Cas13d-NCS的开发不仅为CRISPR技术的应用提供了新的维度,也展示了通过精确控制蛋白质亚细胞定位来提高疗效的前景。此外,Cas13d-NCS的应用潜力远不止于抗病毒治疗,还可能包括治疗各种RNA相关疾病,这标志着向更加精细化和定制化的分子生物工具和治疗策略迈出的重要一步。

Highlights
核质转运Cas13d的开发:研究中开发的核质转运Cas13d(nucleocytoplasmic shuttling Cas13d, Cas13d-NCS)能有效将CRISPR RNA(crRNA)从核内转移到细胞质,实现了在细胞质内靶向降解RNA。
提升对细胞质RNA病毒的抗病毒效能:该系统针对如委内瑞拉马脑炎(Venezuelan equine encephalitis, VEE)病毒和多种严重急性呼吸综合症冠状病毒2(SARS-CoV-2)的菌株显示出显著的抗病毒活性,能完全阻断这些病毒的复制。
潜在的临床应用前景:Cas13d-NCS展示了其在精确调控亚细胞层面RNA靶向和开发新型分子工具及治疗RNA相关疾病的巨大潜力。
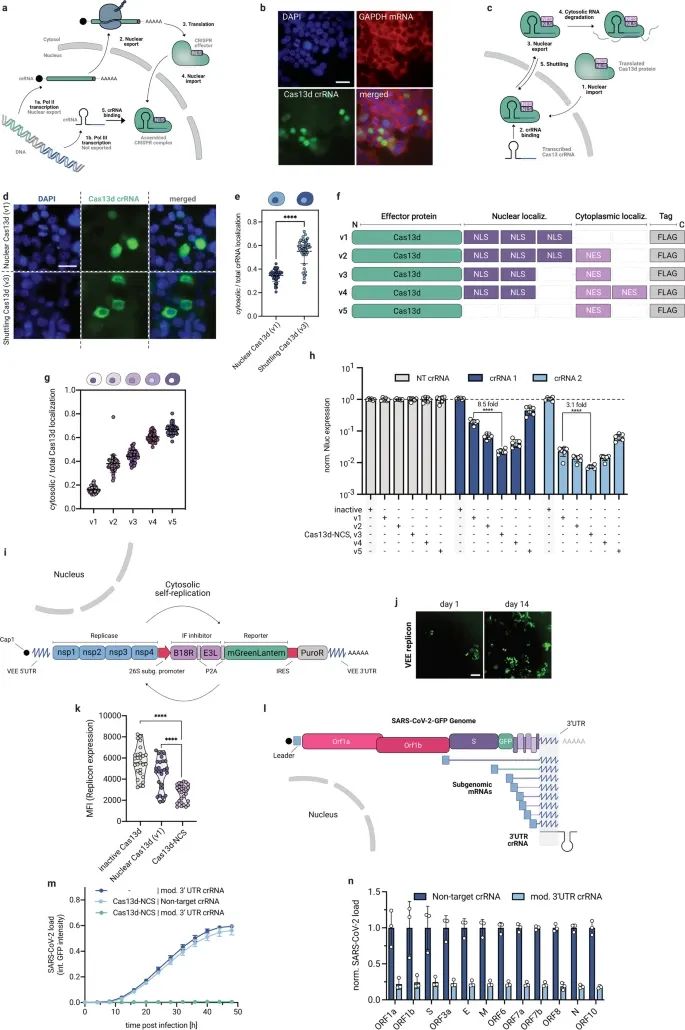
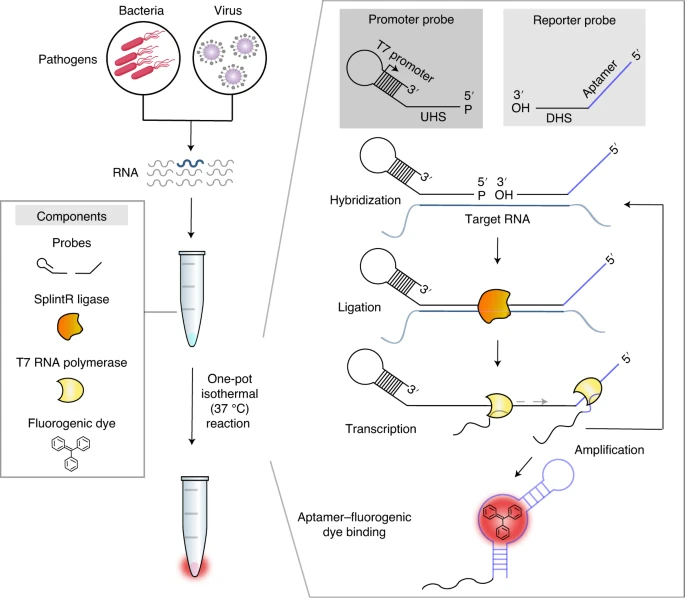
Cas13d-NCS(核-胞质穿梭型Cas13d)为高效靶向细胞质RNA和抗病毒设计的工程过程。
a. Cas13d蛋白及其crRNA在哺乳动物细胞中的表达和定位的示意图。Cas13d-NES在C端具有一个NES,对应于v5变体。
b. 使用RNA FISH染色技术,对表达核定位Cas13d-NLS(含3个NLS,即核定位序列,对应于f中的v1)的细胞中的crRNA及GAPDH mRNA进行染色的结果。
c. Cas13d-NCS的示意图,显示其如何将crRNA从核部运输到细胞质。
d. 与核型(v1)或穿梭型Cas13d(v3)共表达的由RNA聚合酶III表达的crRNAs的RNA FISH染色。
e. 对共表达的核型和穿梭型Cas13d的细胞中细胞质/总crRNA染色强度的定量分析。
f. 不同NLS/NES组合的Cas13d穿梭构建的示意图。
g. 不同变体v1-v5的Cas13d蛋白在细胞质/总蛋白染色强度的定量分析。
h. 比较了Cas13d变体v1-v5在纳米荧光素酶表达抑制方面的效果。
i. VEE病毒报告子复制体的示意图。
j. 短期和长期培养后表达复制体的细胞的荧光成像。
k. 使用流式细胞术比较核型和穿梭型Cas13d-NCS在靶向复制体效率上的结果。
l. 针对单一3'UTR crRNA靶向的SARS-CoV-2-GFP报告病毒和病毒转录组的示意图。
m. 在不同靶向条件下通过整合GFP强度实时测量SARS-CoV-2-GFP病毒载量。
n. 在用Cas13d-NCS和靶向或非靶向3'UTR crRNA处理48小时后,通过RNA测序分析SARS-CoV-2(Delta)亚基因组mRNA表达。(Credit: Cell Discovery)
Strategies
在该研究中,研究人员面临的主要问题是Cas13d蛋白在哺乳动物细胞内的活性主要局限于细胞核,这限制了其在RNA病毒靶向中的应用。为了解决这一问题,研究团队设计了一种能够在核质之间穿搭的Cas13d,称为核质穿搭Cas13d(Nucleocytoplasmic Shuttling Cas13d, 简称Cas13d-NCS)。这种新型Cas13d可以将位于细胞核中的crRNA(CRISPR RNA)转移至细胞质中,进而在那里与目标RNA结合并降解它们。
具体方法上,首先是对Cas13d蛋白进行遗传工程改造,添加了核定位信号序列(Nuclear Localization Sequence, NLS)和核输出信号序列(Nuclear Export Sequence, NES)。通过这些序列的配置,改进后的Cas13d能够与crRNA在细胞核中形成复合体,然后通过NES将其运输出核,实现在细胞质中的活性。
研究团队通过各种设计的蛋白质搭配版本进行筛选,并对系统最佳表现的设计参数进行了进一步研究。他们发现,Cas13d-NCS在细胞质中对mRNA以及来源于委内瑞拉马脑炎(VEE)病毒的自我复制RNA的降解效率远超传统的核定位Cas13d。
此外,通过流式细胞术比较了不同Cas13d变体对RNA病毒靶向的效能,结果显示Cas13d-NCS能够显著提高对细胞质RNA的靶向和降解效率。最终,这种新型Cas13d被用于阻断不同SARS-CoV-2毒株的复制,显示出其在开发RNA病毒靶向治疗上的巨大潜力。
总的来说,Cas13d-NCS的开发不仅优化了Cas13d的亚细胞定位,也大大提高了其在RNA病毒防治中的应用潜力,为使用CRISPR技术进行细胞精准RNA靶向提供了新的策略。
Behind the Scenes
Cas13d 在 RNA 靶向中的传统应用及其局限性
传统应用
Cas13d 是一种 CRISPR/Cas13 系统中的编程工具,被广泛用于 RNA 靶向操作。Cas13d 被认为是在哺乳动物细胞中最活跃的 Cas13 亚型,用于各种 RNA 靶向应用,如抗病毒治疗。尤其在抗病毒领域,近期研究显示 Cas13d 能够针对多种人类 RNA 病毒展现出抗病毒潜力。
局限性
尽管 Cas13d 在 RNA 靶向技术中具有前景,其在细胞质中的活性却非常有限,主要局限于细胞核内。这一限制显著影响了其在编程抗病毒治疗中的应用,因为大多数 RNA 病毒都在细胞质中复制。这意味着现有基于 Cas13d 的抗病毒策略主要依赖于核酸的不受控制泄漏,从而限制了其效率。此外,Cas13d 导向 RNA (crRNA) 的核定位是 Cas13d 偏好核内活性的根本原因。由于 mRNA 在转录后会迅速被运输到细胞质,传统的 Cas13d-NLS (Nuclear Localization Sequence) 系统在识别和绑定目标 mRNA 的时间窗口非常短暂。
Cas13d-NCS在胞质中的RNA靶向效率
Cas13d-NCS的胞质转运机制
Cas13d-NCS是通过对Cas13d蛋白(Cas13d)进行工程改造,使其能够在细胞核和胞质之间穿梭(nucleocytoplasmic shuttling),从而改善其在胞质中的活性。这种改造使Cas13d-NCS能够将原本主要在细胞核中的CRISPR RNA(crRNA)有效转移到胞质中,增强其识别和降解胞质RNA的能力。Cas13d-NCS通过结合核定位序列(nuclear localization sequence, NLS)和核输出序列(nuclear export sequence, NES)来实现这一功能。
Cas13d-NCS在胞质中的表现
在体外实验中,Cas13d-NCS显示出比常规Cas13d(Cas13d-NLS)更高的胞质RNA靶向和降解效率。特别是在对委内瑞拉马脑炎(VEE)病毒的RNA复制体进行靶向时,Cas13d-NCS展现出显著的RNA降解能力。此外,流式细胞术的数据显示,与常规Cas13d相比,Cas13d-NCS在胞质中的靶向和降解效率显著提高。
抗SARS-CoV-2和其他RNA病毒的潜力
Cas13d-NCS在抗病毒应用中表现出极高的潜力。通过靶向SARS-CoV-2病毒的3'非翻译区(3'untranslated region, 3'UTR),Cas13d-NCS成功阻断了多种SARS-CoV-2毒株的复制。研究中还利用实时荧光显微镜跟踪了48小时内SARS-CoV-2-GFP病毒载体的感染过程,结果显示Cas13d-NCS能完全阻止病毒复制。这证明了Cas13d-NCS在胞质中靶向和降解病毒RNA的能力,为其作为一种可编程抗病毒疗法提供了实验依据。
潜在的局限性
效率依赖性:虽然Cas13d-NCS在细胞实验中显示出较高的效率,但其在不同细胞类型中的普适性和效率尚未详细报告。不同细胞类型可能因为核质运输机制的差异而影响Cas13d-NCS的功能。
安全性问题:尽管研究中进行了初步的靶向精确性分析,但长期的生物安全性和潜在的非靶向效应(off-target effects)还需要进一步研究。尤其是当考虑将此技术应用于临床治疗时,非靶向效应可能导致未预见的生物学后果。
系统的复杂性:该研究中的Cas13d-NCS系统需要精确设计和优化多种生物分子,包括不同比例的核定位序列(nuclear localization sequence, NLS)和核输出序列(nuclear export sequence, NES)。这种系统的构建和验证增加了研究的复杂性。
技术转化的挑战:虽然该系统在体外实验中表现良好,但其在体内模型中的表现和实际应用还需进一步验证。体内环境的复杂性可能影响Cas13d-NCS的效率和稳定性。
成本和可接受性:开发和生产具有特定设计的Cas13d-NCS可能涉及较高的成本和技术要求,这可能限制了其在低资源环境下的广泛应用。
潜在的研究方向
优化Cas13d-NCS的设计:尽管当前的Cas13d-NCS表现出优越的细胞质靶向能力,但仍存在进一步提高其稳定性和靶向准确性的空间。未来的研究可能会探索更多的核定位序列 (nuclear localization sequence, NLS) 和核出口序列 (nuclear export sequence, NES) 的组合,以找到更有效的配置。
广泛的病毒类型应用:该研究证明了Cas13d-NCS对SARS-CoV-2和委内瑞拉马脑炎病毒 (VEE) 的高效作用。未来可以扩展其应用到其他RNA病毒,如流感病毒和HIV,看看这种技术是否同样有效。
临床应用的研究:虽然该研究在体外细胞模型中取得了显著成效,但Cas13d-NCS在动物模型中的效果及其安全性仍需进一步验证。此外,探索如何将这种技术转化为实际的抗病毒疗法,例如通过适当的递送系统(如脂质纳米粒子)来保证治疗剂的稳定性和有效性。
副作用和脱靶效应的研究:尽管Cas13d-NCS对目标RNA的剪切效率高,但其潜在的副作用和脱靶效应 (off-target effects) 的研究也非常重要。需要更多的研究来评估其对宿主细胞的影响,确保长期应用的安全性。
与其他CRISPR系统的比较研究:比较Cas13d-NCS与其他CRISPR系统(如Cas9和Cas12)在不同细胞类型和条件下的效率和特异性,可能揭示更多关于这些系统工作机制的信息,也可能帮助开发出更为精确的基因编辑工具。
原文链接
Gruber C, Krautner L, Bergant V, Grass V, Ma Z, Rheinemann L, Krus A, Reinhardt F, Mazneykova L, Rocha-Hasler M, Truong DJ, Westmeyer GG, Pichlmair A, Ebert G, Giesert F, Wurst W. Engineered, nucleocytoplasmic shuttling Cas13d enables highly efficient cytosolic RNA targeting. Cell Discov. 2024 Apr 12;10(1):42. doi: 10.1038/s41421-024-00672-1. PMID: 38609360; PMCID: PMC11015019.
https://www.nature.com/articles/s41421-024-00672-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#RNA# #Cas13d# #Cas13d-NCS#
10