达沙替尼+泼尼松诱导和巩固治疗Ph+ ALL的中国2期研究发表,无化疗方案重塑治疗格局
2023-08-07 聊聊血液 聊聊血液 发表于上海
为进一步研究达沙替尼联合泼尼松作为新诊断Ph+ ALL的诱导和早期巩固治疗的疗效,主鸿鹄教授牵头了一项前瞻性、多中心、单臂研究,使用达沙替尼和泼尼松诱导和巩固治疗。
达沙替尼+泼尼松
导致BCR::ABL1的费城染色体(Ph)融合蛋白表达是ALL中最常见的染色体异常,儿童费城染色体(Ph+)ALL的频率为3%-5%,且随年龄增长而增加,成人达到20%-30%,50岁以上患者甚至高达50%。自2000年以来,TKI纳入强化化疗显著改善了临床结局,但还需要考虑化疗强度与依从性和安全性之间的平衡,而诱导和巩固治疗期间给予无化疗(chemotherapy-free)的靶向治疗,可减轻异基因造血干细胞移植(HSCT)的重度毒性和致死性并发症风险并降低移植相关死亡率。
为了减少治疗相关毒性,无化疗方案已成为Ph+ ALL治疗的新趋势,包括TKI+类固醇作为老年患者的诱导治疗(CR率为95%-100%,几乎无诱导死亡)和贝林妥欧单抗联合二代TKI作为诱导和巩固治疗,后者可实现更高的深度分子学缓解率(CMR,贝林妥欧单抗联合ponatinib的完全分子学缓解率为87%)和更好的生存获益(达沙替尼联合贝林妥欧单抗的18个月OS率为88%),进一步将Ph+ ALL治疗策略转向无化疗方案。主鸿鹄教授和金洁教授牵头于2020年发表的一项回顾性分析中,纳入13例接受达沙替尼和泼尼松作为诱导方案治疗的Ph+ ALL患者,该口服、无化疗方案可带来100%的CR率。
为进一步研究达沙替尼联合泼尼松作为新诊断Ph+ ALL的诱导和早期巩固治疗的疗效,主鸿鹄教授牵头了一项前瞻性、多中心、单臂研究(ChiCTR2000038053),使用达沙替尼和泼尼松诱导和巩固治疗,随后基于供者可用性和患者年龄,进行异基因HSCT、自体HSCT或化疗。还比较了首次缓解时接受或未接受移植患者的生存期,以确定移植在本方案中的作用和需求。研究结果近日发表于《British Journal of Haematology》,共同通讯作者为主鸿鹄教授、金洁教授和佟红艳教授。

研究设计
该研究为研究者发起的多中心、单臂、II期研究(ChiCTR2000038053),住在欧巴广告语达沙替尼/泼尼松作为口服、无化疗诱导和早期巩固方案治疗新诊断Ph+ ALL成人患者的疗效和安全性。主要终点是确定诱导完全缓解(CR),次要终点为整个人群的分子学缓解、无病生存期(DFS)、OS和安全性。
诱导(疗程I)第1-28天给予达沙替尼每日100mg,第1-21天给予泼尼松每日1 mg/kg/d,第22-28天给予0.5 mg/kg/d;未达到CR的患者再次接受疗程I作为第二次诱导。巩固治疗2个疗程(疗程Ⅱ和Ⅲ),第1-28天给予达沙替尼每日100 mg,第1-7天给予泼尼松每日1 mg/kg/d,CNS预防使用鞘内阿糖胞苷和地塞米松。
16-65岁的患者如果有HLA相合的供者(6/6或5/6 HLA相合同胞或8/8 HLA相合非亲缘供者)则行异基因HSCT;否则,根据临床医生的决定接受强化化疗,首选6个周期的hyper-CVAD化疗交替方案B(甲氨蝶呤1 g/m2 d1,阿糖胞苷1 g/m2 Q12H d2和d3)和方案A(环磷酰胺、多柔比星、长春新碱、地塞米松)。60-70岁患者化疗剂量减少1/3,70岁以上患者减少一半。
研究结果
患者
该研究共纳入中国15家中心的41例患者(表1),中位年龄为52.8岁。在73.1%的患者为p190显性BCR::ABL1亚型,在21.9%的患者为p210,在4.8%的患者为罕见类型。患者平均接受2.4个疗程的达沙替尼/泼尼松方案(疗程Ⅰ-Ⅲ)。30例行新一代基因测序,显示最常见的基因异常为IKZF1缺失,占30%(9/30)。其他包括CDKN2A突变、TP53突变和KMT2A重排,分别占6.7%(2/30)。1例患者为IKZF1plus表型(即与PAX5缺失、CDKN2A或CDKN2B缺失或两者相关的IKZF1)。由临床医生确定随访巩固治疗,包括Hyper-CVAD、VDP/VP或连续达沙替尼/泼尼松方案。17例患者接受了异基因HSCT,包括12例缓解后和5例骨髓复发后,此外1例缓解后行Auto-HSCT。
缓解
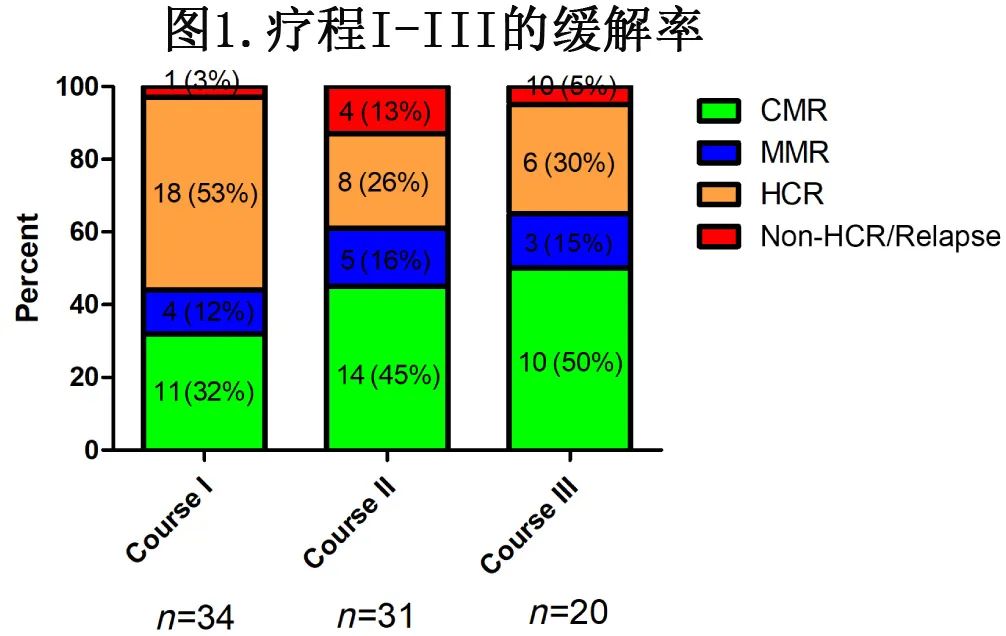
CR率为95%(39/41),包括2例老年患者(73岁和62岁)因严重感染在疗程I内死亡。在39例缓解者中,38例在第I疗程达到CR,1例在第II疗程达到CR。如图1所示,疗程I、II和III中分别对34、31和20例患者使用BCR::ABL1融合产物的定量RT-PCR进行MRD监测,到疗程III结束时,MMR和CMR分别为65%(13/20)和50%(10/20)(图1)。
无病生存期(DFS)和总生存期(OS)
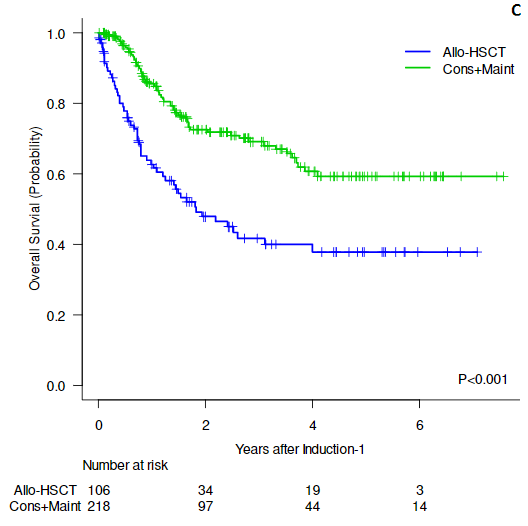
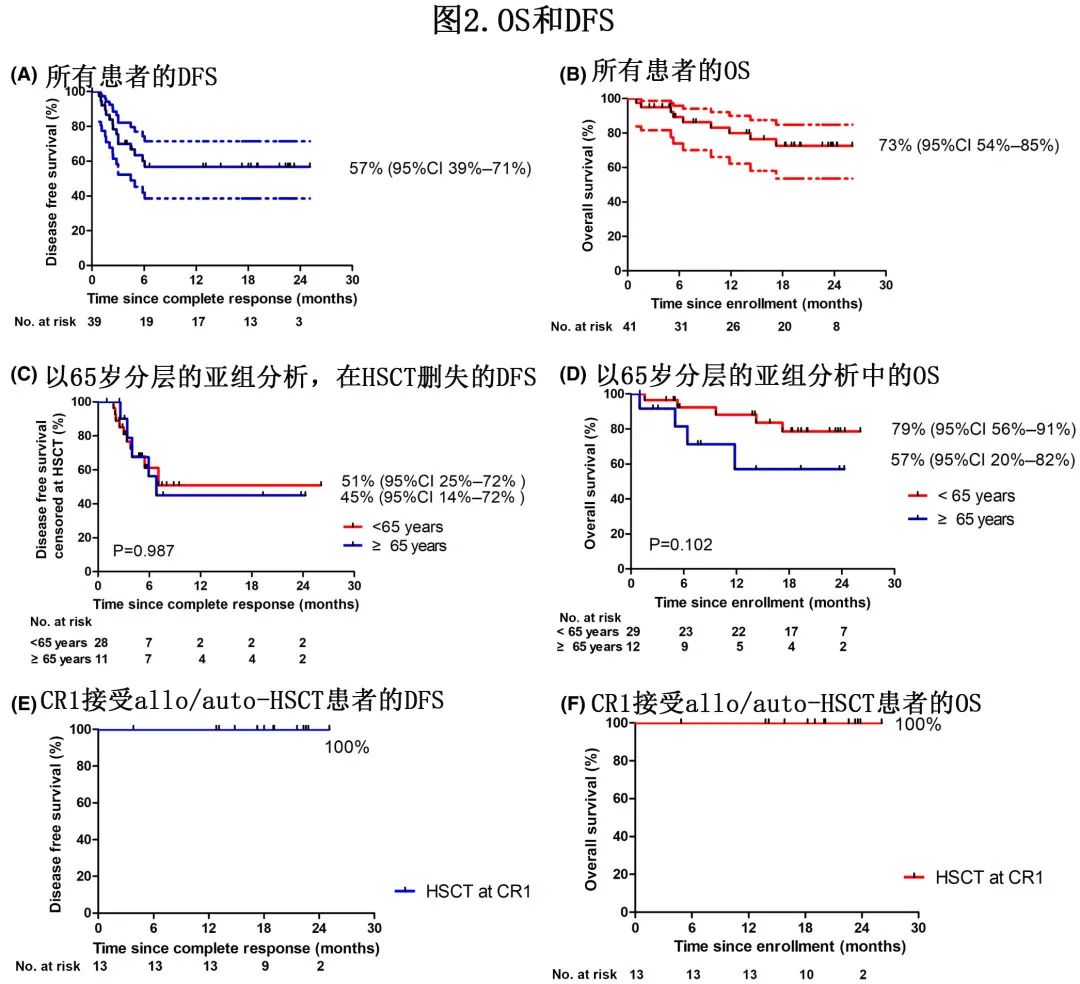
中位随访15.4个月,1年OS和DFS率分别为80%和57%;2年时分别为73%和57%(图2A,B)。在以65岁年龄分层的亚组分析中,年轻患者和老年患者在HSCT时删失时的DFS无显著差异(2年DFS 51% vs 45%,p=0.987;图2 C)。在CR1接受allo/auto-HSCT的患者2年时的DFS和OS分别为100%和100%(图2E,F),而非HSCT组2年时的DFS和OS分别为33%和45%。对于复发后接受HSCT的患者,2年OS为86%。
复发
有2例患者因依从性差停药时复发:1例53岁患者认为该疾病在疗程I后因血液学恢复而治愈,并停药;另一例16岁患者在疗程II期间因胸闷自行停药。12例患者出现骨髓复发,1例出现CNS复发;1例患者在疗程III时分子学复发,并在接受强化化疗后继续血液学缓解(图3,8号患者)。38%的患者(5/13)在疗程I和III之间发生早期复发,而62%的患者(8/13)在化疗巩固治疗内发生晚期复发(图3)。
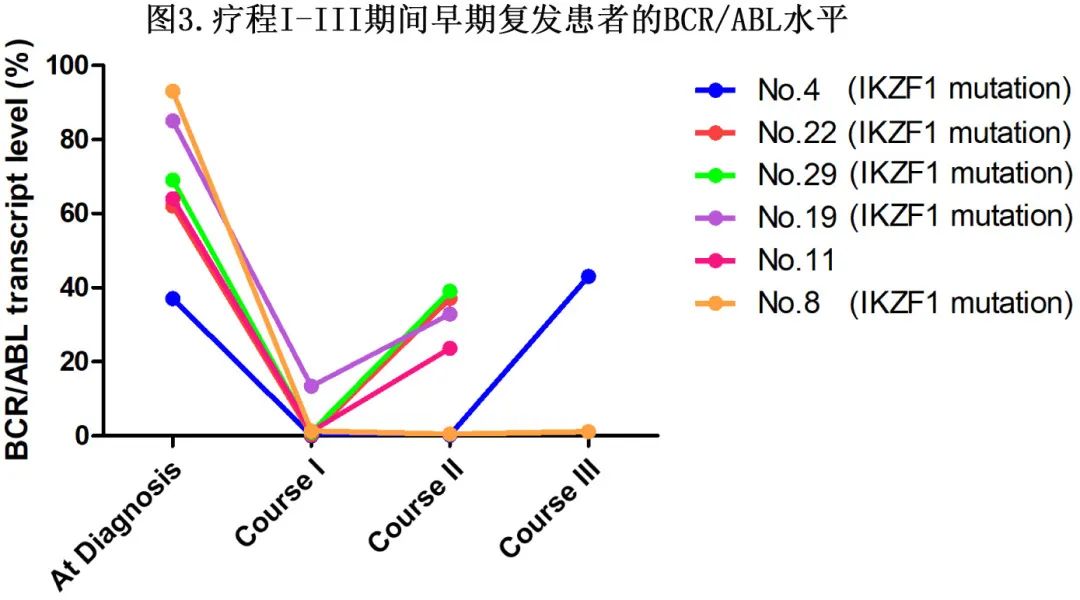
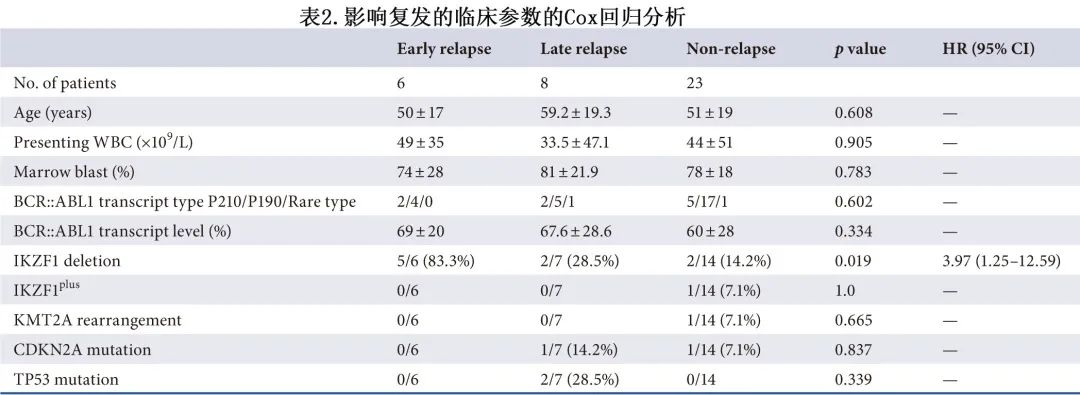
HSCT后无患者复发,无论是CR1时的HSCT还是首次复发后的HSCT。应用COX回归分析影响复发的潜在因素(表2)。IKZF1基因缺失与复发相关(风险比[HR]= 3.97,95%CI 1.25–12.59;p = 0.019);而年龄、诊断时白细胞计数、骨髓原始细胞、诊断时BCR::ABL转录类型或BCR::ABL转录水平与复发无关。
复发后的治疗
在检测ABL激酶结构域突变的12例骨髓复发患者中,100%的患者存在T315I突变。复发后的治疗包括ponatinib联合化疗(6/12,50%)、ponatinib联合维奈克拉、地塞米松(3/12,25%)和奥雷巴替尼联合化疗(1/12,8.3%)。复发后行异基因HSCT的5例患者中,1例患者在异基因HSCT后死于急性移植物抗宿主病和严重感染,其余4例患者在接受异基因HSCT后出现持续缓解。8例未行异基因HSCT的复发患者中,6例死于疾病进展。
安全性
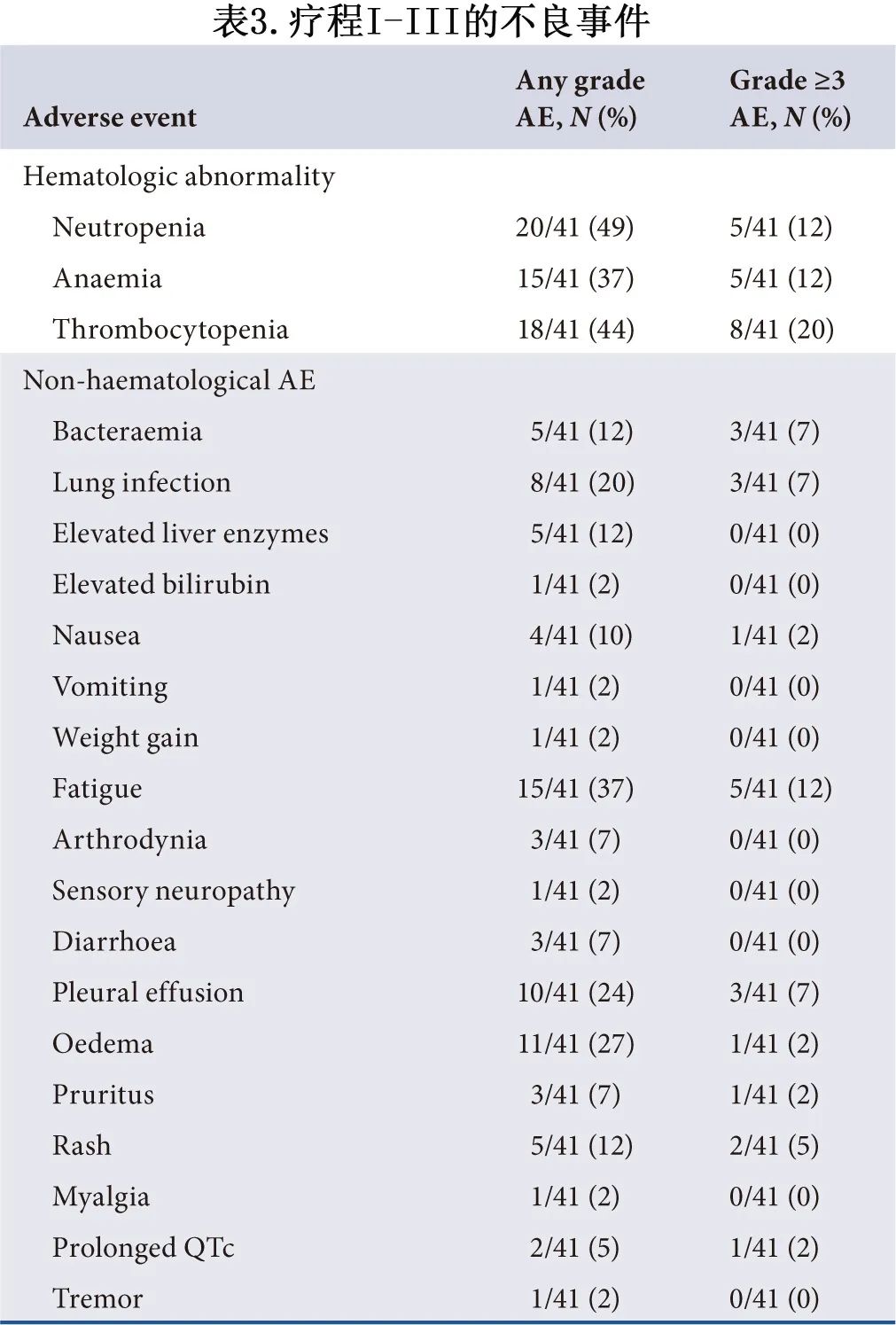
如表3所示,血液学异常是疗程I和疗程III之间最常见的AE。大多数非血液学AE为1级和2级,最常见的≥3级非血液学AE为疲乏(5/41,12%)、菌血症(3/41,7%)、肺部感染(3/41,7%)、胸腔积液(3/4,7%)和皮疹(2/41,5%)。大多数患者可耐受达沙替尼的剂量;2例患者因3级和4级胸腔积液减少达沙替尼剂量,1例患者因3级QTc延长停用达沙替尼。值得注意的是,在疗程I期间,有2例老年患者因AE死亡:1例62岁患者在诊断时身体状况较差,ECOG评分为3,诱导治疗25天后血象恢复且身体状况显著改善,但在诱导的第4周期间血液感染马尔尼菲青霉菌,最后死于败血症休克。另一例73岁患者在治疗前发生肺部感染伴氧合不良(血氧饱和度仅为90%),疗程I期间肺部感染无法治愈,死于重度肺炎。除1例复发后死于异基因HSCT并发症外,无其他治疗相关死亡。
总结
该2期研究表明,达沙替尼联合泼尼松作为一种无化疗诱导和早期巩固方案,治疗新发Ph+ ALL的CR率为95%,包括2例有并发症的老年患者诱导期间死亡,表明无化疗诱导和早期巩固方案治疗新发Ph+ ALL有效且耐受性良好。此外CR1异基因HSCT在该方案后具有明确的生存优势,2年PFS和OS为100%。在HSCT时删失时,年轻和老年患者的2年DFS分别为51%和45% (p=0.987)。未HSCT、复发后接受HSCT和CR1时接受HSCT的患者的2年总生存率分别为45%、86%和100%。共有12例患者发生骨髓复发,1例发生CNS复发,38%发生在早期(疗程I和III之间)。IKZF1基因缺失与复发相关(p=0.019)。
总的来说,该方案在初治Ph+ ALL中具有良好的疗效和良好的耐受性,且CR1时行异基因HSCT在无化疗诱导后具有明确的生存优势。
专家评论
MD安德森癌症中心Fadi G. Haddad教授等对该研究发表评论文章认为,Ph+ ALL的治疗策略正在从强化化疗联合治疗转向新一代TKI的无化疗方案,对造血干细胞移植(HSCT)的依赖性降低。除上述研究外,还有多项研究评估TKI联合皮质类固醇或贝林妥欧单抗的无化疗方案的作用(下表)。
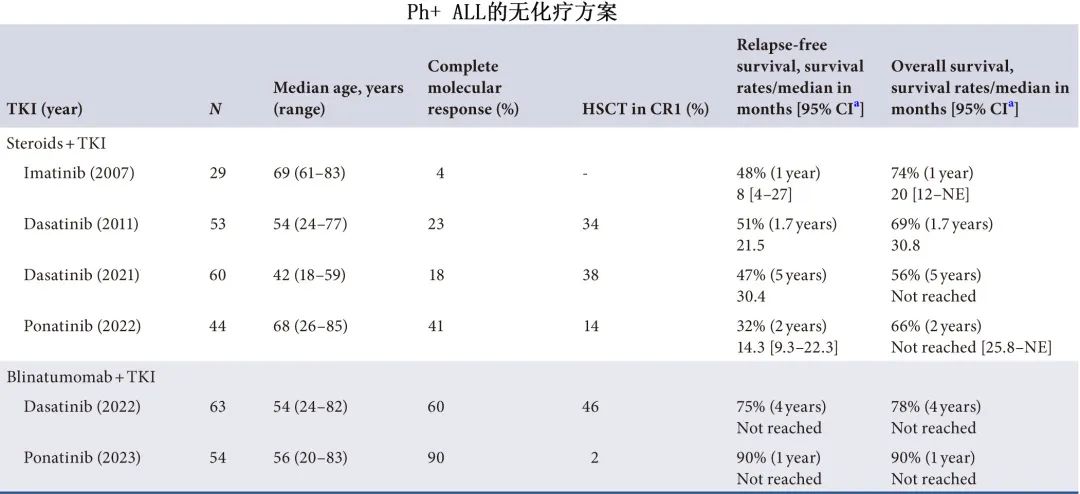
在新诊断Ph阳性ALL患者中,皮质类固醇联合TKI是可行的,但与强化化疗联合治疗相比,它们的CMR和长期生存率稍差,对于大多数没有适当移植巩固策略的患者,单独治疗可能不够。该方案可保留用于不适合强化化疗的患者,或在资源匮乏的环境中无法获得更新和更有效治疗的患者。贝林妥欧单抗联合TKI的无化疗方案在新诊断Ph+ ALL患者同样令人鼓舞,尤其是联合ponatinib时。
那么如何解读这些数据呢?它们强调了在使用无化疗方案的Ph+ ALL管理中的范式转变,避免了强化化疗的毒性并减轻了HSCT的需求。作者倾向于使用ponatinib而非第二代TKI,因为CMR率更高(与更好的生存率相关),并且其可抑制T315I突变出现。在一线治疗中,联合使用贝林妥欧单抗和ponatinib可以消除强化化疗和HSCT的需要,但还需要更长期的随访来确认这些缓解的持久性。尽管基于贝林妥欧单抗的联合治疗似乎更有效,但是在资源匮乏、贝林妥欧单抗不可用、不适合化疗和/或HSCT前诱导CR的患者中,可以使用TKI联合泼尼松,正如上述研究所强调的那样。
参考文献
Xie MX, Lu Y, Ouyang GF,et al. Dasatinib plus prednisone as induction and consolidation for adults with Ph-positive acute lymphoblastic leukaemia: A single-arm, multicentre, phase 2 trial.Br J Haematol . 2023 Jul 11. doi: 10.1111/bjh.18975.
Haddad FG, Kourie HR, Saleh K.Moving away from chemotherapy in newly diagnosed Philadelphia chromosome-positive B-cell acute lymphoblastic leukaemia.Br J Haematol . 2023 Jul 31. doi: 10.1111/bjh.19012.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言