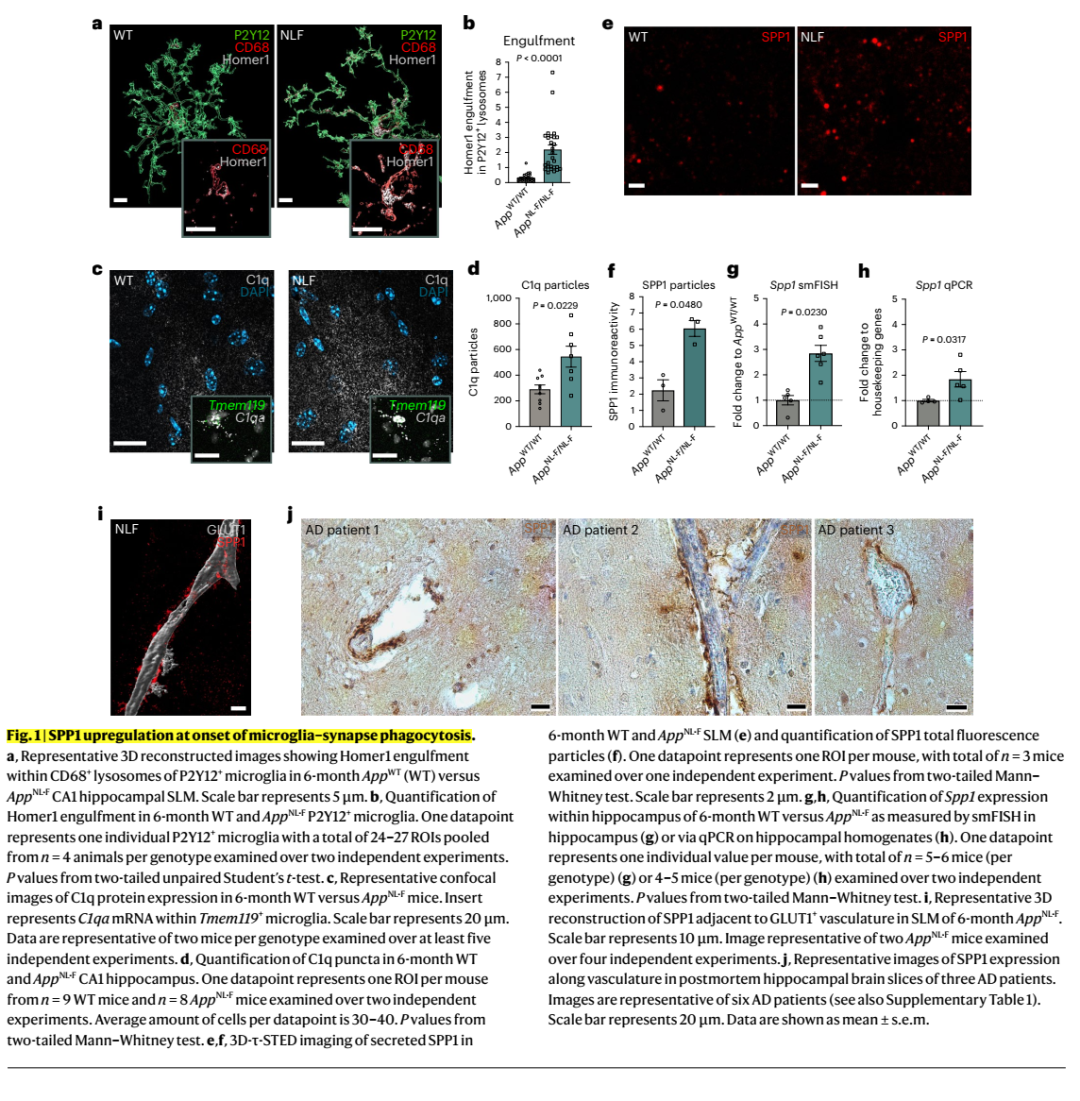
Neuron: 阿尔茨海默病中小胶质细胞的胞葬作用
2023-02-21 brainnew神内神外 brainnew神内神外 发表于安徽省
阿尔茨海默病 (AD) 是最普遍的痴呆类型,是一种神经退行性疾病,其特征是淀粉样蛋白β肽 (Aβ) 在淀粉样斑块中异常沉积以及在神经原纤维缠结中异常沉积 tau 蛋白。
全基因组关联研究和功能基因组学研究已将特定细胞类型、基因和途径与阿尔茨海默病(AD)风险联系起来。特别是AD风险等位基因主要影响巨噬细胞中表达的基因的丰度或结构,从而影响其活性,强烈暗示小胶质细胞(脑内巨噬细胞)与AD的病因有关。小胶质细胞是维持神经系统环境稳定的重要免疫细胞,通过研究阿尔茨海默病(AD)的相关基因变异以及基因在小胶质细胞中的功能影响对于阐明疾病风险机制和开发有效的治疗方法至关重要。
近期,《Neuron》期刊发表了题为“Microglial efferocytosis: Ping into the Alzheimer’s disease gene pool ”的综述,作者回顾了多种AD风险等位基因聚集在包括内吞/吞噬作用、胆固醇代谢和免疫反应等在核心巨噬细胞功能中起的关键作用的通路途径。重点介绍了在最新的AD遗传学和基因组学研究中发现的相关基因,且描述了它们是如何参与AD发病机制。
 阿尔茨海默病遗传学
阿尔茨海默病遗传学
阿尔茨海默病 (AD) 是最普遍的痴呆类型,是一种神经退行性疾病,其特征是淀粉样蛋白β肽 (Aβ) 在淀粉样斑块中异常沉积以及在神经原纤维缠结中异常沉积 tau 蛋白。除了这些经典的神经病理学特征外,Alois Alzheimer 还描述了与同名疾病相关的神经元丢失、明显的神经胶质增生(神经胶质细胞的增殖和“激活”)和脂质沉积(“类脂颗粒”的细胞内积累)。阿尔茨海默氏病 (AD) 是最普遍的痴呆类型,是一种神经退行性疾病,其特征是淀粉样蛋白β肽 (Aβ) 在淀粉样斑块中异常沉积以及在神经原纤维缠结中异常沉积 tau 蛋白。除了这些经典的神经病理学特征外,Alois Alzheimer 还描述了与同名疾病相关的神经元丢失、明显的神经胶质增生(神经胶质细胞的增殖和“激活”)和脂质沉积(“类脂颗粒”的细胞内积累),预测先天免疫系统和胆固醇代谢失衡在AD发病机制中的重要作用。
常染色体显性遗传性AD (ADAD) 占病例的<1%,主要由三个基因( APP、PSEN1 和 PSEN2)之一的突变引起,所有这些基因都参与淀粉样前体蛋白 (APP) 的蛋白水解加工以产生Aβ。淀粉样变性APP 加工与 AD 之间的遗传联系导致了淀粉样蛋白级联假说 (ACH) 的出现。该机制理论表明,淀粉样蛋白聚集和沉积是 AD 发病机制中的触发事件。尽管这是最流行的假设,但它经常被改动,而且目前还没有任何疗法(包括旨在减少Aβ生成和淀粉样蛋白积累的疗法)能够成功预防或减缓 AD 的发作或进展。散发性AD与遗传性且发病时间较早的ADAD相比,其大多数病例都是散发性AD。尽管散发性 AD 通常细分为迟发性 AD (LOAD) 和早发性 AD (EOAD),但遗传证据表明它们代表了一个连续的统一体,而不是两个不同的群体。例如,载脂蛋白 E (APOE) 是LOAD 和 EOAD两者的主要风险基因,其遗传模式更类似于半显性、中度外显性孟德尔疾病基因,而不是复杂疾病的全基因组关联研究 (GWAS) 确定的低风险常见等位基因。
此外,根据 LOAD 遗传关联研究生成的多基因风险评分 (PRS) 显示 EOAD 的富集程度更高,正如所预测的那样(遗传负荷较高的疾病发病年龄较早)。基于此,作者团队将在本次审查中提及 AD 而不是 LOAD/EOAD。ADAD 和 AD 共有临床和病理特征。虽然 ADAD 基因根据定义几乎完全外显,但这些家族中有一些个体表现出外显率降低的例子,例如PSEN1E280A哥伦比亚家族中APOE Christchurch 变异的携带者。
如上所述,APOE基因型具有中等外显性,导致频繁的家族聚集,而迄今为止发现的大多数其他 AD 风险等位基因具有低外显率 (比值比<2)。尽管外显率存在这些差异,但所有位点都具有因 果等位基因。在ADAD中,这些通常是特定基因的编码变异,而对于散发性AD,这些更常见的是特定基因调控元件(GRE,例如启动子和增强子)中的非编码变异,因此将这些变异与特定基因和功能结果联系起来更具挑战性。
迄今为止,GWAS 已在 75 个基因组区域(位点)中识别出与 AD 相关的常见变异(图 1), 阿尔茨海默氏病测序计划 (ADSP)生成并共享越来越多受影响和未受影响个体的全外显子组/全基因组序列 (WES/WGS),现在也可以识别稀有与AD相关的变异(MAF<0.01)。遗传变异(包括APOE基因)解释了70%的AD遗传性常,见和罕见的AD风险变异都集中在相似的细胞类型和途径上。更具体地说,它们中的大多数影响GRE、基因和生物过程,这些过程尽管不是唯一的,但对巨噬细胞至关重要。在本综述中,作者团队将重点介绍它们对小胶质细胞功能的影响。
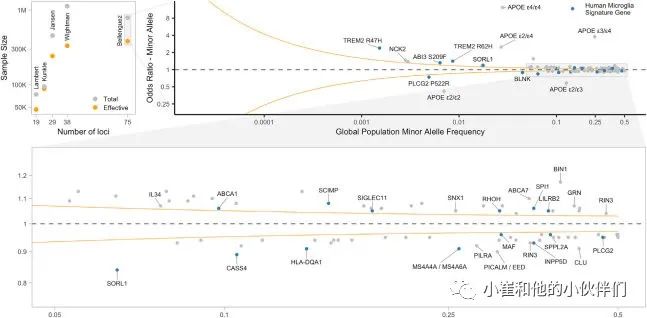 图1 AD/痴呆相关基因座中的人类小胶质细胞标志基因
图1 AD/痴呆相关基因座中的人类小胶质细胞标志基因
人类遗传学和功能基因组学方法
微阵列技术的发展使人类群体规模的遗传关联分析成为可能。微阵列技术用于快速、廉价地对基因组中数十万至数百万单核苷酸多态(SNPs)进行基因分型。GWAS使用SNP阵列或WES/WGS基因型数据来测试不同表型的人之间变异的等位基因频率的差异。GWAS的目标是识别与特定特征或疾病相关的变异。SNP阵列利用了共同的变体在称为单倍型的组中一起遗传(即处于连锁不平衡[LD])的这样一个事实,这种遗传结构允许单个变体对整个单倍型进行“标记”,并根据参考人类基因组序列高精度地归因于相关的变体。
GWAS SNP阵列中使用的群体参考板已经增长到包括更大密度的变异和更广泛的等位基因频率。例如,TRANS-OMICS for Precision Medicine(TOPmed)包括来自不同种族人群的200,000多个参考样本和7.81亿个变异位点。使用微阵列基因分型技术,大型的、更具种族多样性的参考小组已经能够对低频和稀有变异进行归类。
虽然取得了进展,但仍然存在严重差距。GWAS主要在欧洲血统的人群中进行,因此最常见的与AD相关的单倍型可能已经在该人群中被识别出来。然而,在非欧洲祖先中,样本量要小得多(在大多数群体中<5000例),因此,出于科学和公平的原因,这些群体中非常需要更大的SNP阵列GWAS。在欧洲血统样本中获得更大数据集的原因之一是包含了来自英国生物库和 23&Me 等生物库的数据。这允许纳入许多来自健康老年人的人口的控制,并开发了一种创新方法,该方法使用代理病例和基于有或没有痴呆家族病史的基因分型个人的控制。然而,虽然纳入以总体为基础的对照方法增加了总样本量,但提高GWAS的统计能力需要增加有效样本量--平衡样本设计(即50%病例和50%对照)中同等作用的GWAS的样本量。这反映在随着有效样本量而不是总样本量的增加,AD相关的基因座的总数增加(图1)。虽然这种代用表型与AD风险有显著的遗传性,但它不是相同的表型,因为这些代用病例包括其他类型的痴呆症,而代用对照可能遗漏了轻度痴呆。
值得注意的是,一些基因座只有在包括代理病例时才显示出全基因组的统计意义,而其他基因座则低于这一显著阈值,这表明代理病例利用了类似但不同的遗传风险架构。欧洲人AD的进展速度、药物开发背景下最相关以及神经成像和液体生物标记物测量在内的内表型,均未在大型GWAS中进行探索。
虽然基于SNP阵列基因分型的GWAS研究在识别与人类特征相关的常见单倍型方面非常成功,但它们在临床应用以及因果变异和基因识别方面存在局限性。大多数常见的SNPs效应较小,这限制了其临床预测价值。这个问题的一个潜在解决方案是通过根据风险等位基因的数量计算总体遗传负担,根据风险等位基因的数量,根据其影响大小估计进行加权。然而,目前使用的PRS方法还不能解释足够的遗传风险,使它们在临床上有用。GWAS发现的另一个限制是,与疾病相关的单倍型并不能准确定位因果变异和基因。单倍型内相关变异的LD使识别驱动疾病关联的因果变异变得困难。
此外,大多数常见的疾病相关变异映射到基因组的非编码区,使得很难识别介导其对疾病易感性的影响的基因。例如,最常见的与疾病相关的SNPs定位于GRE中,影响一段距离外的目标基因的表达水平。为了解决这些局限性,有必要对GWAs信号进行下游分析,以确定因果功能、调控变体及其目标因果基因,包括利用功能基因组数据的精细图谱和综合方法。
尽管SNP阵列正在改进以包括更多的变体,但可归因于SNP的集合仍然是GWAS的限制因素。识别与疾病相关的罕见变异的一种更准确的方法是直接对整个基因组或整个外显子进行测序。基于WES/WGS的GWAS旨在捕获所有的遗传变异,而不局限于使用微阵列进行基因分型或输入的SNPs。目前新一代测序的高昂价格是GWAS采用WES/WGS的限制因素。此外,我们在任何群体中检测罕见变异关联(微小等位基因频率<0.01)的能力很低,这是因为在非常大的队列中需要WGS/WES(见图1)。通过应用基于聚合的测试而不是单一变量测试,可以在一定程度上克服这一限制。例如,最常见的聚合方法是基于基因的测试,但也可以应用基于路径的测试。
GWAS确定了与AD相关的常见和罕见的变异,但这些方法往往没有识别变异影响的特定基因、细胞类型或组织,以调节疾病风险。为了解决这一缺点,综合基因组学方法将遗传数据与表观基因组、转录和蛋白质组数据相结合,以更好地了解变异的生物学效应及其如何影响感兴趣的性状表达(EQTL)研究将遗传和转录切割数据联系起来,以确定与附近(顺式eQTL)或远端(反式eQTL)基因表达水平相关的变体。重要的是,有必要使用孟德尔随机化等因果推理方法来支持这样的假设,即SNP的QTL效应是其对AD风险影响的中介。
已经开发了其他基因组方法来确定位于非编码区(例如,启动子和增强子)的变异对近端和远端靶基因表达的影响。这些方法侧重于测量组蛋白修饰或组蛋白可及性的变化,组蛋白修饰或组蛋白可及性直接与GRE的活性有关,并间接与其目标基因表达有关。染色质免疫沉淀和测序(CHIP-SEQ)确定基因组中与特定的组蛋白修饰和转录因子(TF)相关的区域。染色质的可及性通过转座酶可及染色质的测定来衡量,然后进行测序(ATAC-SEQ)以鉴定与转座酶和其他DNA结合蛋白结合的DNA。染色质环是通过染色质构象捕捉分析来测量的,如Hi-C。
分层LD分数回归(S-LDSC)是一种基于特定细胞类型的功能基因组注释来划分GWASNP遗传性的方法,已被应用于复杂疾病性状的候选因果细胞类型的提名。S-LDSC估计了全基因组SNP遗传性的比例,这是由位于功能基因组注释中的变异解释的,同时考虑了SNP中的LD。此外,它还调整了不特定于任何细胞类型的注释类,确保在存在的情况下观察到细胞类型的丰富。
人类遗传学和功能基因组学提示髓系细胞参与AD发病
遗传学研究一直表明先天性免疫系统的髓系细胞与阿尔茨海默病的病因有关。有相关研究发现,常见的AD风险等位基因在单核细胞而不是T淋巴细胞中对cis-eQTL的影响更丰富,这表明与AD相关的常见单倍型影响先天细胞而不是获得性免疫系统中的基因表达。其他研究发现,在220种细胞类型的注释集合中,外周髓系细胞(血液单核细胞和巨噬细胞)特有的表观基因组注释中显著丰富了与AD相关的常见非编码变体。使用组蛋白标记的CHIP-SEQ和ATAC-SEQ来识别增强子和启动子,这些增强子和启动子使用从四种主要脑细胞类型(神经元、星形胶质细胞、少突胶质细胞和小胶质细胞)分离的人核。他们确定,与AD风险相关的常见非编码变体特定富含小胶质细胞增强剂,没有证据表明其他脑细胞类型富含。这与精神疾病形成对比,在精神疾病中,浓缩更广泛地分布在所有四种测试的细胞类型中。对这一观察结果进行了扩展,表明常见的AD风险等位基因特异性地富含在单核细胞、巨噬细胞和小胶质细胞的活性(而不是稳定的)增强剂中。
这些观察结果有几个重要的含义。首先,虽然AD风险等位基因在包括小胶质细胞在内的髓系细胞特有的表观基因组注释中丰富,但这些丰富的程度在不同类型的髓系细胞中并没有太大差异,从而明确排除了外周髓系细胞或其他脑巨噬细胞与小胶质细胞相反的因果作用。其次,由于AD风险等位基因主要位于增强子中,由增强子调控的介导因果SNP对疾病易感性的影响的基因可能位于距离增强子一段距离的位置,甚至可能不在GWAS基因座之下,其启动子通过染色质环与因果增强子物理上的接近(图2)。第三,由于平均而言,一个增强子调控一个以上的基因,一个基因受到不止一个增强子的调控,在因果SNP影响其活性的增强子的调控影响下,AD风险SNP的因果效应可以由多个基因介导(例如,通过破坏TF的结合)。类似地,一个因果基因可以受到多个因果调节SNPs/增强子的影响,即使在不同的细胞类型或状态下也是如此。第四,由于常见的AD风险变异大多位于髓系特异性增强子中,AD风险基因没有必要在髓系细胞中特异性或高水平表达。是增强的调节活性,而不是基因表达水平,为髓系细胞提供了因果基因表达效应的特异性。例如,BIN1广泛表达于所有类型的脑细胞,但BIN1基因座上的先导SNP位于小胶质细胞特异性增强子内,仅影响BIN1在小胶质细胞中的表达,通过对该增强子诱导的多能干细胞(IPSCs)、神经元、星形胶质细胞及其衍生的小胶质细胞的实验操作证明了这一点。
因此,同样的基因在小胶质细胞/巨噬细胞中可能是因果的(即,介导因果SNP对AD风险的影响),但在神经元或其他类型的细胞中不是(图2)。应该指出的是,这些方法只能提名候选的因果变异/GRE/基因/细胞/通路。为了得出这些遗传和生物因素确实是因果关系的结论,将需要强有力的证据来证明,针对它们的实验干预(例如,在多个随机临床试验中使用旨在调节候选因果基因或通路的高选择性活性的药物)可以导致统计上和临床上显著的AD风险改变。

图2 常见AD GWAS SNPs的遗传风险机制
WES和SNP阵列GWAS研究发现,与其他脑细胞类型相比,小胶质细胞中高表达的基因中与AD相关的罕见编码变体,并在髓细胞中发挥重要作用。此外,在最近的AD GWAS中确定的候选因果基因中,22%也是人类小胶质细胞标志基因(图1)。总之,大量证据支持这样一种观点,即与AD相关的大多数基因变体都会影响髓细胞中具有重要作用的基因的一级结构或表达水平,从而影响其活性。随着更多罕见的变异被发现,其他细胞类型可能存在遗传风险。然而,根据常见变异风险空间(MAF>0.05)中的现有知识,大多数AD风险等位基因指向髓系细胞作为最可能的候选致病细胞类型。
在通过GWAS鉴定AD相关基因座并通过精细定位在这些基因座上提名候选致病变异株、GRE和基因后,了解它们在生物学和病理生物学中的作用很重要(图3)。有时,过度表达或缺乏感兴趣基因的小鼠模型是可用的,或者可以生成并与“AD”小鼠模型或其他疾病相关过程模型(例如,与年龄相关的髓磷脂降解)杂交。然而,重要的是要考虑到小鼠和人类之间的差异,而人性化模型对于临床前研究的可翻译性至关重要。经基因修饰以改变AD风险GRE或基因中基因表达水平或携带特定等位基因的iPSC可分化为多种细胞类型,如iMGL(iPSC衍生的小胶质细胞),然后在体外研究人类小胶质细胞功能。此外,为了描述不同细胞类型之间的相互作用,3D培养技术代表了一种更为生理的环境。为了在体内评估人类小胶质细胞的功能,小鼠中的iMGL异种移植最近也成为一种有吸引力的工具。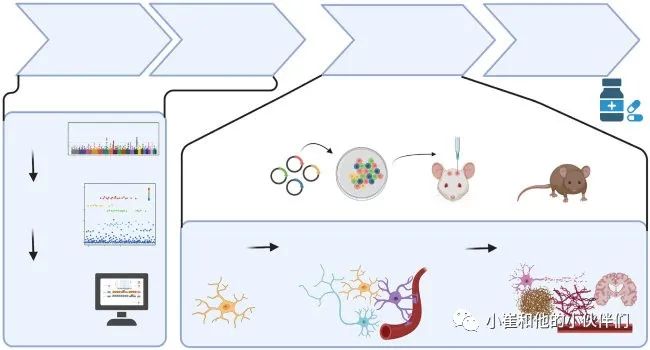
图3 从GWAS信号到治疗目标
AD基因结构的功能解释:一个工作假设
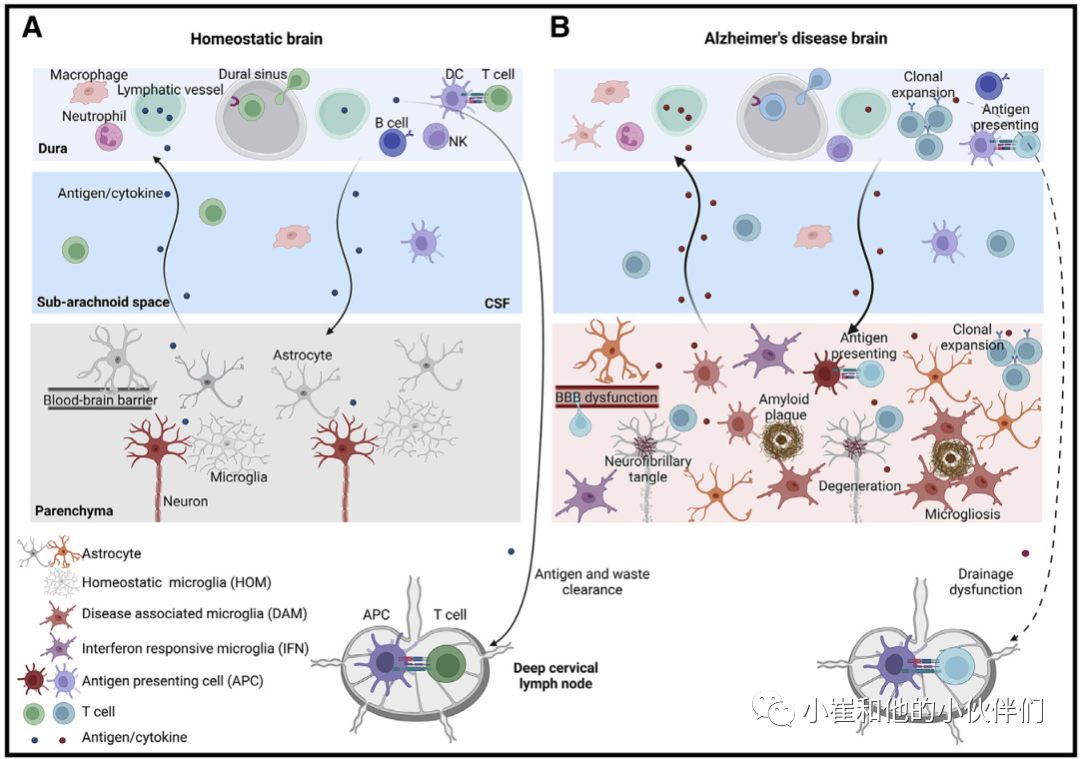
髓细胞包括一组先天免疫系统的细胞,包括粒细胞、单核细胞、巨噬细胞和树突状细胞。小胶质细胞是脑实质的驻留巨噬细胞,在维持和恢复组织稳态和先天免疫反应中发挥着关键作用。它们持续监测其微环境,并在正常条件下,通过释放神经营养因子和清除大脑中的“废物”(蛋白质聚集体、不需要的突触、营养不良的神经轴突、凋亡细胞、髓磷脂碎片等)来促进脑组织的稳态,小胶质细胞启动有益的先天免疫反应,如果需要,还可以招募免疫系统的适应性臂。不能启动或解决这些免疫反应可能是不适应的,对大脑功能和健康有害。
1907年,Alois Alzheimer首次在AD患者的大脑中描述了小胶质细胞增殖和反应性形态学(小胶质细胞增生),由于当时没有意识到胶质细胞类型之间的区别,因此称为胶质细胞增生症。小胶质细胞的功能和形态状态取决于疾病的空间位置和阶段。与斑块相关的小胶质细胞表现出变形虫形态,而位于远端的小胶质随着时间的推移仅表现出微小的变化。小胶质细胞对脑损伤的反应性随着疾病进展而增强,与受病理影响的大脑区域相关,是认知功能障碍的预测因素。通过转录谱对小胶质细胞进行表征,极大地促进了我们对健康、老年和患病大脑中小胶质细胞的不同状态以及定义它们的标记基因的理解。从AD小鼠模型中分类的小胶质细胞的基因表达分析显示,数百个基因的表达发生了显著变化。
这些研究确定了AD大脑中的多种小胶质细胞转录组状态。值得注意的是疾病相关的小胶质细胞(DAM)状态,在这种状态下,健康大脑中小胶质细胞特征基因(“稳态基因”,如CXC21、P2RY12、TMEM119和MERTK)的表达减少,而APOE、CD9、CLEC7A、CST7、IGF1、ITGAX/ CD11C和AXL等基因的表达高度上调。
重要的是,在肥胖、脂肪肝疾病和动脉粥样硬化等富含脂质组织损伤的外周人类和小鼠巨噬细胞中,也观察到类似DAM(称为LAM,脂质相关巨噬细胞)的转录特征。因此,在衰老/脱髓鞘或神经变性过程中,小胶质细胞会对人体、大脑中最富含胆固醇/脂质的组织的损伤产生类似的反应也就不足为奇了。在AD大脑中,DAM细胞位于斑块附近(可能对斑块周围受损的神经pil做出反应),并随着疾病进展而增加。在AD小鼠模型中也发现了与DAM不同的其他微胶质亚群,定义为I型干扰素(IFN-I)和II类主要组织相容性复合体(MHC-II)。
重要的是,虽然这些微神经胶质状态是由转录组特征定义的,但关于这些基因表达谱驱动的不同功能状态的信息却少得多。为了实现这一目标,DAM基因的通路分析强调了内吞/吞噬作用,胆固醇/脂代谢,先天免疫系统,以及(特别是灵长类动物与啮齿动物相比)阿尔茨海默病和凋亡细胞清除/泡泡作用。事实上,DAM标志中的许多诱导基因都是AD风险基因,为AD风险等位基因对老年或患病大脑中的核心小胶质细胞功能(如胞葬作用)的影响提供了进一步的证据。了解这些基因和途径在AD发病机制中的作用对于阐明疾病机制和确定潜在的治疗靶点至关重要。
与DAM基因相似,对常见AD风险等位基因的通路分析也暗示了(1)内吞/吞噬作用,(2)胆固醇代谢,以及(3)自2010年以来AD病因中先天免疫系统的失调。随后,TREM2和ABCA7中罕见AD风险增加的亚型突变的发现不仅指出髓系细胞是AD的主要元凶,而且强烈表明上述三种病因途径不是独立的致病因素,它们可能是高阶生物过程的三个方面,该过程将它们作为髓系细胞致病中枢的功能成分连接起来。关于这一致病中枢可能是什么,第一条线索来自对AD风险基因座内基因的额外途径分析,指出“细胞的吞噬/吞噬”、“RXR:RXR激活”和“动脉粥样硬化信号”是AD风险基因最丰富的生物途径。事实上,众所周知,特别是在动脉粥样硬化研究领域和先天免疫应答由LXR:RXR胆固醇敏感核受体的激活协同调节,并与所有巨噬细胞的最基本的活动密切相关,即它们识别(“发现我”)、吞噬(“吃掉我”)和消化(“消化我”)的能力,并在称为传出细胞增生的多步骤过程中处理(“排泄物”)凋亡细胞和其他富含胆固醇的细胞废物(图4)。在大脑中,胞葬作用主要由小胶质细胞进行,通过消除无用的、受损的或有害的细胞和细胞碎片(例如,退化的神经元、淀粉样斑块、营养不良的神经突、髓鞘碎片和不需要的突触),对维持组织稳态和免疫耐受、炎症消退和组织修复至关重要。无法清除细胞废物可导致慢性炎症/自身免疫性疾病和脑白质营养不良等脑部疾病,通常与AD风险基因(如TREM2、GRN和EIF2B2)的严重功能丧失突变相关。
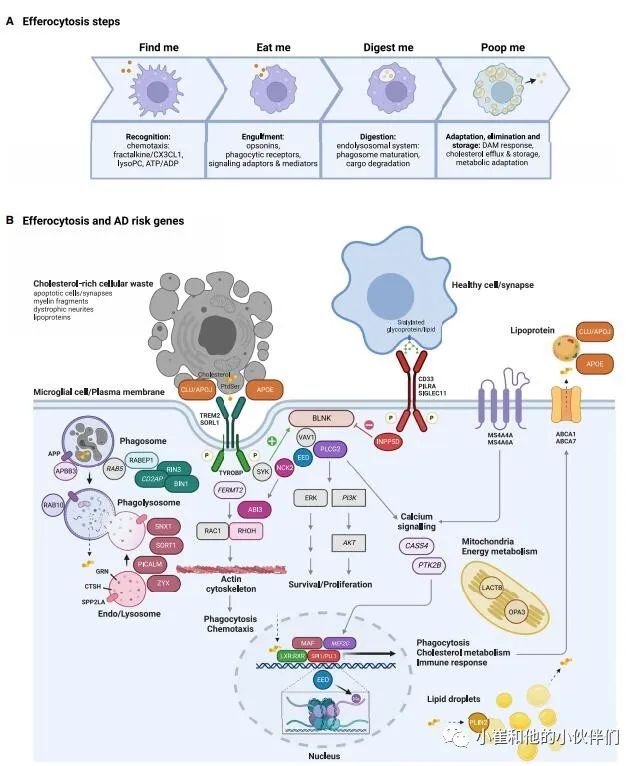 图4 人类遗传学涉及的AD风险途径
图4 人类遗传学涉及的AD风险途径
这种对AD遗传结构的功能解释也得到了以下事实的有力支持:最成熟的AD风险基因(APOE、TREM2、ABCA7和PLCG2)对于脊椎动物骨髓吞噬细胞的高效泡胞作用是必要的,并且在线虫异常胞葬作用的遗传筛选中发现了几种已知或候选AD风险基因。因此,我们假设大量AD相关变体通过改变在胞葬作用中起关键作用的基因的功能或表达,从而导致其在中枢(小胶质细胞)和/或外周巨噬细胞中的功能失常,从而增加疾病风险。在本节中,我们将回顾AD风险基因,这些基因胞葬作用途径中具有已知或推定的作用。
识别和吞噬:吞噬细胞调理素、受体和信号基因
在“找到我”信号(如fractalkine/ CX3CL1、溶血磷脂和核苷酸)提示下,小胶质细胞向胞葬作用靶点迁移或延伸其突起。通过将凋亡细胞和其他细胞碎片表面暴露的“吃我”(和“不吃我”)信号与小胶质细胞表面的特定受体结合,可以识别和连接凋亡细胞(和避免健康细胞)等凋亡靶点。这些细胞表面受体中的一些是AD风险基因(TREM2、PILLA和SIGLEC11),这些受体下游的信号分子(PLCG2、BLNK、INPP5D、NCK2、RHOH、EED和ABI3)和胞葬作用靶点的调理素(APOE和CLU/APOJ)也是如此。
髓样细胞2(TREM2)是一种AD风险基因,它与磷脂酰丝氨酸(PS)结合,磷脂酰丝氨酸是暴露在凋亡细胞和不需要的突触表面的典型“吃我”分子。它还结合其他阴离子和两性离子脂质,这些脂质由受损的髓磷脂释放。TREM2功能的丧失会导致髓磷脂碎片的胞葬作用受损,并改变小胶质细胞胆固醇代谢。它还减少了AD小鼠模型中斑块的压实,并增加了周围神经末梢的损伤。AD相关变体TREM2 R47H降低了TREM2对PS的亲和力,并与AD小鼠模型中小胶质细胞增殖减少、从稳态过渡到DAM状态的能力以及Aβ斑块周围聚集相关。此外,从TREM2 R47H载体衍生的人类iPSC系分化出的iMGL对PS暴露脂质体或凋亡细胞的反应显示出信号转导缺陷,pSYK-pERK1/2信号和NLRP3炎性体激活减少。缺乏TREM2的iMGL在通过“发现我”信号(凋亡细胞释放的ATP/ADP核苷酸)激活嘌呤能受体(如P2RY12)后表现出过度的Ca2+释放,损害了小胶质细胞对它们的趋化性。这些效应可能由PLCG2介导,已知PLCG2调节TREM2下游的Ca2+信号传导,吞噬、趋化和存活。PLCG2是一种AD风险基因,编码磷脂酶Cɣ家族成员,它将膜磷脂酰肌醇PI(4,5)P2切割成DAG和IP3,这是细胞内储存的钙释放所必需的信号转导分子,进而影响小胶质基因表达、吞噬、趋化和存活。PLCG2敲除(KO)表型Trem2功能丧失,导致髓鞘碎片胞葬作用受损,微胶质脂质代谢改变,向DAM样转录状态的缺陷转变。
在AD大脑中,PLCG2表达上调,特别是在淀粉样斑块周围。保护性和轻微超形态的PLCG2 P522R罕见变体与小胶质细胞的存活率提高、吞噬功能增强和DAM标志基因表达增加相关。适配器蛋白BLNK将PLCG2招募到质膜,其中PI(4,5)P2在TREM2激活时定位),也被提名为候选AD风险基因。BLNK基因座中的前导SNP也是单核细胞、巨噬细胞和小胶质细胞中的BLNK eQTL。
尽管其功能尚不清楚,但MS4A4A和MS4A6A是可能与TREM2和其他免疫受体相互作用的跨膜四跨蛋白。MS4A在小胶质细胞和外周免疫细胞中高度表达,并调节模式识别受体的活性,如小鼠体内的DAM标记Dectin-1(由Clec7a编码)。MS4A基因座内的AD相关SNP与髓系细胞中较低的MS4A4A和MS4A6A表达相关,这赋予了保护性表型。更具体地说,一个候选功能变体rs636317已经在iMGL中被识别和验证。MS4A基因簇中的常见变体也与脑脊液(CSF)中的可溶性TREM2水平相关,表明MS4A4A/6A水平与TREM2活性之间存在功能联系。与TREM2类似,已提出MS4A家族成员作为脂质受体。
AD GWAS还涉及多种抑制性免疫受体,它们结合唾液酸(“不吃我”信号),并通过“吃我”(如PS)信号来对抗TREM2的激活。CD33(在一些但不是所有的GWAS研究中)和PILLA基因座中已报告了保护性变体,而SIGLEC11基因座中报告了风险增加等位基因。CD33保护性变体改变了CD33的选择性剪接,减少了包含唾液酸结合结构域的外显子的包含。类似地,PILRA中的保护性G78R氨基酸取代导致唾液酸暴露配体的结合减少>50%。
因此,有人提出,CD33和PITRA变体通过小胶质细胞中的“不要吃我”信号减少抑制性信号来保护个体免于AD。SIGLEC11基因座中的AD相关SNP也是单核细胞、巨噬细胞和小胶质细胞中SIGLEC11的eQTL。这些“不要吃我”信号受体的抑制活性部分由INPP5D介导,该基因位于一个基因座中,GWAS一直与AD风险相关。INPP5D编码SHIP1,这是一种磷脂酰肌醇磷酸酶,水解PI(3,4,5)P3,以防止PI(3,1,4,5)P3-结合效应蛋白(例如,Vav家族蛋白)的募集,后者通过BLNK和PLCG2介导TREM2等“吃我”信号受体下游的免疫刺激信号。
吞噬细胞摄取通过调节胞葬作用而增强。从这个意义上讲,APOE通过充当调理素,包裹凋亡细胞和其他底物,以促进其被小胶质细胞表面的受体(如TREM2和SORL1)识别和束缚,在胞葬作用中发挥重要作用。两个编码变体(rs429358T>C编码Cys112Arg取代和rs7412C>T编码Arg158Cys取代)定义了三种多态性APOE等位基因和蛋白质亚型:。这些编码变体决定了人类的六种APOE基因型(ε2/ε2、ε2/ε3ε3/ε3、ε2/ε4、ε3/ε4和ε4/ε4),从AD的最低风险到最高风险。APOE在星形胶质细胞中高度表达,但在小胶质细胞中表达上调以应对组织损伤,已被确定为关键的DAM标志物。重要的是,APOE亚型和基因型已被证明对胞葬作用有不同的影响。在体外,与APOE3相比,分泌的APOE2增加,APOE4降低星形胶质细胞吞噬突触小体的速率。与APOE33 KI小鼠相比,APOE22 KI小鼠体内补体标记的衰老突触的消除增加,APOE44 KI小鼠体内减少。几项WGS/WES研究已确定APOE中影响AD风险的其他罕见编码变体,包括保护性“Christchurch”和“Jacksonville”变体,但尚未研究其对胞饮作用的影响。
另一种作为凋亡细胞调理素并与AD风险相关的载脂蛋白是clusterin(也称为APOJ),由CLU基因编码。虽然在星形胶质细胞中表达更高,但APOJ也可能在小胶质细胞中发挥作用。在小鼠原代小胶质细胞和人类单核细胞衍生的巨噬细胞中,APOJ是脂蛋白的载脂蛋白成分之一,与TREM2结合并被TREM2吸收。此外,Aβ与含APOJ的脂蛋白结合有助于小胶质细胞吸收Aβ。在外周巨噬细胞中,CLU增强了体外和体内的传出细胞增生。
在识别出由传出细胞靶分泌或暴露的“找到我”或“找到我的”信号后,小胶质细胞重新排列肌动蛋白细胞骨架以向其迁移并吞噬货物。在连接受体与肌动蛋白细胞骨架重塑的信号转导级联中,NCK2、RHOH、EED和ABI3被提名为AD风险基因。NCK2是一种调节免疫细胞受体活化和肌动蛋白聚合动力学的信号衔接蛋白。使用罕见变异插补的GWAS荟萃分析确定了NCK2中的一个罕见变异(rs143080277)与AD的新关联。RHOH是小鸟苷三磷酸酶(GTPases)Rho家族的成员(例如,RHOA、RAC1和CDC42),它们在胞葬作用期间充当肌动蛋白细胞骨架重排的主调节器。胚胎外胚层发育(EED)位于PICALM基因座,是多梳抑制复合物2(PRC2)的蛋白质亚基。AD相关SNPs位于小胶质细胞增强子中,该增强子与启动子接触,似乎调节EED和磷脂酰肌醇结合网格蛋白组装蛋白(PICALM)的表达。
据报道,PRC2在T细胞细胞质中的免疫受体介导的信号传导中发挥作用,在那里它与T细胞受体下游的NCK蛋白相互作用,影响肌动蛋白细胞骨架重塑,这表明EED也可能影响免疫受体信号传导和小胶质细胞中的肌动蛋白细胞骨架重排。ABI3是Abelson相互作用子(ABI)家族的成员,在传出细胞增生期间调节肌动蛋白细胞骨架重排。ABI3中一种罕见的编码变体(S209F)与AD风险增加相关。在AD小鼠模型中,Abi3缺失增加了可溶性和不溶性Ab水平和斑块负荷,减少了斑块周围的小胶质细胞聚集,并导致突触功能障碍。与这些观察结果一致,体外实验表明,Abi3敲除会损害小胶质细胞的迁移和吞噬作用。ABI3最近被提出作为AD生物标志物。AD患者血清、脑脊液和外周血单个核细胞中ABI3水平降低。
消化:溶酶体成熟和内溶酶体系统基因
内溶酶体系统包括以动态方式相互转化的细胞内膜细胞器网络,其主要功能是消化、再循环或消除分别通过自噬或内吞/吞噬作用进入该系统的细胞内或内化的细胞外物质。内溶酶体系统已成为几种神经退行性疾病的中枢发病中枢。早期研究将内溶酶体网络与AD联系起来,这是因为发现APP淀粉样生成过程发生在内体中。因此,改变的内吞作用与Aβ的产生失调有关。
更具体地说,内吞体和反高尔基网络(TGN)之间APP运输的中断导致内吞APP在早期内吞体中的积累和APP加工的减少。ADAD引起的突变影响内溶酶体功能以及APP的细胞内分选和处理。此外,早期内体增大,这表明晚期内体/溶酶体的成熟延迟或被抑制,与斑块形成前Aβ的初始升高一致,表明内溶酶体功能障碍在疾病发病早期发生,至少在ADAD中发生。这些早期的研究集中于ADAD和其他AD风险基因如何调节神经元内溶酶体系统中APP淀粉样变过程。在这里,作者团队重点关注与GWAS引起的AD相关的内溶酶体系统基因如何通过影响小胶质细胞和其他髓细胞的传出细胞增生来调节疾病易感性。
在识别和拴系胞葬作用靶标后,小胶质细胞以突起的形式将其质膜延伸到靶周围,最终融合形成新生吞噬体,这是一个完全包围胞葬作用靶的液泡。这种膜细胞器缺乏降解货物的能力。这种能力是在一个称为吞噬体成熟的过程中获得的,该过程包括吞噬体和内吞、循环和分泌途径(如早期和晚期内体和溶酶体)的囊泡之间的连续融合和分裂事件,以形成能够消化吞噬物质的吞噬体。因此,参与膜囊泡运输途径的几个基因,如网格蛋白介导的内吞作用和逆转录酶复合物介导的内体循环,也与胞葬作用增多有关。
GWAS已经确定了内溶酶体系统基因与AD风险之间的若干关联。PICALM是一种单体衔接蛋白,在胞吞起始过程中将网格蛋白募集到细胞膜上。该基因座的SNP一直与GWAS的AD风险相关. 组织学和实验研究强调了PICALM在溶酶体功能、APP处理和τ清除中的作用。HeLa细胞中PICALM的缺失会导致内体扩大,并显著抑制内吞作用和(自动)吞噬体的形成和成熟。最近表明,PICALM过表达可挽救酵母和iPSC衍生的人类星形胶质细胞中APOE4引起的内吞缺陷。虽然描述PICALM基因座与AD之间关联的因果变异尚不清楚,但功能研究表明,PICALM表达通过抑制Aβ产生而具有保护作用。然而,需要进一步的研究来具体了解其在小胶质细胞胞葬作用中的作用。
桥接积分器1(BIN1)基因座与AD的相关性仅次于APOE基因座。BIN1与动力蛋白一起在溶酶体内系统的膜重塑中发挥作用,动力蛋白是胞葬作用和吞噬体成熟的关键基因。GWAS后分析表明,BIN1基因座中的因果变异通过降低BIN1增强子活性,进而降低BIN1表达,特别是在小胶质细胞和其他髓细胞中,从而增加AD风险。因此,尽管BIN1广泛表达,但AD相关风险SNPs的影响对髓系细胞具有特异性。值得注意的是,小胶质细胞中BIN1的沉默削弱了吞噬作用、LPS的促炎激活,并在体外和体内转变为DAM基因表达谱。
SORL1基因座中的常见变体一直与大型GWAS中的AD相关,家族性和散发性AD中都报告了罕见的编码变体(蛋白质截短变体和错义变体。基于基因的蛋白质截短变体聚集试验与EOAD和优势比>12相关,而错义变体与更适度的优势比<2相关。SORL1编码属于空泡蛋白分选10(VPS10)结构域受体家族的分选蛋白相关受体SORLA,并在神经元、星形胶质细胞和小胶质细胞中表达。SORL1蛋白作为逆转录体复合物的一部分发挥作用,因此负责将APP引导至反高尔基网络中的非淀粉样变性过程。SORL1的缺乏导致早期内体增大、内体运输受损,以及神经元内溶酶体网络内APP定位的改变。
然而,SORL1 KO小胶质细胞在基线时表现出DAM表达谱,在体外和体内Aβ摄取存在缺陷。此外,用SORL1 KO人小胶质细胞异种移植的小鼠大脑中,与TREM2 KO小胶质细胞相似,斑块相关的小胶质细胞显著减少。SORL1在小胶质细胞保障作用中的作用尚未完全研究。然而,如前所述,通过促进吞噬体成熟和TREM2等吞噬受体的循环,其他反转录物复合物基因和相关的排序接子(包括最近提名的候选AD/痴呆风险基因SNX1)已与胞葬作用有关。此外SORT1(最近被提名为候选AD/痴呆风险基因的VPS10结构域受体家族的另一成员)已被提出通过靶向溶酶体酶(包括蛋白酶,如候选AD/失智症风险基因CTSH)在巨噬细胞的吞噬体成熟中发挥重要作用。
AD风险基因RAB10和SPPL2A也被证明参与吞噬体成熟和信号传导。RAB10的3'-UTR中的一种罕见变体赋予AD韧性,尽管其对mRNA和蛋白质水平的影响仍然未知。在巨噬细胞中,RAB10功能的丧失会延迟吞噬体的成熟,相反,RAB1010功能的增加会加速吞噬体的发育。SPPL2A基因座中的SNP与AD风险相关,功能基因组学研究表明,SPPL2A是该基因座的一个强有力的候选致病基因。特别是,髓系特异性增强子中的AD相关SNP与髓系细胞中SPPL2A表达降低和AD易感性增加有因果关系。SPPL2A是一种膜内蛋白酶,主要位于晚期内体和溶酶体中。虽然尚未研究SPPL2A在AD或胞外胞葬作用的作用,但在巨噬细胞中,它定位于吞噬体,在那里它裂解并抑制DAM标记物和吞噬细胞受体Dectin-1(由CLEC7A编码)下游的信号传递,我们之前提到过它是MS4A4A和MS4A6A AD风险基因的信号传递伙伴。
由GRN编码的Progranulin是一种分泌型多效性生长因子和溶酶体功能的关键调节因子,通过胞吐作用调节分泌并定位于溶酶体。GRN的单性不足会导致额颞叶变性,而功能完全丧失会导致神经元类蜡样脂褐症,这是一种溶酶体储存疾病。此外,GRN已被提名为近期GWAS中的候选AD/痴呆风险基因。小胶质细胞激活后,前颗粒蛋白的表达和分泌显著增加。GRN缺乏导致老年小鼠补体生成增加,小胶质细胞对突触的吞噬清除增强,以及线虫对脊椎动物巨噬细胞的凋亡细胞的吞噬清除提高。小鼠、小鼠巨噬细胞和iMGL中的Grn KO可诱导小胶质细胞过度激活和DAM转录反应,但也会导致溶酶体功能障碍、脂质失调和葡萄糖低代谢。GRN KO小鼠中Trem2的遗传和药理学消融减少了小胶质细胞过度激活和DAM转录反应。然而,Trem2 KO无法挽救溶酶体功能障碍、脂质失调和葡萄糖代谢低下,神经退行性变进一步增加。这项研究表明,Grn KO赋予DAM依赖性神经保护功能,但也赋予DAM非依赖性溶酶体和脂质功能障碍,而Trem2消融无法挽救这些功能。因此,即使在体外和体内Aβ神经毒性模型中,前颗粒素的药理学上调具有保护作用,旨在提高GRN活性以降低AD风险的治疗干预措施可能必须在挽救GRN缺乏和抑制DAM反应的保护作用以及AD风险基因下游的小胶质细胞效应(如TREM2)之间取得平衡。
与内溶酶体系统相关的其他基因(例如:AP4E1、AP4M1、APPB3、RABEP1、RIN3、TP53INP1和ZYX)最近已通过将GWAS信号与髓系细胞基因组学整合而被鉴定为候选AD风险基因。在老年或患病的大脑中,评估它们对小胶质细胞功能和胞葬作用的影响至关重要。
适应、消除和储存:转录反应基因
胞葬作用面临与凋亡细胞和其他富含胆固醇的细胞碎片的内化和降解相关的独特挑战,例如处理排出细胞货物加工所施加的繁重代谢负荷以及协调抗炎和促组织修复反应。髓系谱系和信号依赖性TFs的基因表达重编程是这种巨噬细胞/小胶质细胞适应的重要组成部分。
几个AD GWAS基因座包括在巨噬细胞/小胶质细胞发育和功能中发挥重要作用的TFs。CELF1/SPI1基因座与AD相关精细定位方法已将编码TF PU.1的SPI1指定为最可能介导CELF1/SPI基因座与AD风险相关的基因。然而,该基因座髓系增强子内的AD风险SNP调节包括NR1H3在内的几个基因的表达,这表明它们可能通过该基因座中的多个基因调节AD风险。有趣的是,研究的单倍型降低了髓系细胞中PU.1的表达,并延迟了AD发病时的年龄。
最近的一项研究证实了CELF1/SPI1基因座中保护性单倍型与大脑皮层和血液单核细胞/巨噬细胞中SPI1表达降低的相关性,PU.1与髓系细胞中的活性增强子和启动子结合,并调节几种AD风险基因(ABCA7、CD33、MS4A4A、TREM2、APOE)的表达功能研究突出了PU.1在指导小胶质细胞转录组状态和减轻对各种应激源和刺激的转录反应中的重要作用。PU.1调节AD小鼠中白细胞介素(IL)-33依赖性DAM转变,并促进小胶质细胞吞噬清除活性。在体外,降低PU.1水平可调节小胶质细胞基因的表达,模拟DAM反应,减少吞噬细胞摄取,并增加小胶质细胞系细胞毒性条件下的细胞死亡。相反,PU.1的上调增加了吞噬细胞的摄取,减少了细胞毒性条件下的细胞死亡,并上调了小胶质细胞系中促炎基因的表达研究SPI1对AD小胶质细胞的影响是复杂的,因为它对髓系细胞发育至关重要,而完全SPI1 KO可阻止小胶质细胞分化。为了了解这一主调节通路如何被用于疾病治疗,需要进一步研究SPI1表达减少的影响,特别是在AD大脑中。
主髓系调节因子,如PU.1,与其他谱系决定转录因子(LDTF)一起以细胞类型特异性的方式形成增强子景观。MAF家族TFs对于建立巨噬细胞特异性调节区至关重要,最近已表明MAF基因座与AD风险和组蛋白乙酰化QTL相关。与SPI1/PU.1一样,MAF池体富含巨噬细胞中AD风险等位基因。
广泛表达的信号依赖性转录因子(SDTF,例如胆固醇感应LXR:RXR核受体)通过激活由LDTF如SPI1/PU.1和MAF建立的增强子以细胞类型特异性方式调节基因表达。NR1H3基因也位于CELF1/SPI1基因座,通过调节NR1H3表达的髓系增强子与AD风险有因果关系。NR1H2位于另一条染色体上SPI1样基因SPIB旁边(SIGLEC11和CD33 AD风险位点之间),也可能有助于AD发病。这两个基因编码肝脏X受体(分别为LXRb和LXRb),它们是LXR:RXR核受体的氧甾醇激活亚基,参与胆固醇和免疫稳态。LXR:RXR控制胆固醇代谢,并可能在涉及脂质失调的疾病中发挥重要作用,如AD。
更具体地说,在巨噬细胞/小胶质细胞中,LXR:RXR靶基因(包括AD风险基因ABCA1和APOE)参与胆固醇外流、传出细胞增多和炎症反应抑制。在AD小鼠模型中,LXR的缺失导致淀粉样蛋白负荷增加,而LXR激动剂(T0901317)降低了可溶性Aβ水平。敲除Nr1h3、Apoe或Abca1会损害胆固醇流出,并损害脱髓鞘小鼠模型中的髓磷脂碎片胞葬作用和髓鞘再生,而LXR激动剂(GW3695)可挽救APOE和Trem2 KO小鼠中的小胶质细胞脂质稳态失调。因此,LXR:RXR TFs是调节APOE/胆固醇代谢、传出细胞增多和小胶质细胞炎症反应的潜在治疗靶点。
如前所述,EED是PRC2的蛋白质亚基。PRC2通过将H3K27me3(组蛋白3上赖氨酸27的三甲基化)沉积在核小体上,从而抑制基因表达,从而在表观遗传调控中发挥作用. 已表明PRC2在表观遗传学上限制支持小胶质细胞胞葬作用的基因的表达。事实上,PRC2的缺失导致小胶质细胞凋亡细胞清除表型的激活。
适应、消除和储存:胆固醇流出和脂滴基因
当小胶质细胞摄入凋亡细胞或其他富含胆固醇的细胞碎片(如髓磷脂碎片)时,多余的胆固醇必须(1)酯化以储存在脂滴中,导致泡沫细胞形成,和/或(2)渗出到细胞外受体如APOE,以防止细胞应激和细胞毒性。因此,如上所述,小胶质细胞胞葬作用过程中对富含胆固醇的细胞碎片的识别、吞噬和消化触发了适应性转录反应,导致参与胆固醇流出和脂蛋白生物发生的基因表达增加,这一直与AD风险相关。
APOE是一种两亲性分泌糖蛋白,它结合胆固醇和其他脂质形成脂蛋白,并介导胆固醇和磷脂从周围巨噬细胞以及大脑中的星形胶质细胞和小胶质细胞流出。含有APOE的高密度脂蛋白的生物发生主要由ATP结合盒转运蛋白ABCA1和ABCG1介导,这些转运蛋白将磷脂和胆固醇转移到未脂化的APOE和新生脂蛋白。有趣的是,ABCA1(及其近同源物ABCA7)也是AD风险基因,这突出了这一途径在AD病因中的相关性,ABCA7在细胞外效应中的作用可能更依赖于其倾向于将PS从质膜的内叶向外叶翻转,在凋亡细胞表面起到“吃我”信号的作用。这与线虫中的同源序列(ced-7)在死亡和吞噬细胞用于有效的胞葬作用。与APOE3和APOE2相比,APOE4是胆固醇和脂质的有效受体,这可能导致胆固醇外流和大脑内脂质转运减少。尽管APOE44小胶质细胞和星形胶质细胞排出胆固醇的能力降低,但它们上调胆固醇的生物合成,并显示中性脂质如胆固醇酯在脂滴中的积累增加。
在慢性脱髓鞘背景下,Trem2和Plcg2 KO小鼠的小胶质细胞中也观察到这种脂质体表型。在淀粉样沉积的背景下,斑块相关的人类小胶质细胞显示出DAM/LAM转录谱和增加的脂滴积聚,这与人类动脉粥样硬化胞葬作用的情况极为相似。由于TREM2 R47H人类小胶质细胞与淀粉样斑块的接近性和反应性降低,其分子和细胞表型降低,因此,我们认为,淀粉样斑块周围富含胆固醇的受损神经胶质的暴露和胞吐减少。在TREM2 KO小鼠急性和局灶性脱髓鞘的情况下,也观察到TREM2功能丧失的类似效果。
如前所述,Alois Alzheimer首次将淀粉样斑块周围胞葬作用中的细胞内脂质积聚描述为AD的主要神经病理学特征。Alois Alzheimer所描述的类脂颗粒是脂滴还是例如在受年龄相关性慢性髓磷脂降解影响的小胶质细胞溶酶体中观察到的脂褐素颗粒仍有待确定。有趣的是,PLIN2编码脂滴外壳蛋白紫苏素2,最近被提名为髓系细胞中的候选AD风险基因。在胞葬作用中,PLIN2在细胞溶质和溶酶体脂肪酶水解胆固醇酯中起着重要作用,这导致ABCA1从脂滴中动员游离胆固醇流出。此外,酯化胆固醇的水解缺陷导致传出细胞减少,因为氧甾醇的生成受损,进而导致LXR:RXR核受体的激活减少。
适应、消除和储存:能量代谢和线粒体基因
胞吐是一个能量密集的过程,因此在每个步骤中都会发生代谢变化以提供足够的能量。此外,线粒体膜电位会影响吞噬能力(较低的电位会增强吞噬能力),代谢修饰,例如糖和脂肪酸代谢的上调,发生在对吞噬货物和消化物的适应过程中。长期以来,线粒体功能被认为是AD早期受损的细胞内过程之一。然而,对小胶质细胞能量代谢在AD发病机制中的作用知之甚少。小胶质细胞代谢适应性由TREM2 mTOR轴维持。与野生型小鼠相比,Trem2 KO小鼠的培养巨噬细胞和小胶质细胞显示ATP水平和线粒体质量降低。TREM2 R47H iPSC衍生的小胶质细胞表现出代谢缺陷,包括线粒体呼吸能力降低和无法进行糖酵解代谢转换以快速塑性反应。这些作者还表明,这些改变至少部分是通过PPARg/p38MAPK信号的失调介导的,这些途径的激活改善了代谢缺陷,从而挽救了关键的小胶质细胞功能,如Aβ吞噬作用。
在慢性淀粉样蛋白或tau病理学中,如发生在老年AD小鼠中,小胶质细胞依赖于氧化磷酸化,其中TREM2也发挥着重要作用。即使在低氧和葡萄糖水平下,氧化磷酸化也保持不变,这表明小胶质细胞正在代谢替代碳源,主要是谷氨酰胺。尽管脂肪酸β-氧化(FAO)不能高度维持小胶质细胞代谢,因为它们表达的关键FAO酶水平很低,但AD中脂质稳态的改变可能通过与星形胶质细胞的相互作用间接影响小胶质细胞的代谢。在低葡萄糖条件下,FAO在星形胶质细胞中发挥重要作用,星形胶质细胞是将谷氨酸转化为谷氨酰胺的脑细胞。由于谷氨酰胺可能是小胶质细胞代谢的重要碳源,脂质失衡可能间接影响小胶质细胞的能量生产能力。
LACTB是一种位于线粒体膜间空间的丝氨酸蛋白酶,参与脂质调节和能量代谢。最近,在一项使用脑蛋白定量特征位点(pQTL)的全蛋白质组关联研究中,提出了低水平LACTB与AD风险降低之间的关联。LACTB也被提名为肥胖基因,特别是在巨噬细胞富集代谢网络的背景下,突出了其在脂肪和能量代谢中的重要性。LACTB过度表达可降低磷脂酰丝氨酸脱羧酶(PISD)水平,从而改变溶血磷脂酰乙醇胺(LPE)和磷脂酰乙醇酰胺(PE)水平,并损害癌症细胞的细胞增殖。线粒体磷脂(如PE和LPE)是线粒体膜的重要组成部分,因此它们的改变可能影响依赖于这些膜内蛋白质的不同过程需要进一步研究来表征LACTB的功能和在小胶质细胞呼吸和脂质代谢中的重要性。有趣的是,LACTB2(编码人类基因组中唯一的其他内酰胺酶)最近被提名为髓系细胞中的候选AD风险基因。
位于线粒体外膜的OPA3在脑组织的大规模转录全关联研究(TWAS)中也被确定为AD风险候选基因。OPA3过表达可能导致线粒体断裂,而OPA3下调导致不同人类细胞系中的线粒体延长线粒体融合裂变动力学与免疫代谢以及传出细胞增生过程高度相关。在营养或氧气限制等压力环境下,线粒体伸长以保持高呼吸能力。通过电子显微镜,已报道AD小鼠模型中斑块相关小胶质细胞的线粒体延长;那么OPA3在小胶质细胞中的功能将是一个有趣的研究课题。
小胶质细胞胞葬作用如何调节AD风险?
专业吞噬细胞(如髓系细胞)和非专业吞噬细胞(如上皮细胞)的胞葬作用对于维持组织的动态平衡和组织损伤后的修复至关重要。通过胞葬作用去除凋亡细胞可防止继发性坏死和细胞内内容物释放所引起的炎症。胞葬作用不仅作为一种废物处理机制,而且还具有积极的抗炎作用,从而促进自我耐受和炎症消退。因此,一些自身免疫性和慢性炎症性疾病以及动脉粥样硬化、癌症和其他疾病的病因学都涉及到调节失调或功能受损的胞葬作用。不幸的是,小胶质细胞胞葬作用在AD中的作用尚未得到彻底的研究。然而,它有几种(并不是相互排斥的)可能的方式来调节AD风险。
虽然小胶质细胞和其他驻留在组织中的巨噬细胞在吞噬过程中有显著的相似之处,但也有可能是由小胶质细胞与神经元和其他类型的脑实质细胞相互作用所驱动的不同。例如,小胶质细胞胞葬作用的基本作用之一是突触修剪。虽然小胶质细胞对突触的修剪在发育过程中得到了更广泛的研究,但突触的小胶质细胞胞葬作用也塑造了成人神经回路,并已被证明在淀粉样蛋白沉积的小鼠模型中介导突触丢失。最近的研究表明,突触修剪是由凋亡细胞使用的相同的“找到我”、“吃我”和“不要吃我”信号(例如,Fractalkine/CX3CL1、PS、C1q和CD47)指导的。这突显了与胞吐相关的AD风险基因的重要性,不仅在广泛的神经变性背景下,而且在疾病的早期阶段,甚至在大脑发育的胚胎和出生后阶段。小胶质细胞的突触胞葬功能障碍可能导致正常突触的异常消除和/或无法清除功能障碍、衰老或其他不需要的突触,导致突触丢失和脑电路改变。
事实上,突触上的靶向补体抑制(例如,使用C3抑制剂)可以防止突触被小胶质细胞吞噬和记忆印记的退化。在脑老化或神经变性期间,小胶质细胞吞噬细胞并清除其他富含脂质/胆固醇的细胞碎片,如髓鞘碎片和死亡的神经元/营养不良的轴突(例如,淀粉样斑块周围)。因此,受损的小胶质细胞胞葬作用可能会导致此类碎片的积累,并促进促炎和抗修复的微环境,这可能会导致进一步的脑组织稳态失调和神经变性。此外,小胶质细胞胞葬作用也被证明调节出生后和成年神经元和少突胶质前体细胞的存活,这可能影响神经发生、髓鞘发育和动态平衡,进而影响阿尔茨海默病的易感性。
人类遗传学表明,小胶质细胞胞葬作用的终生损害与AD风险的增加有关,因为风险增加的变体与促进泡腾的基因(例如,TREM2 R47H)的功能丧失有关,反之亦然,风险降低的变体与抑制/促进泡腾的基因(例如,PILRA G78R和PLCG2 P522R)的功能丧失/获得相关。这一潜在的生物学表明,直接影响小胶质细胞泡沫化的AD基因可能间接影响神经元和突触的存活以及大脑电路和功能。同样,IL34是一种小胶质细胞生长因子,由其最可能的受体是CSF1R的神经元分泌,其功能丧失突变(无义突变)与AD风险的增加有关。在小鼠中,去除神经前体细胞中的IL34(Nestin-CRE)会导致纹状体灰质中神经元相关小胶质细胞的选择性丧失。这强化了这样一个观点,即小胶质细胞数量和/或功能的减少可能损害大脑健康,并导致AD风险增加。

未来方向和问题
未来的研究需要进一步的研究来扩大对AD风险变量和基因如何共同作用来调节小胶质细胞功能的理解,如胞葬作用,从而导致神经退行性变和痴呆。为此,在体外和体内进行大规模的CRISPR筛查将是确定哪些GWAS提名的AD候选风险基因在什么情况下对小胶质细胞胞葬产生功能影响的关键。在单一培养或更复杂的组合/有机培养中的体外分析使我们能够解决每个基因在增殖、迁移、吞噬细胞清除和新陈代谢中的重要性,然而,这些基因对AD病理或脑内稳态和修复的影响将需要衰老或疾病大脑的生理背景。使用转基因小鼠模型和异种移植模型进行的体内研究将为AD病理或其他与疾病相关的疾病,如年龄相关的髓鞘退化,提供小胶质细胞功能障碍的时间和空间背景。到目前为止,使用这些范例测试的阿尔茨海默病风险基因很少。我们需要填补这一知识空白,以充分了解这些基因调节AD发病信息的机制,这些信息可能是开发新疗法所必需的。此外,由其表观基因组和转录特征定义的各种小胶质细胞状态对小胶质细胞功能和AD风险的影响仍有待了解。
另一个重要的悬而未决的问题是关于淀粉样变性APP处理的生理作用,以及它是否与小胶质细胞中的其他AD风险基因一起参与了本综述中强调的病因途径。在这方面,令人欣慰的是,GWAS最近在散发性AD中发现了APP基因座的关联。因此,与其默认为ACH,关键的是还要调查淀粉样变性APP的处理(而不仅仅是毒化老化的大脑)在基于散发性AD的复杂遗传学的新的发病和治疗假说的背景下进化的目的。例如,有证据表明,APP内的Aβ序列与胆固醇结合,淀粉样变性APP的处理可能作为高胆固醇在溶酶体膜内的传感器,并且它可能在胆固醇代谢和天然免疫中具有生理作用。尽管有这些悬而未决的问题,但在确定新的治疗靶点和开发针对小胶质功能的潜在疗法方面正在取得进展,包括胞葬作用。来自遗传和功能研究的共识是,至少在AD的早期阶段,TREM2信号是保护性的,TREM2激动剂(小分子或抗体)将激活保护性途径,如小胶质细胞的胞葬作用。其他正在积极研究的靶点包括MS4A4A/MS4A6A(低表达/抑制应该是保护性的),CD33(抑制应该是保护性的,类似于“不要吃我”信号受体CD22的阻断),PU.1(低表达应该是保护性的),PLCG2(激活应该是保护性的),INPP5D/SHIP1(抑制应该是保护性的),以及APOE(例如,模仿APOE2亚型的保护作用)。其中大多数都处于早期的临床前开发阶段,但有希望以基因验证的神经免疫靶点为靶点的疗法将在未来带来新的治疗方法。此外,随着我们对AD遗传结构的了解的提高,精确医学的潜力将会扩大。PR可能有助于改善对疾病风险、认知减退率和药物反应的预测,从而更好地进行临床试验设计和开发预防性治疗方法。
Romero-Molina C, Garretti F, Andrews SJ, Marcora E, Goate AM. Microglial efferocytosis: Ping into the Alzheimer's disease gene pool. Neuron. 2022 Nov 2;110(21):3513-3533. doi: 10.1016/j.neuron.2022.10.015
编 译 / 李 昀 峰
校 审 / 蔡 玉 洁
点击上方名片关注我们
感谢支持!欢迎分享、投稿转载!
-欢迎加入神内神外相关学术讨论群-
神经内科学术讨论群
神经外科学术讨论群
脑成像学术讨论群
AD-PD学术讨论群
脑血管学术讨论群
脑肿瘤学术讨论群
癫痫学术讨论群
脑与运动学术讨论群
脑与睡眠学术讨论群
······

-添加小编佩佩微信-
微信 | brainnews_09
留言 | 加群+群名称
近期课程
2023
【随到随学| 2月】跟着18篇CNS文章学单细胞多组学分析(含空间转录组、chipseq、RNAseq、Atacseq外显子)
【02.17-03.18】脑电数据分析启航班
【02.18-02.19】宏基因组与代谢组/脂质组学R软件数据可视化研讨会
【02.25-02.26】多组学联合网络医药学、分子对接及实验验证培训班
【02.28-03.08】多模态网络数据处理班
【02.28-03.08】多模态网络数据处理班
【03.03-03.29】任务态磁共振数据处理学习班
【03.25-03.28】多模态磁共振脑网络分析实战班
【03.27-04.16】脑电机器学习训练营
【04.04- 04.16】核磁机器学习班

微信扫一扫
关注该公众号
知道了
微信扫一扫
使用小程序
取消 允许
取消 允许
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










好文章,谢谢分享。
44