PNAS:不再是梦!将来可以用手机来做检查!
2015-04-15 Zhang JL译 MedSci原创
通过计量与细胞结合的肿瘤标记靶向微珠的数量,D3系统能像传统病理检查一样,区分活检样本的风险高低。(图片来源于科技日报网)一个由美国麻省总医院(MGH)的研究人员开发的设备可以快速、准确地对肿瘤和其他疾病进行分子诊断,并在无相关医疗技术的前提下对病灶位置进行定位,为缺乏先进医疗技术的地区带来好处。相关论文在线发表在美国《国家科学院院刊》(Proceedings of the National Ac
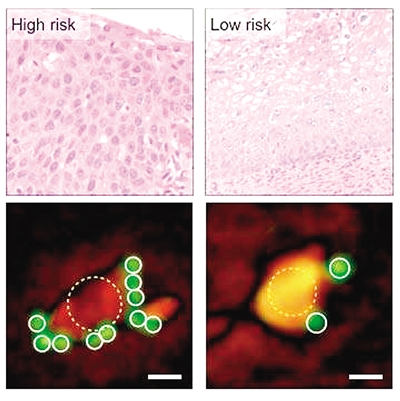
通过计量与细胞结合的肿瘤标记靶向微珠的数量,D3系统能像传统病理检查一样,区分活检样本的风险高低。(图片来源于科技日报网)
“全球范围内癌症的不断发展、许多地区对病理诊断的有限以及新兴细胞分析技术的提高,催生了对低成本、便携式和快速诊断方法的需求,以在任何一个地点得到应用,”该研究的共同作者、MGH癌症中心和系统生物学中心副主管Cesar Castro博士说,“各种癌症新兴的基因组和生物数据,是选择最合适的治疗的必要依据,也是分子分析策略的需要,能够为更多提供者、临床研究人员和患者提供服务;我们相信我们所开发的平台能够在一个相当低成本的基础上提供必要的这些功能。”
该团队所开发的被称为D3(数字衍射诊断)系统,利用夹在一个标准智能手机上的功能成像模块与一个电池供电的LED照明灯,以相机记录高分辨率成像数据。由于比传统的显微镜具有更大的视野,D3系统能够记录在一个单一的图像中超过100000血液或组织样品细胞的数据。该系统随即把数据通过安全、加密的云服务端传输到远程图形处理服务器,并迅速把结果传回到护理点。
在肿瘤的分子分析方面,通过把带有特定癌症相关分子标记的微珠与血液或组织样品结合,把结合物加载到D3成像模块上。在图像记录和数据传输到服务器后,系统将检测到微珠产生的衍射模式并反映特定分子的存在。使用不同大小或包被的珠子可以为不同分子的检测提供方便。研究小组开发的D3平台数值算法能够在不到9/100秒中对细胞以及珠的多达10 MB的数据进行分析。
通过对肿瘤细胞系的预测试,系统能够对肿瘤蛋白质的存在以一个黄金精度匹配标准来进行分析,并且其超大视野允许同时对超过100000细胞进行分析。随后,研究人员对25名巴氏涂片异常的妇女宫颈活检样本进行分析,这些样本与用于临床诊断的样本同时收集,并使用带有三个已被证实的宫颈癌标记抗体的微珠进行处理。基于带标记微珠所结合细胞的数量,D3分析快速且可靠地把活检样本分类为高风险、低风险或良性,并且结果与常规病理分析相匹配。
D3系统对淋巴结细针活检样本的分析,能够准确把四个常规病理诊断证实为淋巴瘤的病人与另外四个良性淋巴结肿大区分开来。在蛋白质分析的同时,系统也提高检测DNA的成功率——在这个例子中用于高敏感性地检测人类乳头状瘤病毒。在这些预测试中,D3系统在一个小时内和1.80美元的成本得出可靠的化验结果,而且随着系统的进一步改进,价格预计将可以进一步下降。
“我们预计D3平台将在资源有限的条件下通过可行和可持续的方式提高癌症筛查的广度和深度,”该研究的第二作者、生物学系统MGH中心(CSB)主任Ralph Weissleder博士说,“通过利用移动电话技术在世界范围内的广泛应用,D3系统能够筛选可疑或高风险的病例,帮助具备有限的病理学检测的地区减少延迟所造成问题以及减少这类病人接受后续医疗检测的必要性,这对于他们来说是非常有挑战性的。”
随着这项技术的进一步发展,文章的第二作者Hakho Lee博士指出:“研究小组将:1)研究D3平台分析蛋白质和DNA标记或其他疾病催化剂的能力,包括传染性病原体和过敏原;2)具有大型数据库的集成软件;3)在发展中国家或地区中进行临床研究并实现供应商和/或临床研究人员医学信息的无缝共享。”
原始出处:
Hyungsoon Im, Cesar M. Castro, Huilin Shao, Monty Liong, Jun Song, Divya Pathania, Lioubov Fexon, Changwook Min, Maria Avila-Wallace, Omar Zurkiya, Junsung Rho, Brady Magaoay, Rosemary H. Tambouret, Misha Pivovarov, Ralph Weissleder, Hakho Lee. Digital diffraction analysis enables low-cost molecular diagnostics on a smartphone. Proceedings of the National Academy of Sciences, 2015; 201501815 DOI: 10.1073/pnas.1501815112
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#PNAS#
30