STTT 山东大学齐鲁医院张澄/张运/杨建民教授团队发现NPRC调控动脉粥样硬化的新机制
2023-08-11 论道心血管 论道心血管 发表于上海
文章报告了NPRC缺失通过抑制氧化应激、炎症和细胞凋亡减轻动脉粥样硬化的新发现和新机制。这一发现为动脉粥样硬化提供了新的干预靶点。
动脉粥样硬化(AS)引起的心血管疾病已成为全球人类死亡的主要原因,每年导致约1760万人死亡。虽然已证明血脂异常和炎症反应与AS有因果关系,但AS的发病机制仍未完全阐明。为了发现中国汉族人群的冠心病易感基因,本课题组作者在国家863重大研究计划的支持下,领导了全国多中心参加的冠心病全基因组关联研究,在3363例冠心病患者和3148例对照人群中,发现利钠肽受体C (NPRC)基因的6个单核苷酸多态性(SNP)位点与冠心病发病有显著性关联,调整传统的冠心病危险因素后这些关联依然存在,表明NPRC基因的SNP显著增加了中国汉族人群冠心病的易感性。然而,NPRC基因多态性与冠心病关联的分子机制尚不清楚。
2023年8月9日,山东大学齐鲁医院络病理论创新转化全国重点实验室和心内科的张澄教授/张运院士/杨建民教授团队在国际权威期刊Signal Transduction and Targeted Therapy杂志(最新影响因子39.3)在线发表了题为“NPRC deletion mitigated atherosclerosis by inhibiting oxidative stress, inflammation and apoptosis in ApoE knockout mice” 的论文,报告了NPRC缺失通过抑制氧化应激、炎症和细胞凋亡减轻动脉粥样硬化的新发现和新机制。这一发现为动脉粥样硬化提供了新的干预靶点。

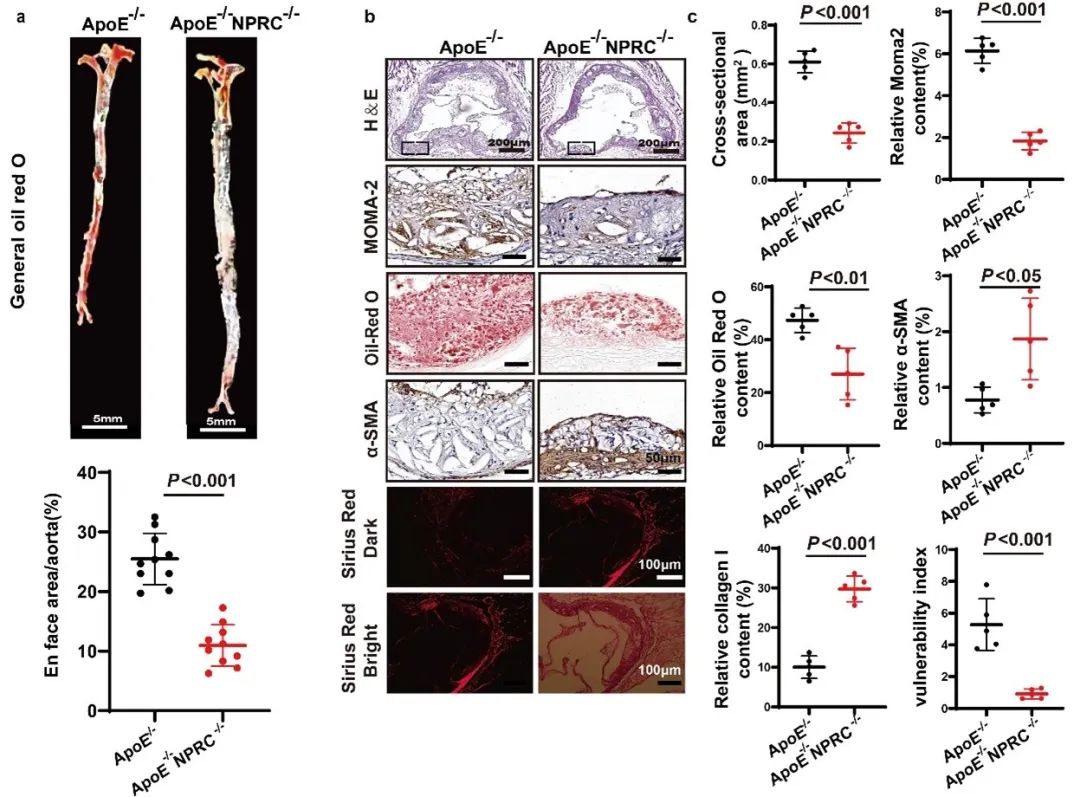
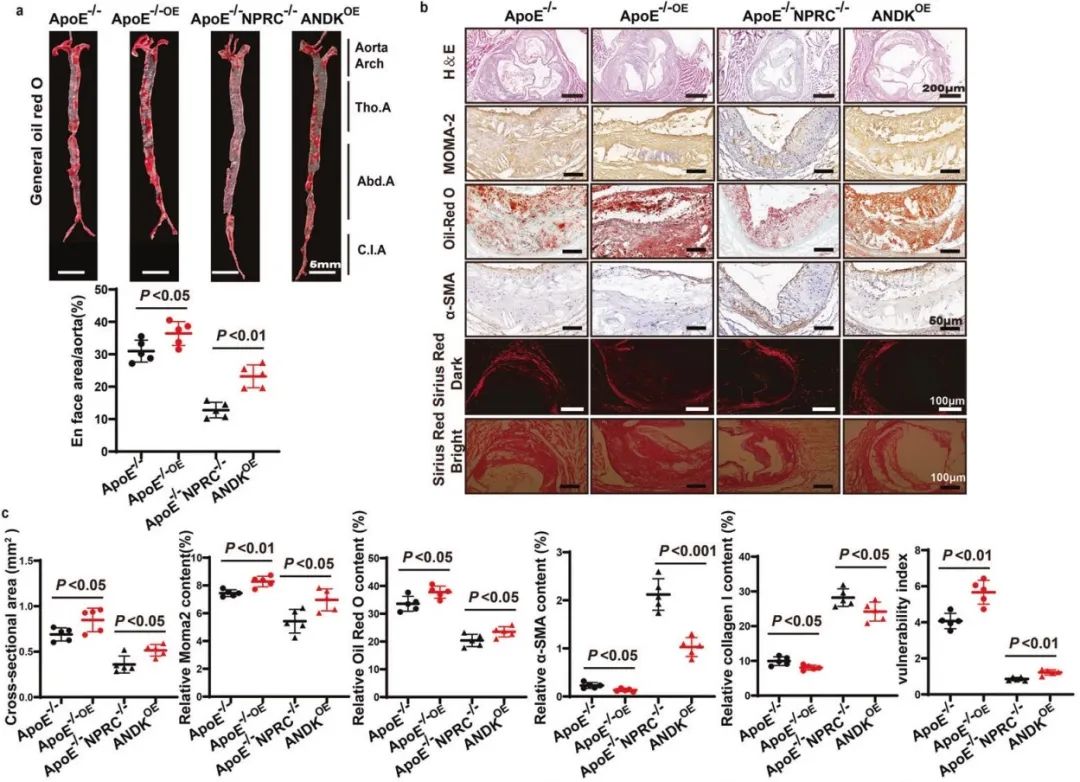
首先,作者收集了高脂喂养的ApoE-/-小鼠的主动脉组织,发现NPRC在AS病变中表达显著增加,提示NPRC可能促进了AS的发生和发展。为了明确NPRC与AS的关系,作者制备了ApoE-/-NPRC-/-小鼠和AS小鼠模型,结果显示,相对于ApoE-/-小鼠,NPRC缺失显著减轻了小鼠的AS病变并增加了斑块的稳定性。
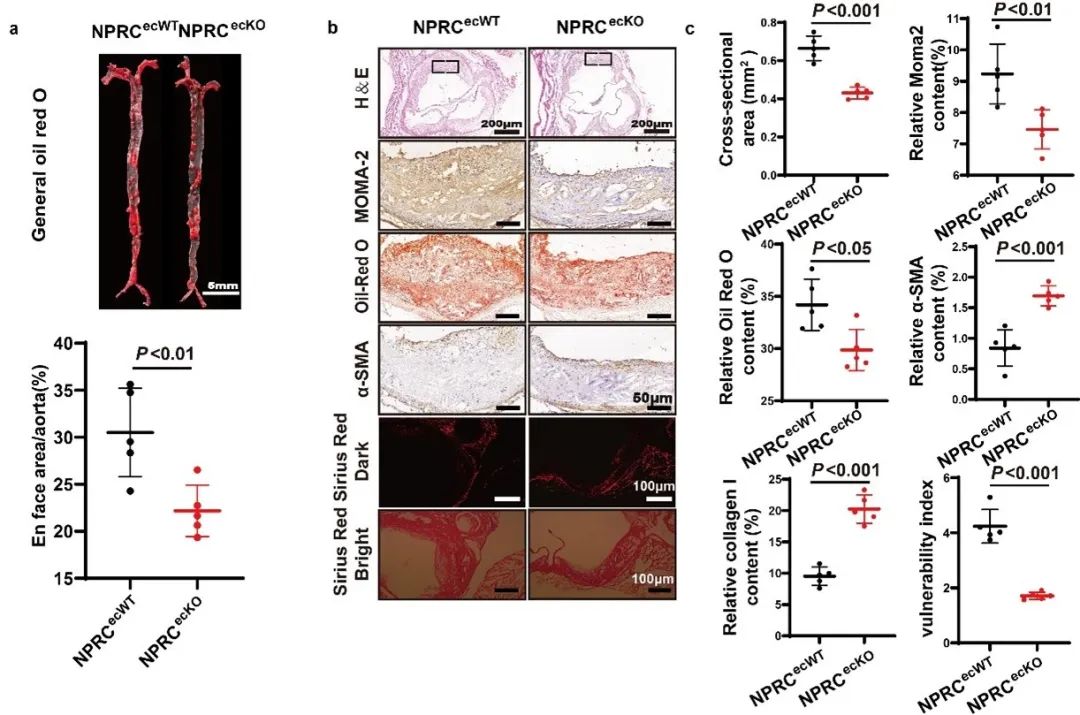
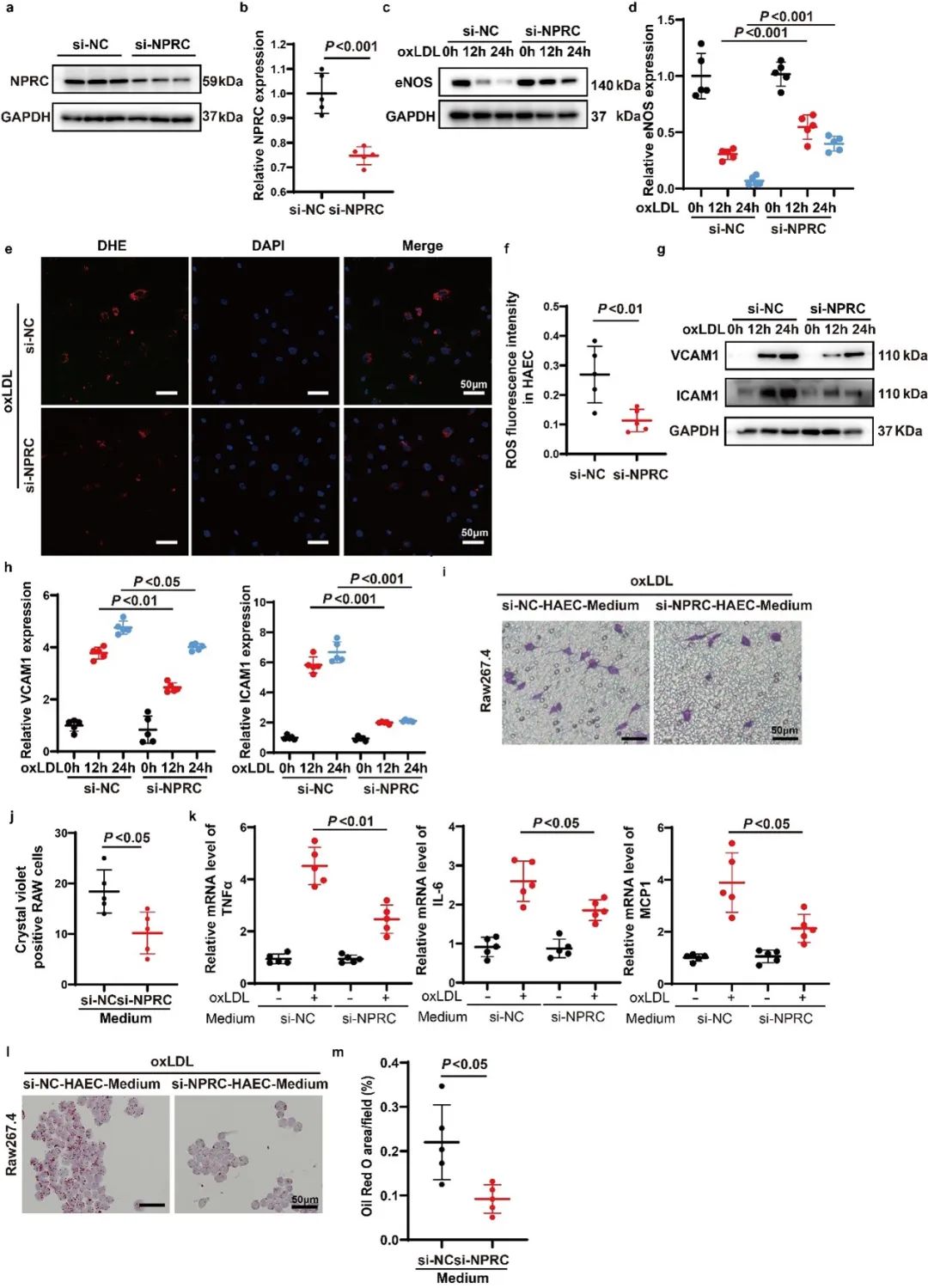
为了明确NPRC的作用机制,作者比较了NPRC在HAECs、VSMCs和巨噬细胞中的表达水平,发现NPRC在VSMCs中的表达低于HAECs,在巨噬细胞中的表达极低。此外,作者比较了有无AS病变主动脉组织之间NPRC的表达水平,发现内皮细胞中NPRC的表达上调,而在平滑肌细胞中的表达变化较小。这提示,内皮细胞中NPRC的缺失可能足以达到抗AS的效果。于是,作者制备了内皮细胞条件性敲除NPRC (NPRCecKO)的小鼠和AS小鼠模型。结果显示,内皮细胞特异性的NPRC缺失明显减轻了小鼠AS病变,同时减轻了局部和全身炎症,增加了斑块的稳定性。
内皮NO合成酶(eNOS)是内皮细胞中催化NO形成的关键酶,eNOS对于维持内皮功能和血管稳态起有关键作用。作者进一步探索了NPRC调控AS的机制,发现NPRC缺失可通过挽救eNOS表达来保护内皮细胞免受氧化应激。同时,NPRC敲低可抑制HAECs中促炎细胞因子的表达,从而抑制巨噬细胞迁移、细胞因子表达和吞噬。此外,NPRC敲低可通过增强AKT1的磷酸化来阻止oxLDL诱导的内皮细胞凋亡并通过抑制促炎的NF-κB信号通路来减轻炎症。
除了作为ANP、BNP和CNP的清除受体外,NPRC还通过其催化活性抑制鸟嘌呤核苷酸调节蛋白(Gi),从而降低环磷酸腺苷(cAMP)水平。深入的研究发现,NPRC缺失的有益作用机制涉及cAMP/PKA通路的激活,导致下游AKT1通路上调和NF-κB通路下调。
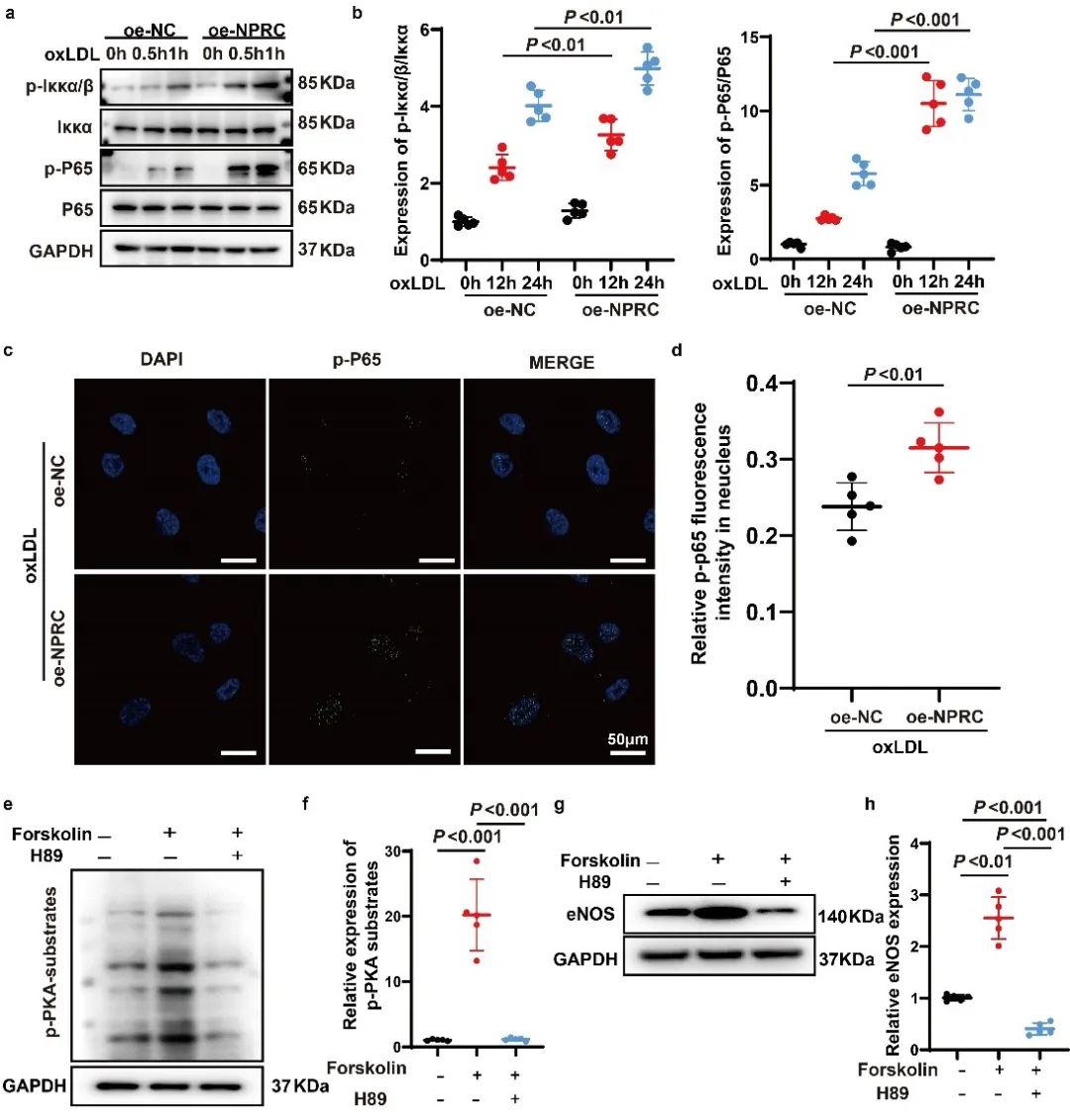
为进一步验证NPRC在AS病变形成中的角色, 作者通过注射AAV9构建了血管内皮细胞中过表达NPRC的小鼠和高脂喂养的AS小鼠模型,发现血管内皮中NPRC的过表达明显加重AS病变、降低AS斑块的稳定性。在分子机制上,过表达NPRC可抑制AKT1磷酸化、上调NF-κB通路,进而促进ApoE-/-小鼠炎症反应和细胞凋亡。
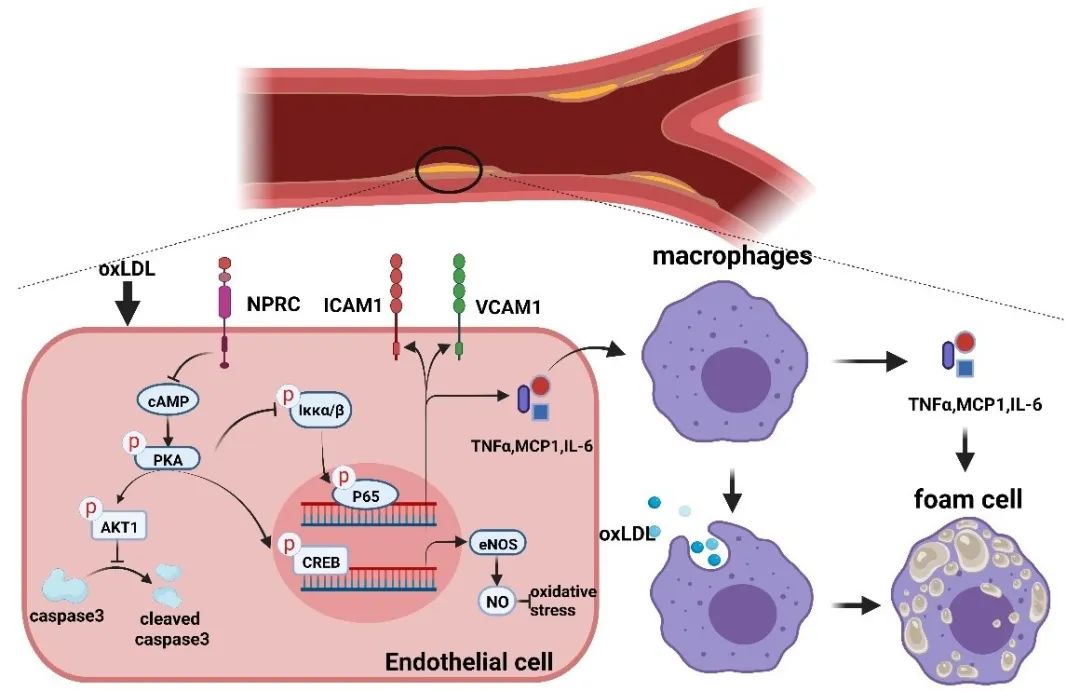
综上,NPRC在AS病变中的表达增加,NPRC的缺失减轻AS病变的大小并增加了斑块稳定性。在机制上,NPRC缺失可通过上调cAMP/PKA-AKT1通路和下调NF-κB通路减弱氧化应激、炎症和内皮细胞凋亡,并增加eNOS表达。因此,靶向NPRC可能为预防和治疗AS提供了一种新策略。
山东大学齐鲁医院张澄教授、张运院士和杨建民教授为该论文的通讯作者,山东大学齐鲁医院心内科博士生/中国医科大学附属盛京医院心内科博士后成程、山东大学齐鲁医院心内科博士后张杰、中国医科大学附属盛京医院心内科李晓东教授为论文的共同第一作者。山东大学齐鲁医院为第一和通讯作者单位。该研究工作获得了国家自然科学基金、国家重点研发计划等项目支持,得到了山东大学心血管重构与功能研究重点实验室动物中心的大力支持和帮助。
原文链接:
https://www.nature.com/articles/s41392-023-01560-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言