Nature:超6万人全基因组序列分析结果揭示:线粒体DNA插入人类基因组从未停止
2023-03-11 测序中国 测序中国 发表于安徽省
通过大规模的研究结合多层面的基因组数据,并根据NUMT的大小和基因组位置,研究团队绘制了一个高度异质性和动态的人类NUMT图谱。
导语
基因从细胞器转移到细胞核是线粒体起源的内共生理论的基础,大多数核-线粒体片段 (nuclear-mitochondrial segments, NUMT)被认为是古老的,早于人类物种形成。高等生物的线粒体基因组逐渐变小,反映了线粒体基因在进化过程中进入核基因组的易位,这促进了细胞质翻译机制对细胞器蛋白的协同合成,这一过程也在整个非编码空间中留下了非表达的线粒体DNA(mtDNA)片段。
大规模的全基因组测序(WGS)项目提供了一个比其他物种更深入地表征人类NUMT的机会。近期,WGS研究在人类中发现了超罕见的NUMT,这表明mtDNA-核转移是一个持续的过程,但种系NUMT形成的速率仍然未知。新的mtDNA -核转移可能会破坏蛋白质编码基因,进而导致疾病的发生,因此具有重要的研究意义。此外,将NUMT序列解释为mtDNA变体可能会混淆对线粒体疾病的诊断。
近日,英国剑桥大学、伦敦玛丽女王大学等机构的研究团队在Nature发表了题为“Nuclear-embedded mitochondrial DNA sequences in 66,083 human genomes”的文章。该研究绘制了包含66,000多个个体的NUMT图谱,其中包括英国十万人基因组计划中8,201个母-父-子三人组样本和12,509个肿瘤-正常组织对,并揭示了mtDNA序列插入核基因组(即NUMT)是一个不局限于过去且一直持续到今天的过程,新的插入一直都在发生。同时,该研究也为解释不同人群的mtDNA变异和理解核基因组进化提供了宝贵资源。
主要研究内容
研究团队分析了66,083名英国罕见病项目参与者的全基因组序列,其中包括12,500多名癌症患者,经过严格的质控(QC)和筛选标准,最终确定了1,637个不同的NUMT。结果显示,超99%的个体,至少具有一种NUMT;每8个个体中有一个人会携带超罕见的NUMT。结合稀有和超稀有NUMT与常见NUMT数据,研究团队共识别出1,564个此前未被报道过的NUMT。大多数NUMT是短插入(63.2%的NUMT小于200 bp,77.8%小于500 bp),且NUMT大小与总体频率呈反比关系(P=0.021)。

图1. NUMT的检测及鉴定。来源:Nature
接下来,研究团队研究了来自英国基因组学癌症项目的26,488个癌症WGS,在QC步骤之后,分析了来自代表21种癌症类型种系的肿瘤和健康组织的12,509个配对WGS。总体而言,肿瘤内不存在于参照序列的NUMT平均数量高于相应的正常组织。进一步,研究团队关注了肿瘤特异性NUMT,其不存在于任何其他非癌症基因组中,这些NUMT要么在导致癌症的体细胞组织中出现,要么在癌症自身中出现。
研究团队从10,713个肿瘤-正常数据对的251个肿瘤组织中发现了379个上述新生的NUMT,有82个肿瘤携带了一个以上的新生NUMT。分析显示,肿瘤特异性NUMT的平均数量为0.035,中位长度为396 bp,高于种系NUMT的数量,这与癌症驱动NUMT形成的理论一致。此外,具有新生NUMT的肿瘤的比例取决于肿瘤类型,例如,膀胱癌的NUMT比肾脏和结直肠肿瘤多7.5倍左右,膀胱癌的NUMT也比其他肿瘤类型更多。
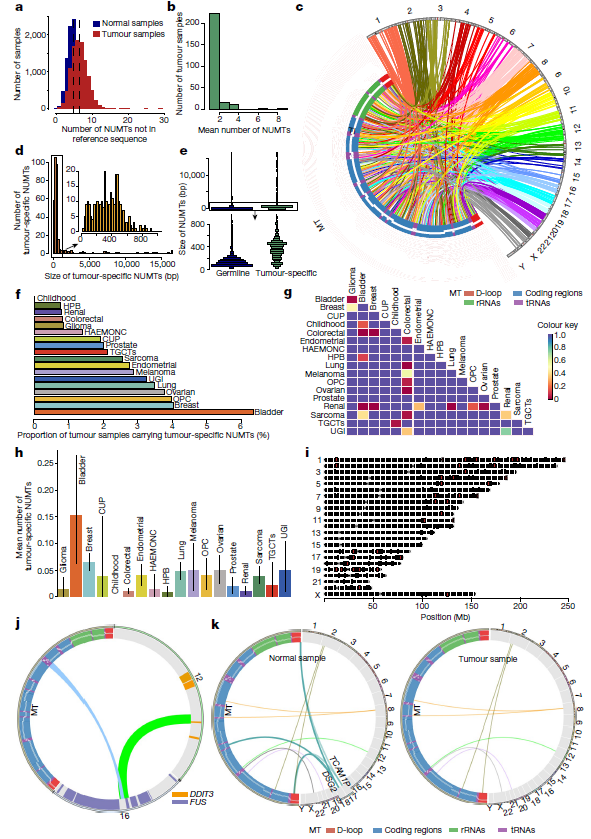
图2. 人类癌症中的NUMT分析。来源:Nature
NUMT的形成是一个持续的过程,约每104个出生中就会发生一次种系新生事件,每103个癌症中就会发生一次体细胞插入,这导致了人类群体中NUMT的高度多样性。mtDNA片段大量转移到细胞核基因组中,不可避免地会增加人类基因组的大小。但NUMT大小与其在人群中出现的频率呈负相关,这指向了一种平衡NUMT插入的选择性过程,即保持基因组大小并去除影响基因表达的NUMT。
PR结构域锌指蛋白9(PRDM9)与DNA双链断裂(DSB)修复有关,并在减数分裂过程中决定了交叉热点位点。研究团队发现,将NUMT与PRPRDM9结合位点共定位有助于在种系中去除影响基因表达的NUMT。通过共定位的方式,NUMT还可以充当类似膏药的“临时修复物”修复DSB,直至其在减数分裂期间被移除。此外,NUMT的形成涉及几种不同的分子机制,其都与核基因组的不稳定性有关,因此携带DNA修复致癌基因错义突变的肿瘤样本比其余肿瘤更可能存在肿瘤特异性NUMT。
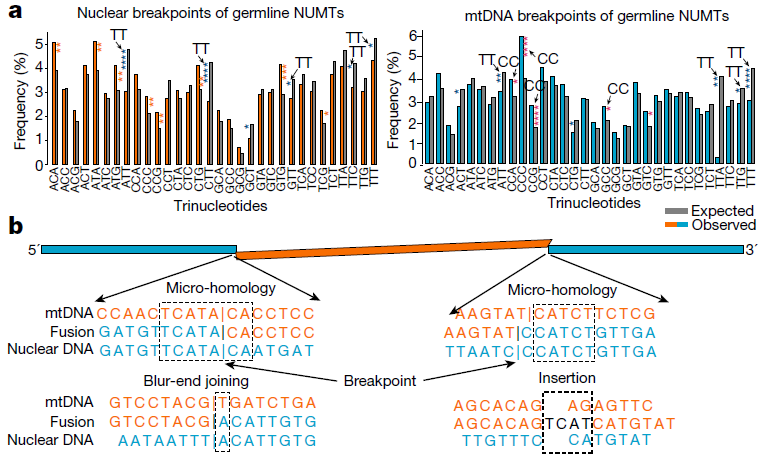
图3. NUMT形成的分子机制。来源:Nature
为了了解mtDNA序列插入核基因组后的分子进化,研究团队确定了931个不同的NUMT的完整核苷酸序列,包含144,805 bp。随后,研究团队估算了429个NUMT插入的年龄。结果显示,大多数(超过90%)NUMT插入的年龄小于10万年,41个(9.5%)年龄超过10万年,其范围可达375万年。与预期一致,较老的NUMT在人群中更常见,较年轻的NUMT更容易携带NUMT特异性突变。上述研究结果表明,在整个人类进化过程中,NUMT的插入和进化一直在进行。

图4. NUMT序列的分子进化。来源:Nature
结语
综上所述,通过大规模的研究结合多层面的基因组数据,并根据NUMT的大小和基因组位置,研究团队绘制了一个高度异质性和动态的人类NUMT图谱。该研究中确定的NUMT的信息表明,非编码mtDNA比线粒体基因组中的编码序列更容易插入到人类细胞核基因组中,这些插入似乎也过量出现在DSB修复和重组热点的PRDM9结合位点上,这些热点在减数分裂中比较活跃。
剑桥大学临床神经科学和线粒体生物学研究员Patrick Chinnery表示:“NUMT被认为是以前mtDNA转位事件的古老残余,这些事件经常在相关物种之间共享,我们的研究表明,NUMT是一个持续的过程。序列一旦嵌入,就不再受线粒体中所见的进化约束,NUMT特异性突变与线粒体DNA具有不同的突变特征。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言