26天拿证 医疗器械注册人制度产品在上海落地
医疗器械注册人制度改革后,符合条件的医疗器械注册申请人可以单独申请注册证,然后委托给有资质和生产能力的生产企业。
新华网 - 医疗器械,注册人,制度 - 2018-02-27
医疗器械产业现状及创新发展思考
5月16日来自中国医疗器械行业协会的姜峰常务副会长就医疗器械的产业现状及创新发展发表了做了简要介绍,梅斯小编现将主要内容整理如下与大家分享。一、 全球医疗器械产业发展现状 1、概述 全球医疗器械产值约占医药行业总产值42% 发达国家药械市场比例达1:1 近年成为发达国家提升生物医药产业和高端装备制造业的重要抓手
MedSci原创 - 2017-05-17
医疗器械召回:何必谈虎色变
这一行为的实施者,除了常见的汽车制造商,还有医疗器械生产商。但如同每逢汽车召回总引发国内民众担忧质量和安全一样,医疗器械召回也常常招致医疗机构忧心忡忡。其实,医疗机构貌似熟悉的“召回”,仍存在陌生或被误读的一面。召回公示背后医疗行业的很多人知道,国家食品药品监督管理总局(下称“国家药监局”),履行着一项重要职能——建立医疗行业问题产品的召
健康界 - 医疗器械,召回,谈虎色变 - 2017-10-15
陕西鼓励药品医疗器械创新:仿制新药优先纳入医保
陕西省政府新闻办举行发布会,解读《陕西省深化审评审批制度改革鼓励药品医疗器械创新的实施方案》,鼓励药品医疗器械创新和促进仿制药发展。
华商报 - 医疗器械,创新,仿制药 - 2018-11-03
国务院批复方案,打造北京医疗器械创新中心
国务院批复了关于全面推进北京市服务业扩大开放综合试点工作方案,同意在北京市继续开展和全面推进服务业扩大开放综合试点,期限为自批复之日起3年。
中国医药报 - 国务院,医疗器械,政策 - 2019-02-27
上海今起试点医疗器械注册人制度:急需医疗器械可委托生产
医疗器械企业研发的临床急需医疗器械,因为生产能力不足无法生产,这对医疗成果的转化是一道绕不开的槛。12月7日,上海市食品药品监督管理局媒体通气会透露,上海当日起正式实施“医疗器械注册人制度”,率先在上海自贸区内试点。今后,医疗器械注册人,酌情可委托生产,加快急需医疗器械上市的步伐。记者从会上获悉,“医疗器械注册人制度”是指,符合条件的医疗器械注册申请人可以单独申请医疗器械注册证,然后委托给有资质和
澎湃新闻 - 医疗器械,制度创新,自贸区 - 2017-12-07
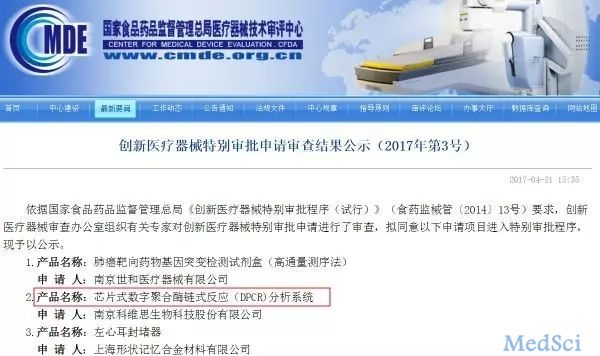
数字PCR获创新医疗器械特别审批,助力肿瘤液体活检
近期,生物探索在国家食品药品监督管理总局医疗器审评中心(CMDE)官网注意到“芯片式数字聚合酶链式反应(DPCR)分析系统”进入创新医疗器械特别审批程序。DPCR凭借其创新特色,可以与高通量测序(NGS)平台实现优势互补,有望成为支撑液体活检的重要平台之一。
生物探索 - 数字PCR - 2017-06-05
宁夏:自2020年起药品医疗器械产品注册收费标准降低50%
12月31日,记者从《药品管理法》宣贯暨2019年宁夏药品监管工作整体情况通报新闻发布会上获悉,宁夏回族自治区药品监督管理局决定自2020年1月1日起,将宁夏药品、医疗器械产品注册收费标准降低50%。
中国新闻网 - 宁夏,医疗器械,收费标准 - 2020-01-01
数智创新开启加速度,本土医疗器械创新正走向全球
当前,以数智创新为主线的新一轮医药产业革命,不断加速医疗成果转化。从创新到应用,从技术到产业,数智化是科技进步的必然结果,也是医疗产业变革的核心动力和数字经济的关键支撑。
梅斯医学 - 2023-12-31
医疗器械产品受益-风险判定技术指导原则(2023修订版)
为加强医疗器械注册申报和技术审评指导,国家药监局器审中心组织制定和修订了《医疗器械产品受益-风险判定技术指导原则(2023修订版)》等4项医疗器械产品注册审查指导原则,现予发布。
国家药品监督管理局官网 - 医疗器械 - 2024-02-02
列入免于临床评价医疗器械目录产品对比说明技术指导原则
本文为国家药品监督管理局医疗器械技术审评中心发布的《列入免于临床评价医疗器械目录产品对比说明技术指导原则》。
国家药品监督管理局医疗器械技术审评中心 - 医疗器械 - 2024-04-23
六部委发文,重点发展10类医疗器械产品
6月7日,科技部、卫计委、体育总局、食药总局、国家中医药管理局、中央军委后勤保障部共同印发了《“十三五”卫生与健康科技创新专项规划》的通知,就“十三五”卫生与健康科技创新提出了发展目前、重点任务和保障措施其中,在重点任务中,六部委明确提出要“加强创新医疗器械研发,推动医疗器械的品质提升,减少进口依赖,降低医疗成本”。通知提出,在医疗器械研发方面,重点突破一批引领性前沿技术,重点发展医学影像设备、
赛柏蓝器械 - 医疗器械 - 2017-06-09
这285人将决定医疗器械产品的分类
2017年3月7日,CFDA官网公示了医疗器械分类技术委员会专业委员候选人名单,共有16个专业组285名委员入选。根据专业组委员的职责与义务,这285名委员将直接参与本组相关医疗器械产品的风险评估、分类界定、分类目录维护等工作。
生物探索 - 医疗器械,CFDA - 2017-03-11
国家药监局发布《创新医疗器械特别审查申报资料编写指南》
12月18日,国家药监局发布《关于发布创新医疗器械特别审查申报资料编写指南的通告(2018年第127号)》,通告称,为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),进一步做好《创新医疗器械特别审查程序》(国家药品监督管理局公告2018年第83号)规定的创新医疗器械申报资料编写和技术审查工作,国家药品监督管理局组织制定了《创新医
国家药监局 - 医疗器械,国家药监局 - 2018-12-19
以医疗器械作用为主的药械组合产品注册审查指导原则
为加强对药械组合产品注册工作的监督和指导,进一步鼓励具有临床价值的药械组合产品上市,构建适合我国国情的药械组合产品的管理模式,国家药品监督管理局将药械组合产品技术评价作为监管科学研究项目,组织制定了《
CDE - 医疗器械 - 2022-01-24
为您找到相关结果约500个