《接受药品境外临床试验数据的技术指导原则》正式发布
今天,国家药品监督管理局发布了《接受药品境外临床试验数据的技术指导原则》,对接受境外临床试验数据的适用范围、基本原则、完整性要求、数据提交的技术要求以及接受程度均给予明确。
国家药品监督管理局官网 - 国家药监局,药品境外临床试验数据 - 2018-07-10
使用体外诊断试剂境外临床试验数据的注册审查指导原则
本文为国家药品监督管理局医疗器械技术审评中心发布的《使用体外诊断试剂境外临床试验数据的注册审查指导原则》。
国家药品监督管理局医疗器械技术审评中心 - 体外诊断试剂 - 2024-04-20
成人用药数据外推至儿科人群的定量方法学指导原则(试行)
为提高儿科药物研发效率,指导业界合理应用外推方法,药审中心组织制定了《成人用药数据外推至儿科人群的定量方法学指导原则(试行)》。
国家药品监督管理局药品审评中心 - 用药数据,定量方法学 - 2023-04-13
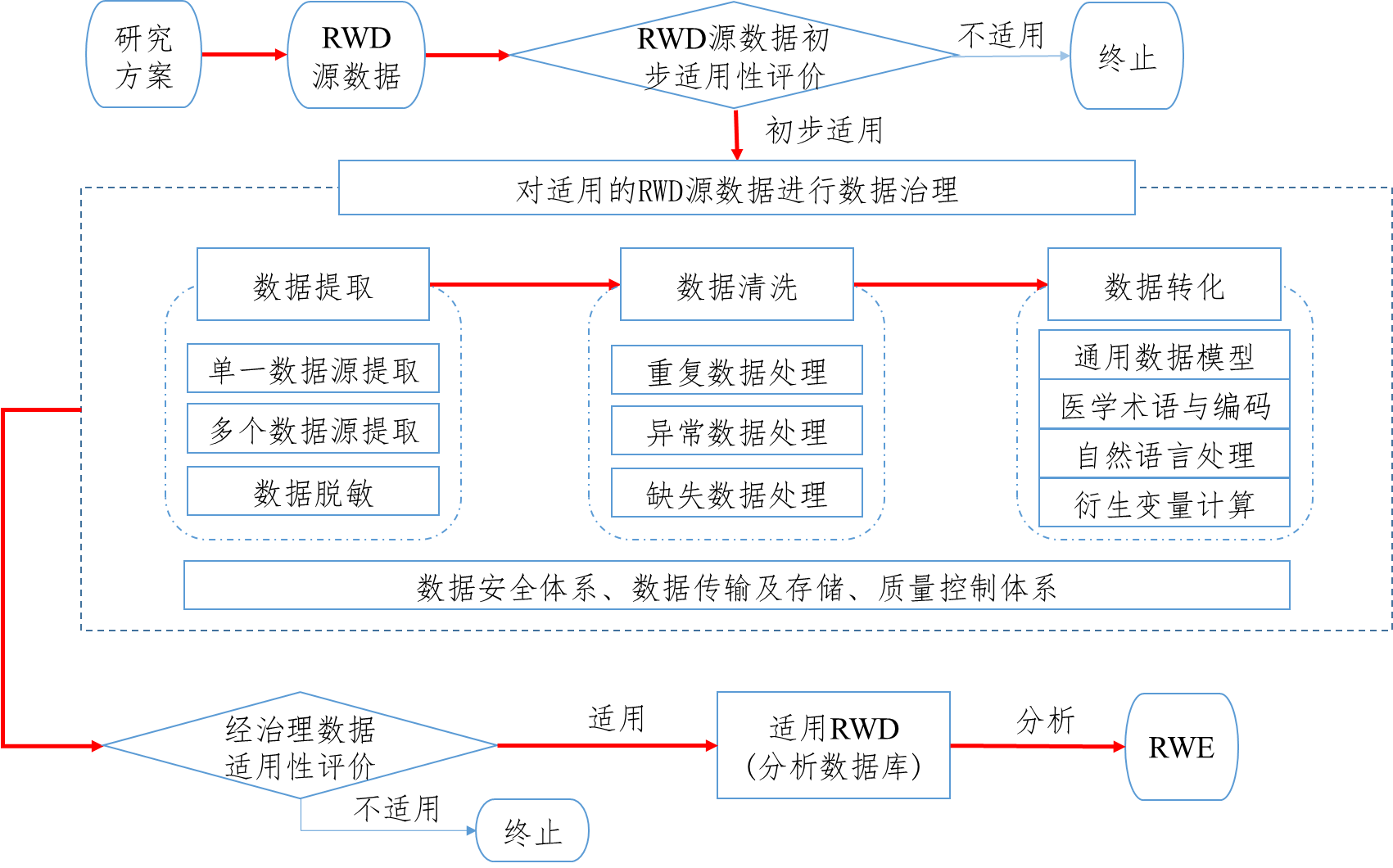
用于产生真实世界证据的真实世界数据指导原则(征求意见稿)
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,我中心组织起草了《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》,现在中心网站予以公示,以广泛听取各界意见和建议,欢迎
CDE - 真实世界证据,真实世界研究 - 2020-08-03
【2017海峡会】CAMI 研究历经5年:用数据指导中国临床实践
发达国家心血管疾病发病率和死亡率都在下降,而我国仍持续上升。存在哪些问题?该怎么办?这就是中国急性心肌梗死注册登记(CAMI)研究的出发点。
中国循环杂志 - 2017海峡会,CAMI,数据指导,临床实践 - 2017-11-17
【英文】ICH指导原则:基因组采样和基因组数据管理指导原则(中文翻译公开征求意见稿)E18
这份指导原则的主要目的是提供临床研究中基因组采样和基因组数据管理的协调性原则。通过对关键因素建立共识,本指导原则将有助于促进基因组研究的开展。
国家药品监督管理局官网 - 基因组 - 2023-10-24
【中文】ICH指导原则:基因组采样和基因组数据管理指导原则(中文翻译公开征求意见稿)E18
这份指导原则的主要目的是提供临床研究中基因组采样和基因组数据管理的协调性原则。通过对关键因素建立共识,本指导原则将有助于促进基因组研究的开展。
国家药品监督管理局药品审评中心 - 基因组 - 2023-10-24
临床试验数据监查委员会指导原则(征求意见稿)
《临床试验数据监查委员会指导原则》起草说明 一、背景和目的近年来,随着国内新药临床试验的不断发展,数据监查委员会(Data Monitoring Committee,DMC)在试验中的使用逐渐增多DMC是一个独立的具有相关专业知识和经验的专家组,负责定期审阅来自一项或多项正在开展的临床试验的累积数据,旨在保证临床试验中受试者的安全性、继续试验的合理性及科学价值。本指导原则主要阐述DMC
临床试验 - 2019-10-31
用于产生真实世界证据的真实世界数据指导原则(征求意见稿)
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,我中心组织起草了《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》,现在中心网站予以公示,以广泛听取各界意见和建议,欢迎
CDE - 指导原则 - 2020-09-01
抗肿瘤药物说明书不良反应数据汇总指导原则(征求意见稿)
随着抗肿瘤药物研发的进展,越来越多的研究表明,一种药物可以应用于不同瘤种、同一瘤种的不同阶段或人群,还可以与不同作用机制的药物联合。随着研究人群不断扩大,积累的安全性信息也越来越多。
CDE - 抗肿瘤药物 - 2021-08-23
药物临床试验数据管理与统计分析的计划和报告指导原则
虽然我国《药物临床试验质量管理规范》(Good Clinical Practice,GCP)中对药物临床试验数据管理与统计分析进行了原则要求,且国家食品药品监督管理总局已发布的有关药物临床试验及其统计学的相应技术指南也涉及数据管理和统计分析工作的主要环节,但针对数据管理计划和报告、统计分析计划和报告却没有详细的技术规范和指导性建议。因此,本技术指导原则对此进行了较为详细的介绍和阐述,并提出具体要求
国家食药监总局 - 药物临床试验数据管理与统计分析,计划和报告 - 2016-08-01
【NMPA】公开征求《真实世界数据用于医疗器械临床评价技术指导原则》意见
各有关单位: 真实世界数据作为医疗器械临床评价可能的数据来源,因其具有数据资源丰富、研究结果的外推性可能较好、可获得长期临床结局数据等特点,日益受到监管机构、行业等各方重视。2019年4月国家药品监督管理局发布了中国药品监管科学行动计划,把“将真实世界数据用于医疗器械临床评价的方法学研究”列为首批研究项目,探索将真实世界数据用于监管决策的可行性和方法学,为医疗器械审评审批制度改革
CMDE - 真实世界 - 2019-12-30
为您找到相关结果约500个