述评:纳米颗粒和外泌体靶向载药系统诊治动脉粥样硬化的机遇与挑战
2023-01-23 中国全科医学杂志 中国全科医学杂志 发表于安徽省
纳米颗粒载药系统的有效性大多已在实验中得到证明,由于生物相容性、循环t1/2和药物在体内滞留量等方面存在问题,临床转化依然是一项重大挑战。未来的工作需致力于提高其靶向精准性和降低不良反应的研究。
述评专栏
纳米颗粒和外泌体靶向载药系统诊治动脉粥样硬化的机遇与挑战
- 本文来源 -
刘滔滔,李天容,王雪,等. 纳米颗粒和外泌体靶向载药系统诊治动脉粥样硬化的机遇与挑战[J]. 中国全科医学, 2023, 26(08): 903-910.(点击文题阅读原文):backhand_index_pointing_left:
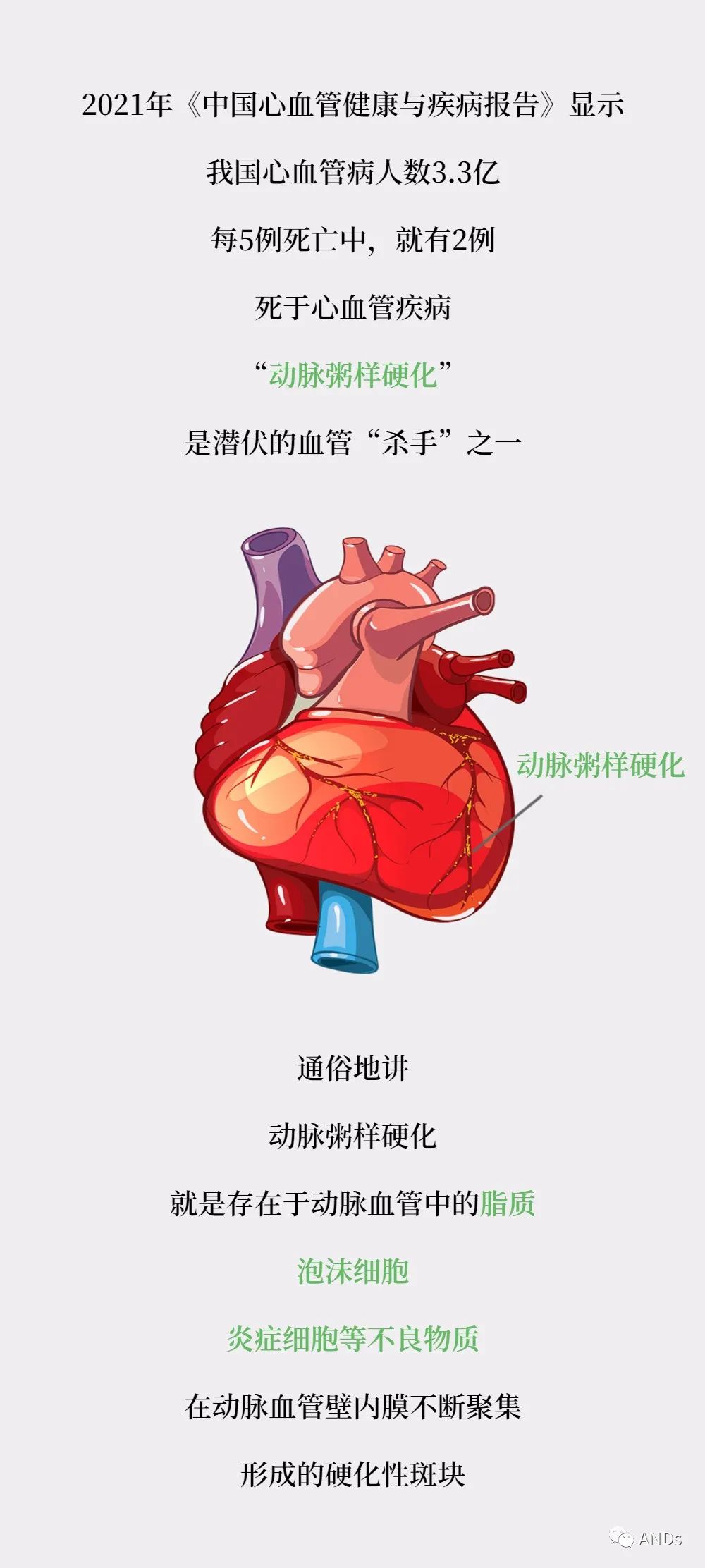
心血管疾病是世界范围内发病率和死亡率较高的疾病。动脉粥样硬化作为多数心血管疾病的病理基础,是一种由慢性炎症引起动脉管壁增厚为特点的疾病。内皮细胞功能障碍引起恶性循环继而促进血管平滑肌细胞的增殖和细胞外基质的重建,最终导致动脉粥样硬化斑块的形成。血浆中低密度脂蛋白的升高是导致动脉斑块进展的主要因素之一。目前,动脉粥样硬化的治疗方法包括调控血脂、抗血小板聚集、抑制血栓形成等手段。他汀类药物是血脂异常药物治疗的基石,在国内外动脉粥样硬化性心血管疾病防控中具有重要作用,然而临床中常出现他汀类药物不耐受(常规剂量)而发生的肌病。为了减少药物带来的不良反应并提高治疗效率,探索新的给药形式干预动脉粥样硬化具有重要意义。
纳米技术和医学相结合应用前途广阔,随着纳米技术的飞速发展,基于纳米载体的给药系统引起了人们广泛关注。纳米技术增加全身药物循环时间、降低药物的非靶点细胞毒性、改善药物的溶解性、降低所需剂量、将诊断和治疗药物结合起来形成治疗药物以及增加药物在特定部位的积累来用于动脉粥样硬化的治疗。近几年报道了各种工业纳米颗粒和工程化载药外泌体靶向给药平台,包括树枝状结构大分子、胶束、免疫脂质体、巨噬细胞仿生纳米颗粒、DNA包裹的纳米颗粒、基于红细胞的核-壳结构纳米复合物等用于药物靶向输送诊治动脉粥样硬化。其输送效率取决于自身尺寸、形状、表面参数、疏水性及其生物理化特性。此外,毒性问题同样需要深入研究来确保在临床中的用药安全。本文综述了近年开发的几种代表性靶向给药平台,并分析其在结构特性以及在动脉粥样硬化疾病诊治中的机遇和挑战。
1.文献检索策略
在英文数据库PubMed、Web of Science中检索并设定检索时间为2007-01-01至2022-10-01。检索词为"nanoparticle" and "atherosclerosis" "exosomes" and "targeted therapy" "atherosclerosis" and "exosomes" "nanoparticle" and "targeted therapy" 。纳入标准:纳米颗粒及外泌体靶向治疗动脉粥样硬化机制及药效研究的相关高质量文献;排除标准:与动脉粥样硬化靶向治疗不相关、质量差及重复性研究文献,最终纳入61篇文献进行综述
2.纳米靶向成像策略在动脉粥样硬化诊断中的运用
目前,动脉粥样硬化的主要成像技术包括血管内超声(IVUS)、计算机断层扫描(CT)、正电子发射断层扫描(PECT)、核磁灌注成像(PWI)和磁共振成像(MRI)。尽管这些成像技术在评估动脉粥样硬化斑块的状态方面迈出了重要一步,随着医疗技术的发展,需要更有针对性和更精确的策略来进一步改善治疗结果。而纳米靶向给药系统为高效诊断动脉粥样硬化带来了新的希望,合成的靶向性纳米颗粒作为新型造影剂引入到传统成像系统中开发出纳米靶向成像平台。
2.1 基于MRI的纳米靶向成像平台
NANDWANA等通过在磁性纳米结构表面添加磷脂和定义高密度脂蛋白(HDL)的载脂蛋白A1(ApoA1)来模仿天然HDL颗粒合成高密度脂蛋白样磁性纳米结构(HDL-MNS)。在成像效果上对比T2 MRI造影剂Ferumoxytol,HDL-MNS在7T MRI中的对比度(r2=383 mM-1s-1)是其5倍。此外,HDL-MNS与天然HDL功能相同,能促进胆固醇流出,且能达到天然HDL排泄效率。OUMZIL等将氧化铁颗粒和具有抗血小板聚集的前列环素负载至固体脂质纳米粒(SLN)上,用于图像引导治疗。在成像方面相比于临床常用造影剂Feridex:registered:,SLN在4.7T MRI中的对比度(r2=557 mM-1s-1)是其2.6倍。
◆ 优点:(1)鉴于近年的发展,将纳米氧化铁引入MRI为动脉粥样硬化的诊断提供新的解决方案;(2)与商业氧化铁MRI造影剂相比,大多数临床前氧化铁纳米颗粒的MRI对比度更好,如Feridex:registered:、FeREX:registered:、Resovist:registered:;(3)氧化铁纳米颗粒可以通过与组织学试剂、抗体和转染剂结合而提高对特定细胞或组织器官靶向灵活性。总体而言,纳米氧化铁仍将是未来MRI的主要研究方向。
◆ 缺点:(1)细胞毒性问题是阻碍其临床转化的主要原因之一;(2)不能克服成像所带来的"伪影";(3)纳米颗粒引入并没有缩短信号采集时间,提高扫描效率。
2.2 基于荧光的纳米靶向成像平台
除了MRI,荧光剂也通常用于定位和检测动脉粥样硬化病变。LU等开发了靶向炎症巨噬细胞的光动力硒纳米颗粒(SeNPs)。体外研究表明,与未刺激的巨噬细胞相比,SeNPs在脂多糖(LPS)刺激的巨噬细胞中提供了更强的Rb荧光信号。光毒性研究表明,SeNPs能以过氧化氢酶的形式杀死活化的巨噬细胞,同时也有效地降低了LPS刺激的巨噬细胞的H2O2水平(85.2%)。
在另一项针对纳米粒子靶向治疗巨噬细胞的研究中,KOSUGE等设计了一种用Cy5.5染料功能化的单壁碳纳米管(SWNT),可用于炎症巨噬细胞的近红外成像。体外近红外成像显示,经SWNT处理的小鼠结扎的左侧颈动脉有较强的近红外信号,而未经SWNT处理的小鼠无近红外信号。
◆ 优点:(1)传统的荧光诊疗平台因成像精准性和深层治疗效果较差一直阻碍其在生物医学中的应用。相较于传统由可见光(400~700 nm),近红外荧光平台(NIR,700~1 400 nm)可以明显提升荧光成像的清晰度和分辨率。(2)NIR-Ⅱ光热治疗也极大提升了深层疾病的治疗效果。未来NIR光热荧光诊疗平台将成为荧光靶向平台研发热点方向之一。
◆ 缺点:在过去的几十年,用于生物成像的小分子荧光探针的发展经历了巨大的努力。然而,受限于小分子本身,仍有一些瓶颈尚未被克服:(1)小分子探针的抗光漂白能力差,限制了其在长期体外/体内生物标志物追踪和持久性细胞标记领域的应用。(2)NIR探针的发展主要取决于紫外可见荧光团的修饰和转化。这从合成的角度来看是繁琐且昂贵的,得到的近红外荧光团分子比较大,其水溶性和药代动力学特性可能需要改进。(3)敏感性差。许多已开发的近红外小分子探针不能检测代表动脉粥样硬化疾病发生的生物标志物,而这些标志物在生物体内通常以非常低的浓度存在。
2.3 基于CT的纳米靶向成像系统
CHHOUR等合成了金纳米粒子(AuNP)。在体内动物实验中,将金标记的原代单核细胞注射到接受西方饮食10周的ApoE-/-小鼠体内,用微型CT扫描仪进行成像,与对照组相比,接受金标记细胞的小鼠主动脉中的衰减显著增加。此外,对斑块进行切片和电子显微镜检查再次验证了AuNP能够靶向斑块内单核细胞。
QIN等开发了一种简便的方法来合成无毒和良好的生物相容性好的金纳米棒(Au-NRs)用于体外和体内巨噬细胞的高效成像和光热消融。巨噬细胞的显微CT成像显示信号强度呈浓度依赖性增加。ApoE-/-小鼠的体内热疗表明,静脉注射Au-NRs后,发炎股动脉的CT强度略有增强。这种纳米系统已被证明是无毒的,有望成为诊治动脉粥样硬化的新平台。
◆ 优点:(1)通过纳米颗粒的单光子发射计算机断层成像术(SPECT)和CT的双模式成像也被用来揭示斑块发展过程中的炎症动态和抗炎治疗。(2)作为临床上常用的成像技术之一,CT通常使用X射线结合敏感的探测器来做断层扫描,其能提供快速的扫描时间和清晰的图像,在许多疾病的诊断中起关键作用。(3)纳米颗粒除了与PECT的双模式成像共同作用外,CT还可以与其他成像方式共同作用,获得更高质量的诊断图像。
◆ 缺点:CT成像技术本身存在辐射照射,在临床诊疗过程中不太可能在短时间内进行多次扫描。未来,低辐射、高灵敏度和靶向性高的纳米颗粒将是新的开发方向。
3.纳米技术药物输送系统靶向治疗动脉粥样硬化需要解决的问题
3.1 影响药物输送效率的因素
纳米给药系统处于抗动脉粥样硬化治疗模式发展的前沿。近几年,基于动脉粥样硬化病理过程,研究人员设计了纳米颗粒作为治疗或显像剂的输送载体,最终目标是改善临床症状。为了实现这一目标,被组装的纳米颗粒要求能够高效输送到特定组织,并且具有细胞特异性和亚细胞精确性。这种有效且高效的纳米药物递送需要完全控制体内纳米颗粒的转运。然而,这种控制水平尚未实现,也是开发纳米平台的重要挑战之一。为解决这一问题,研发人员需要更好地理解纳米颗粒如何与生物系统相互作用的基本概念。
用聚乙二醇(PEG)或"聚乙二醇化"包覆纳米颗粒表面,是提高药物和基因输送到靶细胞和组织效率的常用方法。通过改变PEG分子量、PEG表面密度、纳米粒核心性质可调节PEG包裹纳米颗粒体循环时间。表1从类型、粒径、靶点、小鼠模型等几个方面汇总了近年报道的一些纳米给药平台。
表1 2017—2022年报道的纳米靶向系统

(点击查看大图)
3.2 膜包裹仿生纳米颗粒
◆ 设计思路:研究表明,血小板和炎性细胞参与动脉粥样硬化斑块的形成。这一行为被用来开发血小板膜伪装纳米颗粒,其能够将治疗药物靶向输送至动脉粥样硬化斑块处。SONG等[32]开发了血小板膜包裹纳米颗粒(PNP)介导雷帕霉素靶向给药的新方法治疗动脉粥样硬化,研究在小鼠体内和体外检测了PNP对动脉粥样硬化的靶向性,并对比了单独给药雷帕霉素和PNP负载雷帕霉素(RAP-PNP)、雷帕霉素聚乙二醇化纳米粒(RAP-NP)这3种方式抗动脉粥样硬化的疗效。PNP靶向递送雷帕霉素可显著增强其抗动脉粥样硬化活性。RAP-PNP通过减少坏死灶和巨噬细胞数量,升高平滑肌细胞数,增加胶原蛋白,显著延缓动脉粥样硬化的进展,稳定斑块。
◆ 需要解决的问题:(1)自从膜包裹的仿生纳米颗粒首次报道以来,无数的研究探索了其诊断和治疗潜力。如上所述,这种仿生纳米技术可延长药物循环时间,并赋予纳米粒子活性靶向性和炎性细胞因子中和活性来治疗心血管疾病。然而,如果对复杂细胞膜的性质仍然缺乏基本的了解,输注不适当的细胞膜进入体内则会产生严重的溶血反应。因此,应优先考虑采用自体细胞膜。(2)此外,膜包裹纳米颗粒的研究仍停留在实验室阶段,应该加强对其安全性评估以加快实现其临床应用。
3.3 多肽两亲性(PA)超分子纳米结构
◆ 设计思路:ApoA1是高密度脂蛋白胆固醇的主要蛋白质成分,能够促进胆固醇从动脉粥样硬化斑块中流出。然而,由于ApoA1是一种大而疏水的蛋白(21~31 kDa),直接合成并加入治疗剂中是不可行的。将18个氨基酸的ApoA1模拟肽(称为"4F")共价结合至PA上可以解决这个问题。这种肽的大小约是内源性ApoA1的1/10,使得其更容易合成和融入纳米材料,同时还保留了ApoA1在动物中的胆固醇外流和结合作用。因此,将4F肽结合到PA中得到可以靶向斑块的纳米载体——ApoA1 PA。
动脉粥样硬化长期的炎症会诱导炎症细胞和凋亡的血管平滑肌细胞释放基质金属蛋白酶(MMPs),这些间质胶原酶会分解胶原,从而导致纤维帽变薄和斑块失稳。胶原蛋白的裂解位点,由肽序列[VPMS-MRGG]或Col-1肽识别,由MMP-1识别并经历快速降解。CHIN等将Col-1肽纳入肽两亲胶束(PAM)纳米颗粒中,并用单核细胞趋化蛋白1(MCP-1)的C-C趋化因子受体2(CR2)合基序功能化,以靶向和治疗不稳定的动脉粥样硬化斑块。为了提供临床相关性和适应性,在胶束上加入了钆饰得到单核细胞结合、胶原酶抑制和钆修饰的肽两亲性胶束(MCG PAM)以允许同时对斑块进行分子MRI。通过MRI,MCG PAM在体内显示了增强的靶向性和对患病小鼠斑块的成功检测。在组织学上,MCG PAM处理的小鼠与非靶向胶束或PBS处理的小鼠相比,纤维帽厚度分别增加了61%和113%,这体现了MCG PAM在动脉粥样硬化小鼠易损斑块的靶向、诊断和治疗方面的潜力。
PA可以和多种生物活性基元相结合从而达到诊疗的目的。基于这些背景,未来PA的研发方向是开发出诊疗一体的靶向平台。
◆ 需要解决的问题:PA由于具有良好的生物相容性、功能性、设计和合成的灵活性以及作为药物载体的巨大潜力,被广泛应用于生物医学领域。然而,在发展两亲性自组装肽方面仍有一些问题需要解决。(1)为了成功地过渡到临床应用,两亲性多肽的自组装结构必须能够被操纵以产生特定尺寸和形状的纳米结构,并且具有更高的稳定性和靶向性,以及递送效率。(2)其次,对于通过调整氨基酸残基达到载药(治疗)效果的PA可能会影响其生物学活性。因此,两亲性自组装肽的形态、物理化学性质与生物活性之间的关系有待于进一步研究和探索。(3)PA的免疫原性需要更深入的研究,因为非免疫原性有利于疏水药物、核酸药物和多肽药物的传递,而免疫原性有利于疫苗的传递。
3.4 介孔二氧化硅纳米材料(MSNs)
◆设计思路:随着纳米技术的飞速发展,基于纳米载体的给药系统引起了人们广泛关注。介孔二氧化硅以其尺寸灵活、比表面积大、孔体积可控、载药量高、生物相容性好、水热稳定性好、表面可化学修饰等优点,被广泛应用于纳米药物平台的构建。基于MSNs的药物载药方法主要有物理吸附和溶剂挥发。其中,物理吸附方法是将MSNs浸泡在含药溶液中,直到达到平衡,并且多数药物渗透到载体的孔道中。另一种药物装载方法是溶剂蒸发,其结合了物理吸附和随后的快速溶剂蒸发。溶剂蒸发法的药物溶出速度快于物理吸附法。
孔隙形态对药物的载药和释放有很大影响。WANG等报道了具有连通孔结构的MCM-48比具有非连通孔网络结构的MCM-41具有更快的溶出速率。此外,具有三维笼状立方介孔结构的SBA-16溶出速度比具有二维六边形排列的MCM-41表现得更快,这是因为相互连通的孔结构减少了扩散阻碍,并促进了药物向溶出介质中的扩散。ZHANG等采用3种不同孔径的球形MSNs作为载体负载替米沙坦(TEL)。体外溶出度测试表明,TEL的溶出度随孔径的增大而加快。
易损性斑块中巨噬细胞数量占绝大多数。对高危斑块进行成像评估,特别是大量巨噬细胞的斑块,巨噬细胞是理想的靶点之一。WU等合成了一种新型的负载IR820的磁性介孔二氧化硅纳米颗粒(PP1-IO@MS-IR820,PIMI)。将氧化铁作为T2和T2 MRI的磁芯制备介孔二氧化硅负载NIRF染料(IR820)进行光学成像;将两种成像元件叠加,最终实现双模成像效果。
◆需要解决的问题:(1)尽管这些研究证明了MSNs在动物模型上的有效性,但是实现临床最终飞跃的关键在于证明MSNs的长期安全性,测试不同的给药途径,能够扩大其生产规模,从而实现商业规模的合成。(2)MSNs由于其含有的二氧化硅具有高度稳定的化学结构而在体内的生物降解性差,未来需要对其化学结构修饰以改善生物降解性。(3)MSNs生产工艺复杂,也是阻碍其临床转化的原因之一。
3.5 基于DNA/RNA的纳米结构
◆ 设计思路:有研究报道了糖基纳米材料的应用,如基于透明质酸的纳米颗粒和糖基两亲性纳米颗粒用于靶向粥样斑块和抑制巨噬细胞的增殖。当然,以核酸为基础开发纳米粒子靶向斑块平台也是一个新的方向。ZHANG等开发的DNA包裹的超顺磁性氧化铁纳米颗粒(DNA-SPIONs)也能很好地靶向至斑块。设计者认为DNA寡核苷酸作为纳米颗粒的外壳使其表面带负电,从而促进巨噬细胞的摄取。活性氧(ROS)是细胞内的一类自由基,由OH-、H2O2、O2-等组成。动脉粥样硬化斑块中巨噬细胞的ROS水平高于正常细胞,这与动脉粥样硬化的发生、发展密切相关。基于这些前期研究结果,LI等使用基于氨基酸的纳米颗粒载体HB-OLD7将靶向NOX2的siRNA局部递送到动脉壁。检测动脉壁Cybb基因的表达降低了87%,新生动脉/中膜面积比减少83%,管腔/全动脉面积比增加89%。
基于DNA/RNA的纳米材料具有很好的选择靶向性,是一种安全、高效、特异性和非致病性基因治疗材料。基因治疗和纳米传递系统结合,拓宽了这些分子的治疗和生物医学应用。
◆ 需要解决的问题:(1)基因治疗和纳米传递系统结合,拓宽了这些分子的治疗和生物医学应用,递送系统对于核酸药物疗效具有关键作用,由于核酸是携带负电荷的生物大分子,很难通过细胞膜表面磷脂双分子层。(2)携带的DNA/RNA容易被机体所带的核酸酶酶解,这些均是阻碍其临床转化的技术门槛。
3.6 金属纳米粒子
◆ 设计思路:金属纳米粒子以其独特的优势,在动脉粥样硬化的诊断、治疗和预防中发挥着越来越重要的作用。动脉粥样硬化形成的易损性斑块突然破裂会引发心血管事件,而斑块的易损性与斑块的成分密切相关,巨噬细胞是易损斑块中含量最丰富的细胞成分,占易损斑块成分的80%以上。动脉粥样硬化的早期特征是A类清道夫受体(SR-A)在表面过表达而激活巨噬细胞吞噬氧化型低密度脂蛋白(OXLDL)形成泡沫细胞。
YE等成功制备了基于SR-A靶向巨噬细胞的金属纳米粒子Fe-PFH-聚乳酸-羟基乙酸共聚(PLGA)/壳聚糖(CS)-ds纳米粒子,并对纳米粒子的表征进行了测定。在随后的靶向性测试中Fe-PFH-PLGA/CS-ds纳米粒子可选择性地聚集在主动脉斑块激活的巨噬细胞内,经低强度聚焦超声辐照后可引起体外培养的大鼠主动脉斑块细胞凋亡。POON等报道了金属氧化物-肽两亲性杂化胶束(HMO-ms),其将无机、磁性氧化铁或锰氧化物内核与有机的、纤维蛋白靶向的PA结合,由CREKA序列组成,用于潜在的动脉粥样硬化斑块靶向治疗。
金属纳米粒子和普通敏感修饰材料相比,金属纳米粒子的尺寸很小(粒径为1~100 nm)。纳米材料的表面效应使金属纳米粒子修饰材料具有很大的比表面积,与反应物的有效接触面积也很大,这提升了药物在体内的运输效率。
◆需要解决的问题:(1)还需要加强对金属纳米粒子的毒理学评估。(2)目前金属纳米材料的开发大多在于动脉粥样硬化的靶向成像或治疗单一方面,未来开发出靶向给药和成像一体化平台将是热点方向。
4.外泌体靶向载药系统在动脉粥样硬化中的运用
◆ 结构特性:外泌体是直径30~200 nm的小型单膜分泌细胞器,具有与细胞相同的拓扑结构,富含选定的蛋白质、脂质、核酸和糖缀合物。作为一种细胞外囊泡,外泌体在细胞间信号传导和细胞间通讯、免疫应答、细胞稳态、自噬和传染病中发挥着重要作用。随着对细胞外囊泡和动脉粥样硬化研究的深入,外泌体已经作为一种靶向载药策略用于治疗动脉粥样硬化。
◆ 载药方式:外泌体负载药物的方式通常与所负载的药物种类有关。小分子通常被动孵育或主动加载方法负载,通过有目的地破坏外泌体膜的完整性,使得药物装载至外泌体中。此外,主动装载方式相比于被动装载更为高效,常作为首选方式,其包括电穿孔、超声处理、插入脂质体方式装载药物。
◆ 应用:一项体外研究证实了内皮来源的外泌体向分离自小鼠主动脉的原代内皮细胞运送siRNA的潜力,表明外泌体可能是一种天然的药物递送系统,可以将治疗性核酸运送到动脉粥样硬化的炎症内皮。在外泌体中发现miR-143/145这两种核酸可以防止平滑肌细胞去分化,将富含这两种miRNA的外泌体静脉注射至高脂饲料喂养的ApoE-/-小鼠,可将主动脉脂肪病变减少约1/2,并防止动脉粥样硬化病变。WU等通过电穿孔的方式将小分子治疗药物盐酸5-氨基乙酰丙酸己酯(HAL)装载至M2型巨噬细胞来源外泌体,并用载药后的外泌体处理巨噬细胞后,白介素(IL)-6和肿瘤坏死因子α(TNF-α)的表达显著降低。此外,注射载药外泌体后观察到ApoE-/-小鼠动脉粥样硬化载药外泌体中的定位比HAL更强,且载药外泌体显著减少了斑块面积。这些研究表明,通过基因途径将治疗性miRNAs富集到外泌体中,可以使外泌体有效地治疗动脉粥样硬化。
外泌体载药很可能成为下一代药物传递机制,其将纳米颗粒尺寸与非细胞毒性效应相结合,具有较高的载药能力和较低的免疫原性。
◆ 优势:(1)与人工合成的纳米技术药物传递系统相比,外泌体作为一种天然衍生药物传递载体表现出更好的生物分布、生物降解性、免疫相容性和低毒性。(2)外泌体在治疗分子的靶向递送方面具有优势,因为这些表面蛋白促进了外泌体和其目标细胞之间的有效互动。其是自发形成的囊泡,比合成的纳米颗粒危害小。(3)药物装载方式多样。可以通过物理/化学/生物方法选择性地装载所需的货物,以产生治疗效果。
◆ 不足:尽管在输送系统中使用外泌体有很多优势,但仍有4个主要问题有待解决:(1)外泌体的大规模生产;(2)外泌体的分离与纯化;(3)外泌体的装载效率;(4)外泌体的生物分布和吸收。
5.挑战
工业纳米药物近几年在心血管疾病靶向诊断治疗方面得到广泛关注的同时也暴露出一些问题。
◆在人体内,纳米药物通常被先天免疫系统认为是一种威胁,由于补体激活而导致不必要的清除。
◆当静脉注射纳米颗粒时,大量补体蛋白C3b结合到纳米颗粒表面,最终导致补体系统激活"失控"而危及生命。
◆在脂质体纳米制剂,Doxil、无机纳米颗粒如氧化铁和金属纳米颗粒研究中均报道了这种不良反应。
◆虽然多数纳米药物临床前研究是成功的,但批量生产运用还是一项挑战,仍需大量的临床试验去佐证其安全性。
◆不同于工业纳米靶向平台,外泌体载药靶向平台具有更好的生物相容性和低免疫原性。但是外泌体提取工序不够完善和可重复性是临床面对的主要挑战。
6.总结与展望
近年来,纳米给药平台在靶向成像和动脉粥样硬化治疗方面的研究和应用不断增多。这些靶向给药系统不同于传统的给药方式,具有显著的优势,能够将治疗药物靶向输送至病变的部位,一定程度上降低了药物的不良反应,这也是受控药物释放和改善药代动力学和药效学的结果。
纳米颗粒载药系统的有效性大多已在实验中得到证明,由于生物相容性、循环t1/2和药物在体内滞留量等方面存在问题,临床转化依然是一项重大挑战。未来的工作需致力于提高其靶向精准性和降低不良反应的研究。
- END -
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言