JMC:FGFR/HDAC双靶抑制剂的设计与合成,用于肿瘤治疗
2023-02-14 精准药物 精准药物 发表于上海
成纤维细胞生长因子(FGF)家族及其四个受体(FGFR1−4)在许多生理过程中发挥重要作用,包括胚胎发生、组织稳态、组织修复、伤口愈合和炎症。
成纤维细胞生长因子(FGF)家族及其四个受体(FGFR1−4)在许多生理过程中发挥重要作用,包括胚胎发生、组织稳态、组织修复、伤口愈合和炎症。细胞中FGFRs的激活突变或扩增可导致FGF-FGFR信号通路的过度激活,使细胞获得过度增殖,避免凋亡、易迁移等致癌特征。当配体与受体特异性结合时,它诱导FGFR自磷酸化,然后二聚,导致其结构域从非活性状态过渡到活性状态。激活的FGFR和细胞内激酶相互接近并相互磷酸化,从而激活一系列下游信号通路,如PI3K/AKT, PLCγ, MAPK/ERK和STAT,最终刺激细胞增殖、分化,抑制细胞凋亡。
组蛋白乙酰化和去乙酰化是重要的表观遗传修饰,这可逆的动态修改是由组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)。在正常生理条件下,组蛋白乙酰转移酶和组蛋白去乙酰化酶处于平衡状态,但当细胞进行转换,HDACs的活动显著增强,导致基因表达的平衡中断,导致对细胞增殖的影响。调节细胞周期的分子表达不平衡,这反过来导致细胞噁性转化。
HDAC抑制剂可以在实体肿瘤细胞系中通过逆转录激活JAK-STAT信号通路,从而导致对HDAC抑制剂的耐药性。虽然STAT是FGFR的下游信号,但激活的FGFR可以调控STAT通路靶基因的表达。因此,HDAC与FGFR联合抑制可以恢复HDAC抑制剂的敏感性,并产生协同抗肿瘤作用。基于这些信息,FGFR和HDAC抑制剂的合理联合使用是一种潜在的癌症治疗策略。
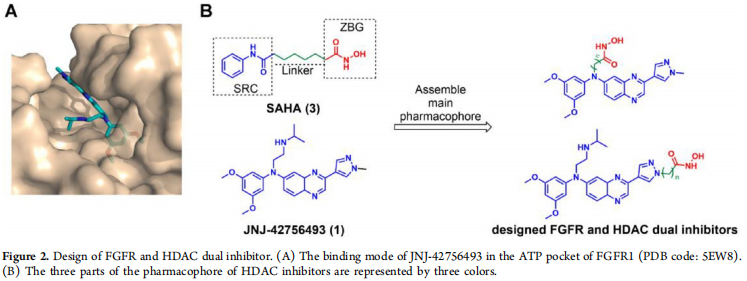
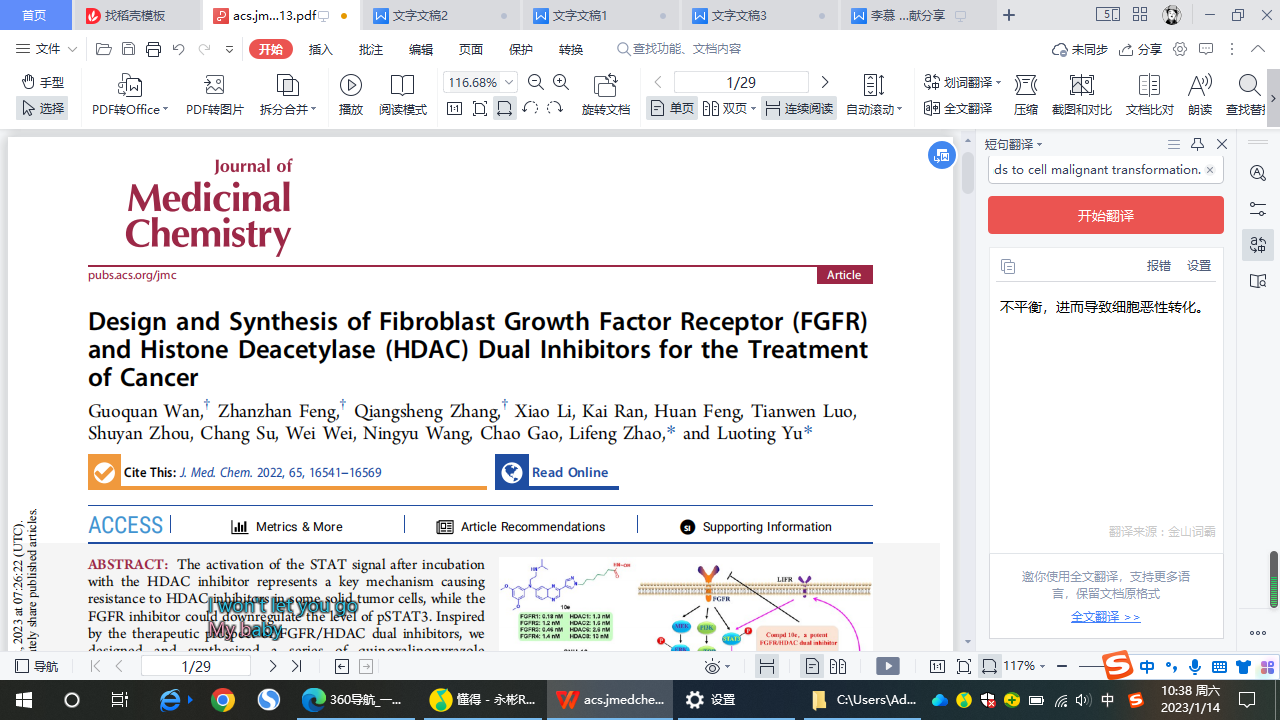
在此,作者开发了一系列喹噁啉吡唑羟肟酸衍生物作为有效的FGFR/HDAC抑制剂,并对其进行了综合评价。底物竞争HDAC抑制剂大多有相同的药效团,主要是由锌结合组(ZBG),最有效的配体是羟肟酸,表面识别帽(SRC)与周围的氨基酸残基入口活性网站,和连接ZBG和SRC(Figure 2)。连接剂可以是烷基、烯基或芳基,其中5到7个碳可以实现最有效的HDAC抑制,如SAHA(3)结构所示。FGFR/HDAC双抑制剂的设计是基于JNJ-42756493。结果表明,甲基吡唑暴露于溶剂中,异丙胺侧链占据深磷酸区。依此,作者设计合成了化合物8a−8c、9a−9e、10a−10g和11a−11j。
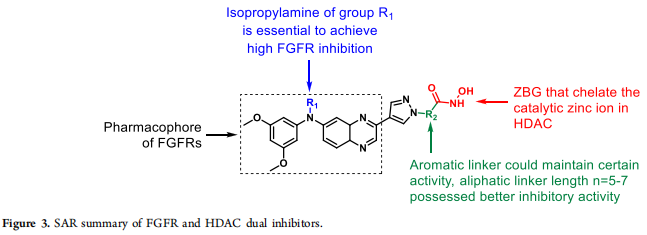
在完成对所有化合物的FGFR1和HDAC1酶活性的评价后,作者建立了结构−活性关系(SARs),并总结在Figure 3中。(1)目标化合物的羟肟酸酯可以螯合HDAC中的催化锌离子,获得较强的HDAC抑制活性;(2)目标化合物的异丙胺侧链对实现高FGFR抑制;(3)适当的脂肪族连接体对提高HDAC1的抑制活性非常重要,连接子长度为5~7个亚甲基的目标化合物对HDAC1的抑制作用最强,但对FGFR1的抑制活性无明显影响;(4)芳香连接子放置于适当位置时,也能对FGFR1和HDAC1具有较高的抑制活性。

接下来作者测试了双抑制剂对FGFR和HDAC亚型的选择性。如Table 4所示,值得注意的是,10e对所有四种HDAC亚型都显示出最有效的活性。10e是一种泛FGFR/HDAC双抑制剂,对FGFRs和HDACs具有强而平衡的抑制活性。
通过对其体内外抗肿瘤活性进行了评价。化合物10e对双靶点具有较强且平衡的抑制活性(FGFR1半抑制浓度值:0.18 nM,HDAC1半抑制浓度值:1.3 nM)。抗增殖试验表明,10e对各种实体肿瘤细胞系的增殖具有良好的抑制活性。在HCT116和SNU-16细胞系中,10e都可以同时调控FGFR和HDAC的主要下游信号通路。10e可诱导SNU-16细胞系G0/ G1期阻滞和凋亡。药代动力学分析显示,10e口服给药后的生物利用度为24.83%。此外,10e对HCT116和SNU具有显著的抗肿瘤活性16个异种移植模型,优于阳性化合物1和3。需要注意的是,在一些实体肿瘤细胞系中,对HDAC抑制剂的耐药性是由与HDAC抑制剂SAHA孵育后的STAT信号的激活引起的,然而FGFR抑制剂可下调pSTAT3的水平。实验表明,10e以浓度依赖性的方式抑制了pSTAT3的表达,这表明10e可能能够克服对HDAC抑制剂的耐药性,这些结果支持了10e可能成为恶性肿瘤的新候选药物。
DOI::10.1021/acs.jmedchem.2c01413
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







