Cell:上海药物所徐华强/庄友文等团队合作阐述阿片受体家族与内啡肽系统的分子作用机制
2023-01-14 iNature iNature 发表于上海
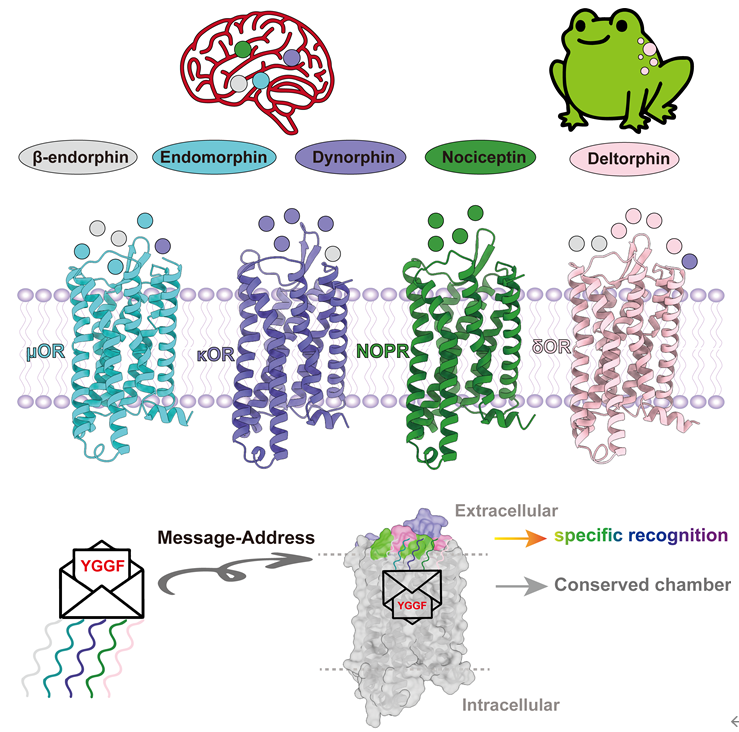
本研究解析的痛敏肽结合NOPR的结构也是首个激活形式的结构,通过结构比对分析,不出意外地发现它遵循阿片受体通用的激活机制。
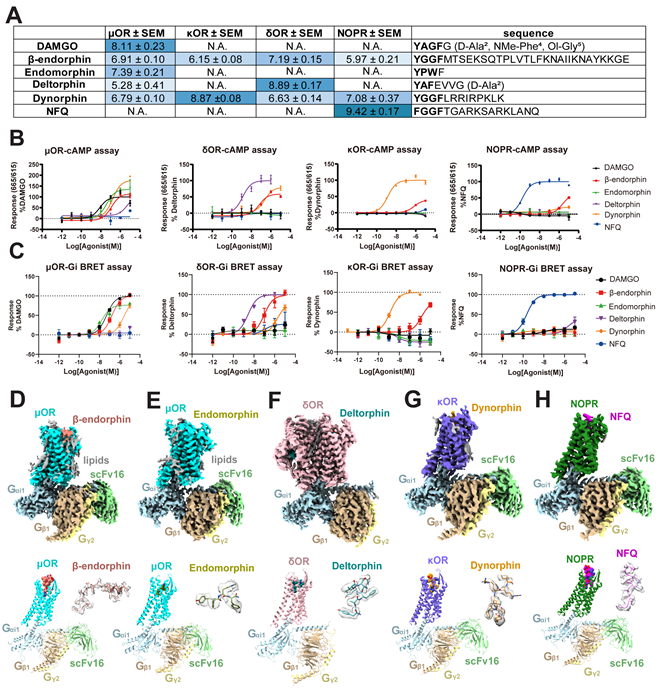
2023年1月12日,中国科学院上海药物研究所徐华强/庄友文团队联合美国北卡罗莱纳大学教堂山分校Bryan L. Roth团队合作在国际顶级期刊Cell 上以长文形式在线发表了题为“Structures of the entire human opioid receptor family”的研究论文,该项研究系统地解析了阿片受体家族四个亚型μOR、δOR、κOR、NOPR和各自的选择性多肽包括内啡肽、内吗啡肽、强啡肽、皮啡肽和痛敏肽的冷冻电镜复合物结构,结合大量细胞水平的功能实验,揭示了多肽类配体和阿片受体的结合模式,阐述了它们的选择性和保守性机制,为“信使-信箱-效能”模式提供了结构和功能支持。


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









