Science Advances: 新型简便的病原体核酸POC检测技术
2023-10-03 小桔灯网 小桔灯网 发表于陕西省
作者开发了一种简化的one-pot核酸等温扩增方法,可以通过电阻抗的变化来检测,而不需要微珠作为外部成核剂。
快速准确地检测遗传物质是诊断的基石,包括传染病和生物标志物的鉴定。基于蛋白质的诊断方法(如快速抗原检测结合侧流)已被广泛应用,但由于需要开发高质量的抗体,基于核酸的方法通常更容易开发,具有更高的灵敏度和内在的灵活性。逆转录定量聚合酶链反应(RT-qPCR)是核酸检测的金标准,其他几种基于核酸的方法,比如等温扩增,特别是环介导等温扩增(LAMP),已经被开发出来。LAMP后的DNA检测可以通过多种策略实现,包括凝胶电泳、荧光和比色法。荧光方法成本高,需要复杂的读出系统或集成专用平台。比色法简单但容易产生误报。因此,开发细胞核酸扩增检测的简化方法是必要的。
通过测量阻抗变化进行电化学检测DNA扩增是一个无标记替代荧光和比色技术。基于阻抗的生物传感器已广泛用于各种分析物,包括具有高灵敏度的蛋白质、核酸和癌细胞。此外,由于近几十年来的技术进步,电子元件经历了快速的小型化,大量减少的体积输入要求进一步提高了即时检测(POC)的可能性。
近日,一组由美国、中国、瑞典等多所顶尖大学研究团队在Science Advances杂志上发表了一篇题为“Digital assay for rapid electronic quantification of clinical pathogens using DNA nanoballs”的文章。在文章中,作者开发了一种简化的one-pot核酸等温扩增方法,可以通过电阻抗的变化来检测,而不需要微珠作为外部成核剂。作者改进了RT-LAMP反应,使扩增的DNA自核成纳米球,在微流体通道中,被动流动通过两个检测电极,在阻抗信号中产生量化尖峰。作者将其应用于SARS-CoV-2的检测,检测到的尖峰的数量与扩增DNA的数量相对应,因此病毒浓度更高。还展示了多种DNA和RNA致病序列的检测,包括来自各种病毒和细菌病原体序列,包括HIV、流感、结核分枝杆菌和β-内酰胺酶。这种技术为一种新的、简单的基于阻抗的多病原体POC核酸检测系统铺平了道路。

图片来源:Science Advances
自组装DNA纳米球
为了简化基于阻抗的DNA检测,作者开发了一种能够在一锅反应中生成DNA纳米球的分子方法,并且不需要外部成核剂。受先前滚动圈扩增(RCA)工作的启发,作者改进了LAMP反应,设计标准的六个目标特异性LAMP引物和两个额外的compaction引物,使扩增的DNA自核成纳米球,且纳米球的产生与等温DNA扩增平行(下图A)。当使用SARS-CoV-2 RNA测试此RT-LAMP反应时,可以在荧光显微镜下观察到自组装紧凑的DNA纳米球,直径从1到2 μm(下图B和C)。
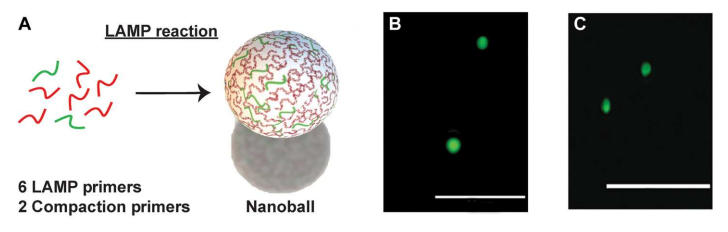
DNA纳米球的自组装。图片来源:Science Advances
微流控装置中的阻抗检测
作者将简单的微流控芯片放在带有金电极的玻璃基板上(下图A和B)。微流控芯片采用毛细管作用驱动的被动流动,从而消除了复杂的微流控管和泵的需要。这种简单的被动流动使DNA纳米球通过的金电极上方的通道(下图D)并连接到电子读出系统。当纳米球通过金电极时,它会阻塞两个电极之间的电流路径和电场。这会产生阻抗的变化,从而在读出系统的输出处产生类似于图C至E所示的峰值特征。接下来,作者尝试改变compaction引物相对于LF和LB引物的浓度。结果显示使用更高比例的compaction引物 (9:1)产生更高的DNA纳米球数量(平均10分钟>100个),因此在接下来的实验中都使用了这个比例。
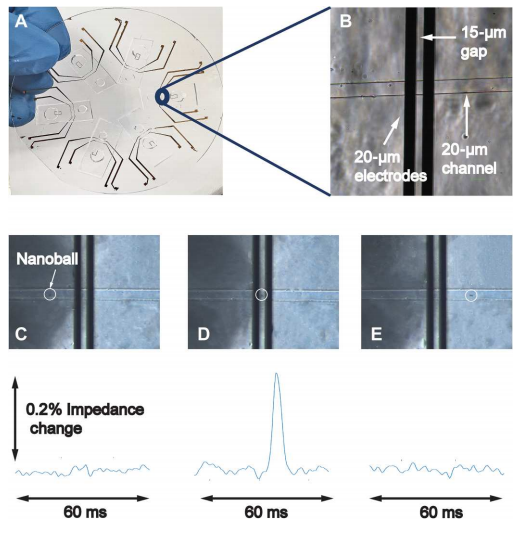
基于阻抗检测DNA纳米球的微流控芯片。
图片来源:Science Advances
检测限
研究团队以合成RNA为模板进行了梯度稀释实验,探索了该方法的检出限(LOD)。结果显示,即使是最低浓度的合成RNA测试(10拷贝RNA)也很容易与阴性对照区分开(下图A)。作者还在不同的时间间隔(5分钟、3分钟、60秒和30秒),测试了缩短电检测时间对LOD的影响。结果显示,即使在30秒,检测到的纳米球数量分布与初始合成RNA的浓度密切相关,并且在阴性对照组之间表现出统计学上的显著差异(下图B)。
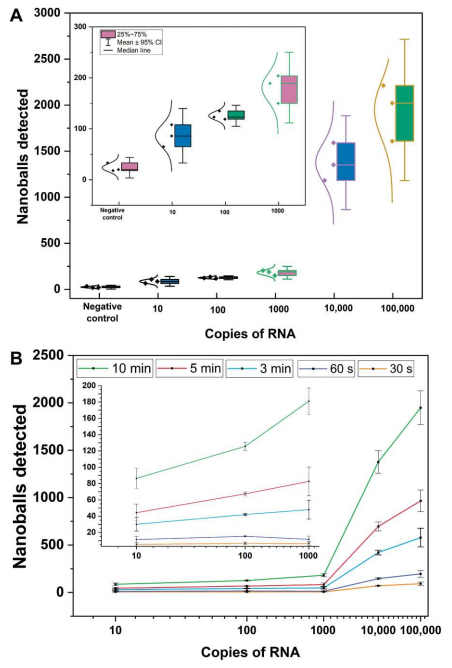
检测限的分析。图片来源:Science Advances
三重复compaction引物设计导致信号增强
为了进一步提高系统的DNA检测能力,作者采用了几种策略。首先尝试增加DNA纳米球的大小或改变其电性能可能会增加信噪比,从而提高可探测性。为了增加DNA纳米球的大小,作者在compaction引物中添加一个额外的共同序列拷贝可能会增强LAMP扩增子压缩和形成纳米球的能力。结果证实了作者的推断,三重复compaction引物设计大大增加了检测到的平均DNA纳米球数量,从使用两重复compaction引物时的大约2000个增加到接近3000个(下图B)。

DNA纳米球检测实验方案的优化。
图片来源:Science Advances
临床样本中SARS-CoV-2的阻抗检测
为了测试此方法的适用性,接下来将其应用于检测来自临床诊断测试的上呼吸道拭子样本中的SARS-COV-2。随机选择了5个不同病毒载量的样本,通过RT-qPCR测量:低病毒载量(Ct 26-27),中病毒载量(Ct 22-24)和高病毒载量(Ct 17-20),并使用此纳米球方法进行检测。结果(下图A)证明了基于阻抗的检测在非提取的热灭活样品中检测临床相关病毒水平的能力,且病毒载量与检测到的DNA纳米球数量之间存在很强的关系。在Ct值(27到17)范围内检测到1000到2000个DNA纳米球。更重要的是,从SARS-COV-2阴性患者中检测到的阻抗峰值水平较低,尽管这些样本中的材料(咽拭子、鼻拭子和唾液)基质很复杂。
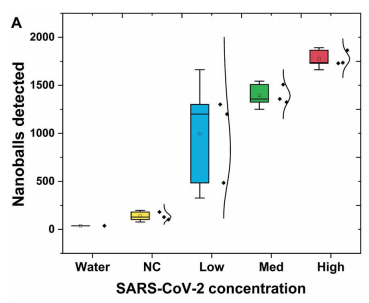
对COVID-19患者进行临床样本检测。
图片来源:Science Advances
利用DNA纳米球灵活检测病原体
为了证明此检测的灵活性和易用性,作者设计了针对多种病原体的LAMP三重复compaction引物,其中包括抗结核分枝杆菌、艾滋病毒、流感A/H1N1,以及一种常见的产生抗微生物药物耐药性的β-内酰胺酶基因。如下图B所示,使用所选病原体的合成遗传物质进行RT-LAMP(或LAMP)反应时成功检测到DNA纳米球。所有目标检测到的峰值均接近1000个,与阴性对照显著不同。这证明了将任何LAMP反应与基于阻抗的检测相结合的策略相适应的便利性。
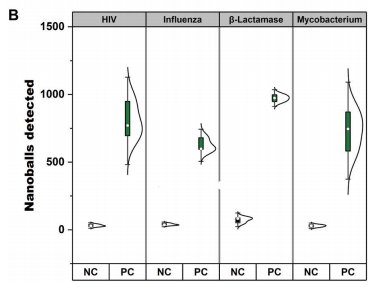
对多种病原体序列进行临床样本检测。
图片来源:Science Advances
总结与讨论
研究团队提出了一种结合一锅等温生成DNA纳米球和电阻抗检测的新方法。通过使用compaction引物来改进环介导的等温扩增,扩增的靶标可以自组装成纳米球。接下来使用毛细管驱动的流动被动地让这些纳米球通过两个检测电极,在阻抗信号中产生量化尖峰。这种方法可灵活的检测多种靶标DNA/RNA,预计将其集成到一个独立的设备中将提供廉价(< 5美元),敏感(10个靶标拷贝)和快速测试(<1小时),推测可以帮助解决未来几十年日益增长的病原体检测挑战。
目前实施的一个限制是需要一个台式阻抗测量光谱仪,可以使用单一电压,频率和放大器设置进行。另一个优点是,此无标记方法原则上适用于试剂冻干。此外可以提供量化的读数,并且不容易因原始样品(例如唾液)的pH值而产生假阳性。通过将可负担得起的批量生产的电子产品与冻干试剂相结合,此技术有可能成为开发低成本(< 5美元)、广泛部署和可扩展的POC设备的基础。作者设想未来的设备由两个模块组成:一个提供65°C等温温度的反应室和一个由毛细管流动操作的经济实惠的阻抗检测器,两个模块结合在一个独立设备中也是可行的。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







