靶向CD30的CAR-T细胞慢病毒转导条件优化研究
2023-08-26 中国癌症杂志 中国癌症杂志 发表于上海
本实验旨在优化抗CD30 CAR-T细胞的慢病毒转导参数,以制备出高质量的抗CD30 CAR-T细胞,以期为临床试验所需的大量细胞的制备提供依据,同时也为其他靶点CAR-T细胞的转导优化提供参考。
[摘要] 背景与目的:嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞技术在血液肿瘤治疗领域已被广泛应用,慢病毒转导是CAR-T细胞制备的关键环节,与CAR-T细胞的质量密切相关,因此慢病毒转导过程涉及的各项参数仍需进一步优化。本研究旨在探讨携带CD30抗体序列的慢病毒转导T细胞的感染复数(multiplicity of infection,MOI)、温育密度、转导前活化时间和转导体系高度对抗CD30 CAR-T细胞的影响,优化CAR-T细胞的转导条件,提高转导效率和CAR-T细胞功能。方法:采用不同的MOI、温育密度、转导前活化时间和转导体系高度等对人外周血来源的T细胞进行转导优化,转导后分别检测抗CD30 CAR-T细胞的增殖能力、转导效率、细胞存活率和体外杀伤效率等,以确定最优的T细胞转导条件。结果:MOI为1.00、1.50和3.00时转导效率和有效细胞数显著高于0.00、0.25和0.50组。在温育密度大于1.0×107个/mL 时,温育密度对T细胞转导效率无影响。活化时间为72 h组细胞存活率低于80%,显著低于其他组;24、48 h的转导效率显著高于0、8、16 h组;48 h组CAR-T细胞的增殖速率显著高于24 h组。转导体系高度为0.16 mm时转导效率和增殖倍数都显著高于0.53 mm组,但对CAR-T细胞的体外杀伤效率无影响。结论:通过对CAR-T细胞功能的综合评估,确定慢病毒的最佳转导条件为MOI=1、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm。
[关键词] 慢病毒载体;抗CD30嵌合抗原受体T细胞;转导条件
[Abstract] Background and purpose: Chimeric antigen receptor T (CAR-T) cell technology has been widely used in the field of blood tumor treatment. Lentivirus transduction is a key link in the preparation of CAR-T cells, which is closely related to the quality of CAR-T cells. Therefore, the parameters involved in the lentivirus transduction process still need to be further optimized. This study aimed to investigate the effects of multiplicity of infection (MOI), incubation density, activation time before transduction and transduction system height on anti-CD30 CAR-T cells in lentiviral transduction T cells carrying CD30 antibody sequences, optimize the transduction conditions of CAR-T cells, and improve transduction efficiency and CAR-T cells function. Methods: Different MOI, incubation density, activation time before transduction and transduction system height were used to optimize the transduction of human peripheral blood-derived T cells, then proliferation capacity, transduction efficiency, cell viability and killing efficiency in vitro of anti-CD30 CAR-T cells were detected. Results: When the MOI was 1.00, 1.50 and 3.00, the transduction efficiency and effective cell number were significantly higher than those in the 0.00, 0.25 and 0.50 groups. When the incubation density was greate than 0.5×107 cells/mL, the incubation density had no significant effect on the transduction efficiency of T cells. The cell viability rate of the 72 h group was lower than 80%, which was lower compared with other groups significantly, the transduction efficiency of 24 and 48 h was significantly higher compared with the 0 h, 8 h and 16 h groups, and the expansion rate of CAR-T cells in the 48 h group was significantly higher compared with the 24 h group. The transduction efficiency and proliferation capacity of 0.16 mm in height of transduction system were significantly higher compared with the 0.53 mm group, however, had no significant effect on killing efficiency of CAR-T cells in vitro. Conclusion: Through the comprehensive evaluation of CAR-T cells function, the optimal transduction conditions for lentivirus include MOI of 1.00, incubation density of 1.0×107 cells/mL, activation before transduction for 48 h and transduction system height of 0.16 mm.
[Key words] Lentiviral vectors; Anti-CD30 chimeric antigen receptor T cell; Transduction conditions
随着分子生物学的发展,各种可以人为操纵DNA和RNA的工具也得到了长足发展,并改变了现代医学的发展进程[1]。基因疗法能够赋予细胞或有机体在自然状态下不存在的能力[2]。在基因改造方面,慢病毒是最典型的代表,因为其具有进入细胞并将遗传物质运送到细胞的天然能力[3]。慢病毒载体经过几十年的发展,目前已经进入了第三代慢病毒载体阶段。第一代慢病毒载体包含人类免疫缺陷病毒(human immunodeficiency virus,HIV)基因组的大部分,以及一种病毒的包膜蛋白,最常见的是水泡性口炎病毒糖蛋白(vesicular stomatitis virus glycoprotein,VSV-G)[4],VSV-G可以识别在细胞上广谱表达的低密度脂蛋白受体[5-6],因此使得该慢病毒载体可转导广泛的细胞;第二代慢病毒载体去除了辅助毒性因子VIF、VPR、VPU和NEF[4],提高了其安全性且不影响慢病毒转运遗传物质的能力;第三代慢病毒载体将病毒基因组gag和pol分裂成单独的质粒[7],进一步降低了由基因重组导致的的复制型慢病毒产生的概率。
嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞技术是通过分子生物学和基因工程改造技术,将靶向特异性抗原的单链抗体的轻重链可变区序列在患者的T细胞膜上表达,进而特异性地杀死肿瘤细胞,达到治疗癌症的目的[8-9]。慢病毒载体的出现极大地推动了CAR-T细胞治疗的发展。目前,已有多种CAR-T细胞治疗进入临床应用阶段[10]。研究[11-13]表明,CAR-T细胞在治疗B细胞恶性肿瘤方面取得了前所未有的疗效,最显著的是应用抗CD19 CAR-T细胞治疗B细胞急性淋巴细胞白血病的完全缓解率高达90%。
对于霍奇金淋巴瘤,CD30是一个理想的候选靶点,因为其在霍奇金淋巴瘤肿瘤细胞中表达丰富且具有特异性,在正常组织中表达有限[14]。抗CD30 CAR-T细胞是最近新兴的靶向CD30分子的CAR-T细胞,对霍奇金淋巴瘤有很好的治疗作用[15]。有临床研究[16-17]表明,抗CD30 CAR-T用于治疗复发或难治性霍奇金淋巴瘤,淋巴清除后产生高应答率并持续一般时间,具有极好的安全性和极小的毒性。随着抗CD30 CAR-T细胞研究的进行,利用慢病毒载体制备CAR-T细胞的技术研究取得了很大进展,然而原代T细胞抗CD30 CAR慢病毒转导条件还没有进行全面细致的研究。
影响慢病毒静止转导的因素通常有感染复数(multiplicity of infection,MOI)、温育密度、转导前活化时间和转导体系高度等[18-20]。本实验旨在优化抗CD30 CAR-T细胞的慢病毒转导参数,以制备出高质量的抗CD30 CAR-T细胞,以期为临床试验所需的大量细胞的制备提供依据,同时也为其他靶点CAR-T细胞的转导优化提供参考。
1 材料和方法
1.1 试剂
抗CD30 CAR慢病毒和CD30检测蛋白为武汉波睿达生物科技有限公司赠予,人原代T细胞从人外周血中提取,人CD3磁珠和人T cell TransAct购自德国Miltenyi公司,T25和T75细胞培养瓶购自美国Corning公司,转导试剂聚凝胺(Polybrene)购自翌圣生物科技(上海)股份有限公司,胎牛血清购自上海吉泰依科赛生物科技有限公司,DMEM-Basic、RPMI-1640及TexMACSTM GMP培养基均购自美国Gibco公司。
流式抗体:7-AAD、PE抗人CD25抗体和Alexa Fluor 488 Donkey抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体购自美国Biolegend公司,BV421抗人CD69抗体购自深圳市达科为生物技术股份有限公司。
1.2 方法
1.2.1 人原代T细胞的分离
采集健康人群外周血,经等体积的生理盐水稀释后,缓慢加到已预先加入20 mL淋巴细胞分离液的50 mL离心管中,700×g离心20 min,离心时调节离心机升降参数至最低,离心后将环状乳白色淋巴细胞层用移液器吸出,得到单个核细胞。以10 μL/2×107个细胞的比例加入人CD3磁珠,加入4倍体积的分选缓冲液后4 ℃温育15 min,用5 mL分选缓冲液重悬,将悬液通过磁力柱,T细胞会通过磁珠被吸附到柱子上,用2 mL分选缓冲液洗两遍柱子后,在柱子中加入5 mL分选缓冲液,用力快速推动柱子上的活塞将T细胞冲洗下来,收集冲洗下来的细胞。
1.2.2 慢病毒转导T细胞
1.2.2.1 不同MOI对T细胞转导的影响
取需要数目的生长状况良好的原代T细胞于6孔板中,采用MOI为0.00、0.25、0.50、1.00、1.50、3.00的梯度对T细胞进行转导,转导时补加Polybrene使其终浓度为5 µg/mL。转导后持续监测CAR-T细胞的增殖情况,通过流式细胞术检测转导效率和细胞存活率。
1.2.2.2 转导时T细胞温育密度对T细胞转导的影响
确定最优的MOI后,采用0.2×107、0.5×107、1.0×107、2.0×107个/mL的温育密度转导T细胞,转导后监测CAR-T细胞的增殖情况,通过流式细胞术检测转导效率和细胞存活率。
1.2.2.3 转导前T细胞活化时间对T细胞转导的影响
确定最优的MOI和温育密度后,选用人T cell TransAct刺激T细胞0、8、16、24、48及72 h后,转导T细胞,转导后监测CAR-T细胞的增殖情况,通过流式细胞术检测T细胞激活情况、转导效率和细胞存活率。
1.2.2.4 转导体系高度对T细胞转导的影响
转导相同数量的T细胞,分别用T25和T75培养瓶作为容器,使转导体系高度分别为0.16和0.53 mm,转导后监测CAR-T细胞的增殖情况,通过流式细胞术检测转导效率,采用钙黄绿素释放法检测抗CD30 CAR-T细胞的体外杀伤效率。
1.2.3 流式细胞术检测
收集大于5×105个CAR-T细胞于流式管中,向每管中加入1~2 mL流式缓冲液,500×g离心5 min,去掉上清液,重复洗2遍,用流式缓冲液配制好工作浓度的染色抗体重悬细胞,4 ℃避光染色30 min后,加入1 mL流式缓冲液终止染色,500×g离心5 min,弃去上清液,重复洗2遍,加2 µL 7-AAD抗体于100 µL流式缓冲液中重悬细胞,2~3 h内通过流式细胞术分析检测。
1.2.4 钙黄绿素释放法检测抗CD30 CAR-T细胞的细胞毒性
选取L428细胞系作为阳性靶细胞,人骨髓瘤细胞系K562作为阴性靶细胞,效应细胞为抗CD30 CAR-T细胞。将经钙黄绿素标记、浓度为5×104个/mL的靶细胞接种于U底96孔培养板中,100 µL/孔。按不同效靶比(25︰1、5︰1、1︰1)加入各组效应细胞,体积为100 µL/孔。设置阳性对照组(加入裂解液)和阴性对照组(加入磷酸缓冲盐溶液)。各组均设3个复孔,在37℃生化培养箱中温育2.5~3.0 h。后将96孔板以700×g离心10 min,从各孔吸取150 µL上清液对应转移到预先标记好的新的平底96孔板中,置于酶标仪(参数设置:激发光波长为485/20,发射光波长为530/25)扫描读取荧光值。根据以下公式计算各组效应细胞的细胞毒性:特异性裂解百分比(%)=(实验组荧光值-阴性对照组荧光值)/(阳性对照组荧光值-阴性对照组荧光值)×100%。实验重复3次。
1.3 统计学处理
本研究采用GraphPad Prism 8软件进行数据分析,实验数据以x±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同MOI对于抗CD30 CAR-T细胞转导的影响
MOI对于T细胞转导效率具有决定性的影响,因此我们首先从该条件开始进行转导条件的优化。根据本课题组以往研究[17],分别采用MOI为0.00、0.25、0.50、1.00、1.50、3.00的梯度对健康人群外周血来源的新鲜T细胞进行转导。通过流式细胞术检测不同MOI对于抗CD30 CAR-T细胞转导效率的影响,结果显示,MOI为1.00、1.50和3.00组在第8天的转导效率显著高于0.00、0.25和0.50组[(25.60±3.51)%、(26.33±5.32)%和(32.67±6.47)% vs ( 1.00±0.00)%、(9.17±2.23)% 和(14.50±4.81)%,P<0.01],1.00、1.50和3.00组间差异无统计学意义(P均>0.05,图1A),各组CAR-T细胞在转导第8天的细胞存活率均为80%左右,组间差异无统计学意义[(84.67±5.20)%、(81.17±2.79)%、( 79.50 ±2.74)%、(79.67 ±1.63)%、( 79.00 ±1.55)%和(77.83 ±1.72)%, P >0.05,图1B]。
本实验还研究了不同MOI对抗CD30 CAR-T细胞增殖能力的影响,结果显示,不同MOI对于抗CD30 CAR-T细胞的增殖能力的影响差异无统计学意义(P>0.05,图1C),但1.00、1.50和3.00组在第16天的抗CD30 CAR-T有效细胞数(T细胞数×转导效率)显著高于0.00、0.25和0.50组(P 均<0.01);1.00、1.50、3.00组间差异无统计学意义(图1D)。根据不同MOI的转导条件下,转导效率、抗CD30 CAR-T细胞总数和有效细胞数等3个方面的情况,综合慢病毒成本,最终选择MOI=1.00作为慢病毒转导T细胞的关键参数。
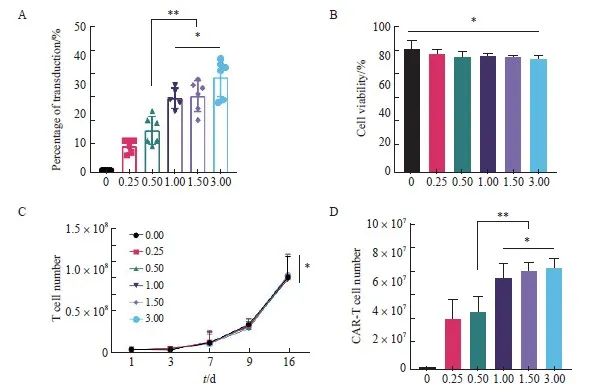
图1 不同MOI对于抗CD30 CAR-T细胞转导的影响
Fig. 1 Effects of different MOI on transduction of anti-CD30 CAR-T cell
A: Transduction efficiency of anti-CD30 CAR-T cells in each MOI on day 8; B: Cell viability of anti-CD30 CAR-T cells obtained from different MOI; C: Proliferation activity of T cell; D: Number of anti-CD30 CAR-T cells on day 16. *: P>0.05, compared with each other; **: P<0.01, compared with each other.
2.2 不同温育密度对于抗CD30 CAR-T细胞转导的影响
温育密度会影响细胞与慢病毒之间的接触[19],可能会进一步影响转导效率,因此本研究选取不同的温育密度对转导条件进行优化。通过流式细胞术检测不同温育密度对抗CD30 CAR-T细胞转导效率和细胞存活率的影响,结果显示,各组抗CD30 CAR-T细胞在转导第8天的转导效率和细胞存活率差异均无统计学意义[转导效率:(24.00±8.51)%、(25.50±7.87)%、(25.33±8.09)%和(24.50 ±7.58)%,P>0.05;细胞存活率:(81.17±1.94)%、(83.50±2.07)%、(83.67 ±2.66)%和(80.83±3.49)%,P>0.05,图2A、2B]。细胞增殖实验显示,不同温育密度得到的抗CD30 CAR-T细胞之间的增殖情况差异无统计学意义(P >0.05,图2C);0.2×107组在第16天的抗CD30 CAR-T有效细胞数显著低于0.5×107、1.0×107和2.0×107组(P<0.05),但0.5×107、1.0×107、2.0×107组之间差异无统计学意义(图2D)。
本实验还研究了不同温育密度对于抗CD30 CAR-T细胞毒性作用的影响,结果显示,0.5×107、1.0×107组抗CD30 CAR-T细胞的细胞毒性显著高于2.0×107组[(46.00±1.41)% vs (45.00±1.41)% vs(35.50±2.12)%,P <0.05,图2E]。综上所述,根据转导效率、细胞存活率、抗CD30 CAR-T有效细胞数及体外杀伤效率等情况得出最佳温育密度为0.5×107和1.0×107个/mL,从生产成本方面考虑,最终选择MOI=1.0、温育密度为1.0×107个/mL作为慢病毒转导T细胞的关键参数。
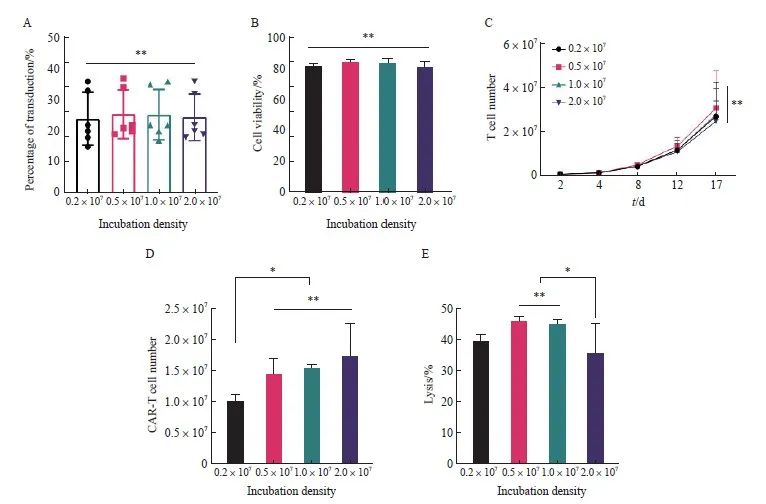
图2 不同温育密度对于抗CD30 CAR-T细胞转导的影响
Fig. 2 Effects of different incubation densities on transduction of anti-CD30 CAR-T
A: Transduction efficiency of anti-CD30 CAR-T cells obtained at different incubation densities; B: Cell viability of anti-CD30 CAR-T cells obtained from different incubation densities; C: Proliferation activity of T cell; D: Number of anti-CD30 CAR-T cells on day 16; E: Lysis efficiency of different anti-CD30 CAR-T. *: P<0.05, compared with each other; **: P>0.05, compared with each other.
2.3 不同活化时间对于抗CD30 CAR-T细胞转导的影响
T细胞的激活水平与慢病毒转导效率密切相关[21]。T细胞的激活状态可以根据CD25和CD69的表达水平来衡量[22],通过流式细胞术检测不同转导前活化时间对CD25和CD69的表达情况,结果显示,在加入人T cell TransAct刺激后,T细胞被激活(图3A)。T细胞的持续激活会影响其存活率,结果显示,持续刺激72 h后T细胞的活率低于80%,显著低于其他组[(97.00±0.00)%、(95.67 ±1.53)%、(93.00 ±3.46)%、(90.33 ±3.06)%、(85.67 ±5.51)%和(77.00±5.57)%,P<0.01,图3B]。转导后通过流式细胞术检测不同活化时间对抗CD30 CAR-T细胞转导效率的影响,结果显示,24、48和72 h组抗CD30 CAR-T细胞的转导效率显著高于0、8和16 h组[(35.00±5.15)%、(42.60±9.45)%、(41.20 ±8.64)%、(51.83 ±9.20)%、(56.50 ±7.87)%和(55.75 ±2.22)%,P<0.05],但24、48和72 h组间的转导效率差异无统计学意义[(51.83±9.20)%、(56.50±7.87)%和(55.75±2.22)%,P >0.05,图3C]。
本实验进一步研究了不同活化时间对抗CD30 CAR-T细胞增殖情况的影响,结果显示,在第11天时,48 h组的有效细胞数显著高于其他组(P<0.05);但在第15天时差异无统计学意义(P >0.05,图3D)。因此,为了更加准确地验证活化时间对CAR-T细胞的影响,本研究分别选用活化时间为24和48 h进行放大研究。

图3 不同活化时间对抗CD30 CAR-T细胞转导的影响
Fig. 3 Effects of different activation times on transduction of anti-CD30 CAR-T
A: Expression of CD25 and CD69 along the time in activation; B: Cell viability of anti-CD30 CAR-T at different activation times; C: Transduction efficiency of anti-CD30 CAR-T obtained at activation times; D: Proliferation activity of CAR-T with different activation times. *: P<0.05, compared with each other; **: P<0.01, compared with each other; ***: P>0.05, compared with each other.
2.4 24和48 h活化时间对于抗CD30 CAR-T细胞转导影响的放大研究
为进一步验证上述研究结果,我们将转导的T细胞起始量由0.5×107个提高到2.0×107个,培养容器从6孔板改为培养瓶,其他条件与上述一致。通过流式细胞术检测24和48 h活化后CD25和CD69的表达情况,结果显示,48 h组CD69阳性细胞比例及其平均荧光强度(mean fluorescence intensity,MFI)均低于24 h组,48 h组CD25阳性细胞比例略高于24 h,但CD25的MFI明显升高,T细胞被激活(图4A),此结果与2.3结果保持一致。有研究[23]显示,T细胞大小也与其激活有关,因此本研究检测了不同活化时间细胞大小的变化,结果显示,随着刺激时间的延长,T细胞逐渐变大,进一步说明T细胞被激活(图4B)。转导前细胞存活率检测结果显示,24和48 h组间的细胞存活率差异无统计学意义[(81.33±1.15)% vs(82.67±3.51)%,P>0.05,图4C]。转导后通过流式细胞术检测两组转导效率,结果显示,24和48 h组间转导效率差异无统计学意义(P>0.05,图4D)。细胞增殖实验结果显示,48 h组的增殖速率显著高于24 h组(P<0.01,图4E)。综上所述,根据转导效率、细胞存活率及细胞增殖速率等情况,最终选择MOI=1.0、温育密度为1.0×107个/mL、转导前活化48 h作为慢病毒转导工艺的最佳条件。
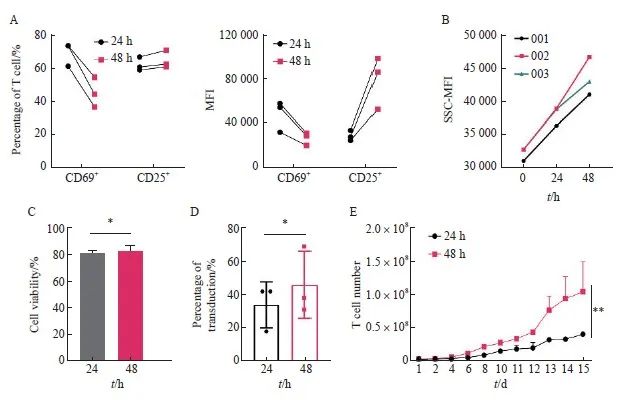
图4 活化时间为24和48 h之间的比较
Fig.4 Comparison of activation time between 24 and 48 h
A: Expression level of CD25 and CD69; B: The variation of T cell size with activation time, 001, 002 and 003 represents three groups of T cells of different origin; C: Cell viability of anti-CD30 CAR-T cells; D: Transduction efficiency of anti-CD30 CAR-T with two different activation times; E: Proliferation activity of T cell with two different activation times. *: P>0.05, compared with each other; **: P<0.01, compared with each other.
2.5 转导体系高度对于抗CD30 CAR-T细胞转导的影响
转导体系高度为转导体积/底面积。T细胞在转导时迅速沉积在容器底部,导致转导体系顶部溶液中的慢病毒很难与沉积下来的T细胞接触,进而可能影响T细胞的转导。为了验证上述猜想,分别采用0.16和0.53 mm两种转导体系高度对T细胞的转导进行研究。实验结果显示,0.16 mm组在第8天的转导效率显著高于0.53 mm组[(62.00±1.41)% vs(37.00±2.83)%,P<0.01,图5A]。细胞增殖实验结果显示,0.16 mm组抗CD30 CAR-T细胞的增殖倍数显著高于0.53 mm组(P<0.05,图5B)。
本研究还分析了不同转导体系高度对抗CD30 CAR-T细胞毒作用的影响,结果显示,在相同效靶比时,0.16和0.53 mm组对L428肿瘤细胞的杀伤作用差异无统计学意义[效靶比为25∶1时:(14.67±2.08)% vs(17.67±1.53)%,P >0.05,图5C]。综上所述,根据转导效率、增殖倍数、体外杀伤效率等情况,选择MOI=1.0、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm作为最终转导优化条件。
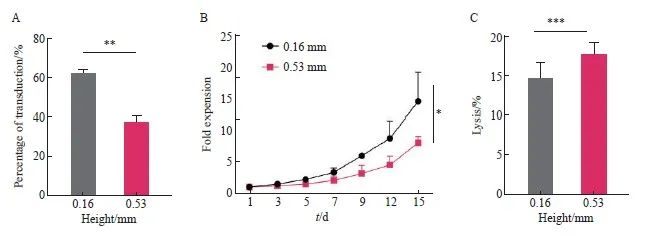
图5 不同转导体系高度对于抗CD30 CAR-T细胞转导的影响
Fig. 5 Effects of different height on transduction of anti-CD30 CAR-T
A: Transduction efficiency of anti-CD30 CAR-T with two different bottom-areas; B: Proliferation activity of T cell with two different bottom-areasanti-CD30 CAR-T; C: Lysis efficiency of anti-CD30 CAR-T cells. *: P<0.05, compared with each other; **: P<0.01, compared with each other; ***: P>0.05, compared with each other.
3 讨 论
CAR-T细胞疗法是基于免疫细胞的疗法之一[24]。由于T细胞具有细胞毒性、体外培养增殖良好、病毒载体易转导等特点[25],CAR-T细胞现在已经成为常见且有效的用于癌症治疗的基因修饰细胞[26]。慢病毒可以高效地将基因整合到静止期和增殖期的真核细胞的基因组中并稳定表达[27],临床安全性也高于其他病毒[28],由于上述原因,目前最成熟的CAR-T基因修饰方法是慢病毒转导法[29]。抗CD30 CAR-T细胞的慢病毒转导条件鲜见报道,因此本实验通过对MOI、温育密度、转导前活化时间和转导体系高度等转导条件进行研究,优化慢病毒转导T细胞时的参数,以制备出转导效率更高、功能更强的抗CD30 CAR-T细胞,为抗CD30 CAR-T细胞后续的临床研究提供参 考。
本研究结果显示,MOI等于1、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm时,转导得到的抗CD30 CAR-T细胞的转导效率更高,增殖效果更好,但对抗CD30 CAR-T细胞的杀伤功能无影响。原代T细胞取材于不同健康人群外周血,因此原代T细胞间可能存在个体差异。MOI转导参数研究结果显示,MOI大于1时,抗CD30 CAR-T细胞的转导效率处于平台期,可能其他靶点的慢病毒在进行CAR-T细胞转导时也会出现该现象;转导前活化时间决定了T细胞的状态,可能会影响T细胞相关基因的表达水平,进而影响慢病毒的转导效果和表观遗传修饰;T细胞的直径只有8~10 μm,转导体系过高导致上层慢病毒颗粒无法与T细胞接触,进而影响转导效率。本研究将转导体系高度作为慢病毒静止转导的研究参数,同时也验证了我们的猜想:转导体系的高度趋近于T细胞的直径时,可能会使慢病毒的转导效率不断提高。本研究对不同转导条件下的抗CD30 CAR-T细胞的分析评价指标较少,可通过细胞表型、耗竭程度、表观遗传及细胞因子等[30-33]进行进一步研究,以提高抗CD30 CAR-T细胞的质量。
综上所述,本研究通过对MOI、温育密度、转导前活化时间和转导体系高度等转导参数的研究,最终获得了最优的转导条件:MOI等于1、温育密度为1.0×107个/mL、转导前活化48 h、转导体系高度为0.16 mm。这样的转导条件可以显著提高抗CD30 CAR-T细胞的转导效率,增强抗CD30 CAR-T细胞的增殖能力,且对抗CD30 CAR-T细胞的杀伤能力无显著影响。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] MILONE M C, O'DOHERTY U. Clinical use of lentiviral vectors[J]. Leukemia, 2018, 32(7): 1529-1541.
[2] MAUDE S L. Future directions in chimeric antigen receptor T cell therapy[J]. Curr Opin Pediatr, 2017, 29(1): 27-33.
[3] THOMAS C E, EHRHARDT A, KAY M A. Progress and problems with the use of viral vectors for gene therapy[J]. Nat Rev Genet, 2003, 4(5): 346-358.
[4]VANNUCCI L, LAI M, CHIUPPESI F, et al. Viral vectors: a look back and ahead on gene transfer technology[J]. New Microbiol, 2013, 36(1): 1-22.
[5]FINKELSHTEIN D, WERMAN A, NOVICK D, et al. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus[J]. Proc Natl Acad Sci U S A, 2013, 110(18): 7306-7311.
[6]AMIRACHE F, LÉVY C, COSTA C, et al. Mystery solved: VSV-G-LVs do not allow efficient gene transfer into unstimulated T cells, B cells, and HSCs because they lack the LDL receptor[J]. Blood, 2014, 123(9): 1422-1424.
[7]DULL T, ZUFFEREY R, KELLY M, et al. A third-generation lentivirus vector with a conditional packaging system[J]. J Virol, 1998, 72(11): 8463-8471.
[8]JUNE C H, O’CONNOR R S, KAWALEKAR O U, et al. CAR T cell immunotherapy for human cancer[J]. Science, 2018, 359(6382): 1361-1365.
[9]李 帆, 张琴星, 童祥文, 等. 不同信号肽对嵌合抗原受体T细胞杀伤作用的影响研究[J]. 中国癌症杂志, 2022, 32(2): 142-151.
LI F, ZHANG Q X, TONG X W, et al. A study on influence of different signal peptides on anti-tumor effect of chimeric antigen receptor (CAR) T cells[J]. China Oncol, 2022, 32(2): 142-151.
[10]MAUDE S L, FREY N, SHAW P A, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med, 2014, 371(16): 1507-1517.
[11]WANG Z G, WU Z Q, LIU Y, et al. New development in CAR-T cell therapy[J]. J Hematol Oncol, 2017, 10(1): 53.
[12]FRY T J, SHAH N N, ORENTAS R J, et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy[J]. Nat Med, 2018, 24(1): 20-28.
[13]MARTINO M, ALATI C, CANALE F A, et al. A review of clinical outcomes of CAR T-cell therapies for B-acute lymphoblastic leukemia[J]. Int J Mol Sci, 2021, 22(4): 2150.
[14]PIERCE J M R, MEHTA A. Diagnostic, prognostic and therapeutic role of CD30 in lymphoma[J]. Expert Rev Hematol, 2017, 10(1): 29-37.
[15]RAMOS C A, GROVER N S, BEAVEN A W, et al. Anti-CD30 CAR-T cell therapy in relapsed and refractory Hodgkin lymphoma[J]. J Clin Oncol, 2020, 38(32): 3794-3804.
[16]RAMOS C A, BALLARD B, ZHANG H M, et al. Clinical and immunological responses after CD30-specific chimeric antigen receptor-redirected lymphocytes[J]. J Clin Invest, 2017, 127(9): 3462-3471.
[17]ZHANG S K, GU C J, HUANG L F, et al. The third-generation anti-CD30 CAR T-cells specifically homing to the tumor and mediating powerful antitumor activity[J]. Sci Rep, 2022, 12(1): 10488.
[18]SIMON B, HARRER D C, THIRION C, et al. Enhancing lentiviral transduction to generate melanoma-specific human T cells for cancer immunotherapy[J]. J Immunol Methods, 2019, 472: 55-64.
[19]UCHIDA N, NASSEHI T, DRYSDALE C M, et al. High-efficiency lentiviral transduction of human CD34+ cells in high-density culture with poloxamer and prostaglandin E2[J]. Mol Ther Methods Clin Dev, 2019, 13: 187-196.
[20]GHASSEMI S, DURGIN J S, NUNEZ-CRUZ S, et al. Rapid manufacturing of non-activated potent CAR-T cells[J]. Nat Biomed Eng, 2022, 6(2): 118-128.
[21]BRYN T, YAQUB S, MAHIC M, et al. LPS-activated monocytes suppress T-cell immune responses and induce FOXP3+ T cells through a COX-2-PGE2-dependent mechanism[J]. Int Immunol, 2008, 20(2): 235-245.
[22]AGRAHARI G, SAH S K, BANG C H, et al. Superoxide dismutase 3 controls the activation and differentiation of CD4+ T cells[J]. Front Immunol, 2021, 12: 628117.
[23]CHAPMAN N M, CHI H. Hallmarks of T-cell exit from quiescence[J]. Cancer Immunol Res, 2018, 6(5): 502-508.
[24]OKUMA A. Generation of CAR-T cells by lentiviral transduction[J]. Methods Mol Biol, 2021, 2312: 3-14.
[25]MOHANTY R, CHOWDHURY C R, AREGA S, et al. CAR-T cell therapy: a new era for cancer treatment (review)[J]. Oncol Rep, 2019, 42(6): 2183-2195.
[26]CHEN G M, CHEN C H, PERAZZELLI J, et al. Characterization of leukemic resistance to CD19-targeted CAR T-cell therapy through deep genomic sequencing[J]. Cancer Immunol Res, 2023, 11(1): 13-19.
[27]COCKRELL A S, KAFRI T. Gene delivery by lentivirus vectors[J]. Mol Biotechnol, 2007, 36(3): 184-204.
[28]BERKOWITZ R D, ILVES H, PLAVEC I, et al. Gene transfer systems derived from Visna virus: analysis of virus production and infectivity[J]. Virology, 2001, 279(1): 116-129.
[29]LABBÉ R P, VESSILLIER S, RAFIQ Q A. Lentiviral vectors for T cell engineering: clinical applications, bioprocessing and future perspectives[J]. Viruses, 2021, 13(8): 1528.
[30]GERRITSEN B, PANDIT A. The memory of a killer T cell: models of CD8(+) T cell differentiation[J]. Immunol Cell Biol, 2016, 94(3): 236-241.
[31]GATTINONI L, LUGLI E, JI Y, et al. A human memory T cell subset with stem cell-like properties[J]. Nat Med, 2011, 17(10): 1290-1297.
[32]GOLUBOVSKAYA V, WU L J. Different subsets of T cells, memory, effector functions, and CAR-T immunotherapy[J]. Cancers (Basel), 2016, 8(3): 36.
[33]WEBER E W, PARKER K R, SOTILLO E, et al. Transient rest restores functionality in exhausted CAR-T cells through epigenetic remodeling[J]. Science, 2021, 372(6537): eaba1786.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言