CCR:复发性低级别浆液性卵巢癌携带MAPK通路变异,对比美替尼和化疗均有较高的缓解率
2024-02-29 苏州绘真医学 苏州绘真医学 发表于上海
本文展示了3期MILO/ENGOT-ov11研究(NCT01849874)的肿瘤组织事后分析结果。

本文展示了3期MILO/ENGOT-ov11研究(NCT01849874)的肿瘤组织事后分析结果。对随机分组前获得的组织进行突变/拷贝数分析。采用Kaplan-Meier法估算无进展生存期(PFS)。无偏倚单变量分析、Cox回归和二元Logistic回归用于检验突变状态和结局之间的关联。
2013年6月至2016年4月,MILO/ENGOT-ov11共纳入341例患者,年龄为22~79岁。患者以2∶1的比例随机分组,分别接受比美替尼(贝美替尼,binimetinib,Mektovi)或医师选择的化疗(PCC)。最常见的变异基因是KRAS(33%)。在135例接受比美替尼治疗并有缓解率(RR)数据的患者中,检测到的其他MAPK通路变异包括:NRAS(n=11,8.1%)、BRAF V600E(n=8,5.9%)、RAF1(n=2,1.5%)和NF1(n=7,5.2%)。在有和无MAPK通路变异的患者中,比美替尼的RRs分别为41%和13%。与未发生MAPK通路变异的患者相比,发生MAPK通路变异的患者在接受比美替尼治疗后的PFS显著延长(HR,0.5;95%CI 0.31-0.79)。与未发生MAPK通路变异的患者相比,发生MAPK通路变异的患者接受PCC治疗后有趋势不显著的PFS改善(HR,0.82;95%CI,0.43-1.59)。
据研究者所知,这是对低级别浆液性卵巢癌(LGSOC)患者开展的最大规模随机研究。虽然本研究未达到主要终点,但产生的数据提供了关于分子变异如何影响结局的有价值信息。研究报告了MAPK通路变异和患者结局之间关联的综合分析。在接受比美替尼治疗的MAPK通路变异LGSOC患者中观察到较高的缓RRs和显著较长的PFS,在接受PCC的MAPK通路变异患者中观察到较小程度的RRs和PFS改善。本研究结果提供了可靠的证据,MAPK通路变异状态对LGSOC患者的预后有意义。对于所有复发性LGSOC患者,应考虑进行肿瘤体细胞检测,以帮助做出有关系统性治疗相对获益的临床决策,并在未来LGSOC的前瞻性研究中用作分层因素。
研究背景
低级别浆液性卵巢癌(LGSOC)占所有上皮性卵巢癌的5%~10%,其特征是临床病程漫长、p53野生型(WT)表达和MAPK通路变异的高发生率。相反,高级别浆液性卵巢癌几乎普遍显示异常的p53表达,很少有可识别的MAPK通路变异。MAPK通路通过Ras家族成员(KRAS、NRAS和HRAS)介导的信号转导级联调节细胞增殖,导致下游RAF/MEK/ERK效应蛋白的激活,并可被该通路的负调控因子抑制。在LGSOC肿瘤中,KRAS突变的发生率为19%~36%,BRAF突变的发生率为2%~16%。正如回顾性报告中所报道的那样,化疗后的缓解率低,以及LGSOC具有独特的分子特征,这些使人们对使用MEK抑制剂治疗复发性LGSOC患者产生了极大的兴趣。
口服MEK抑制剂司美替尼(selumetinib)的一项2期研究结果显示,在未经分子选择的复发性LGSOC患者人群中,司美替尼显示出很有前景的活性,客观缓解率(ORR)为15.4%。该研究表明,突变状态与司美替尼治疗的应答之间没有关联。然而,这一发现有局限性,因为在纳入的患者中,只有65%有足够的DNA进行基因组分析,并且该研究的重点是检测BRAF的密码子600突变以及KRAS的密码子12和13突变。随后,开展了两项关于MEK抑制剂治疗复发性LGSOC的大型研究,两项研究均纳入了未进行分子选择的患者。一项比较曲美替尼与PCC或内分泌治疗的随机2/3期研究表明,在复发性LGSOC女性患者中,曲美替尼单药治疗的缓解率为26.2%(GOG-0281,NCT02101788)。3期MILO/ENGOT-ov11研究比较了比美替尼与PCC治疗复发性LGSOC患者的效果,在对初始303例患者进行中期分析后(2016年1月数据截止日期),研究提前结束。研究发现,PFS的HR跨过了预先设定的无效阈值。在中期分析时,据报告比美替尼的缓解率为16%。患者被告知中期分析结果,并允许患者继续接受比美替尼治疗,直至达到停药标准。根据当地RECIST 1.1放射学读数,2019年1月数据截止日期的最新分析表明,比美替尼单药治疗的缓解率为24%。曲美替尼和比美替尼现在被美国国家综合癌症网络(NCCN)分别列为复发性LGSOC患者的2A类和B类治疗选择。虽然这些研究表明,在复发性LGSOC女性一般人群中,MEK抑制剂单药治疗的缓解率很有前景,但它们也促使人们关注确定生物标志物,以便更好地选择最有可能从MEK抑制剂治疗中获益的患者。本文展示了与3期MILO/ENGOT-ov11研究结合进行的肿瘤组织基因检测的结果。
研究方法
MILO/ENGOT-ov11研究纳入了患低级别卵巢浆液性癌或原发性腹膜癌的女性。接受比美替尼治疗的患者中位年龄为51.6岁(23~79岁),接受PCC治疗的患者中位年龄为50.2岁(22~78岁)。简而言之,符合条件的患者患可测量的复发性或持续性疾病,既往接受过≥1种铂类化疗方案,但总共接受过≤3种化疗方案,既往接受激素治疗的线数不受限制。患者的美国东部肿瘤协作组体能状态评分为0或1分。既往接受过MEK或BRAF抑制剂治疗的患者被排除。患者按照2∶1的比例随机分组,分别接受比美替尼或医师选择的静脉化疗(聚乙二醇脂质体多柔比星、紫杉醇或拓扑替康)。比美替尼45 mg口服,每日2次,从第1天开始,连续用药。
研究结果
2013年6月至2016年4月,MILO/ENGOT-ov11 3期临床研究共纳入341例患者。在有可用的测序数据且接受比美替尼治疗患者中,144例患者有PFS数据,135例患者有RECIST 1.1缓解数据。在有分子分析数据的PCC治疗患者中,有71例患者有PFS数据,66例患者有RECIST 1.1缓解数据(图1)。基因panel检测的基因中有47个基因在至少5%的患者中发生了变异。KRAS是最常见的突变基因,发生于33%的患者。两组的KRAS突变频率相似——比美替尼治疗组有46例患者(32%)和PCC治疗组有24例患者(34%)。
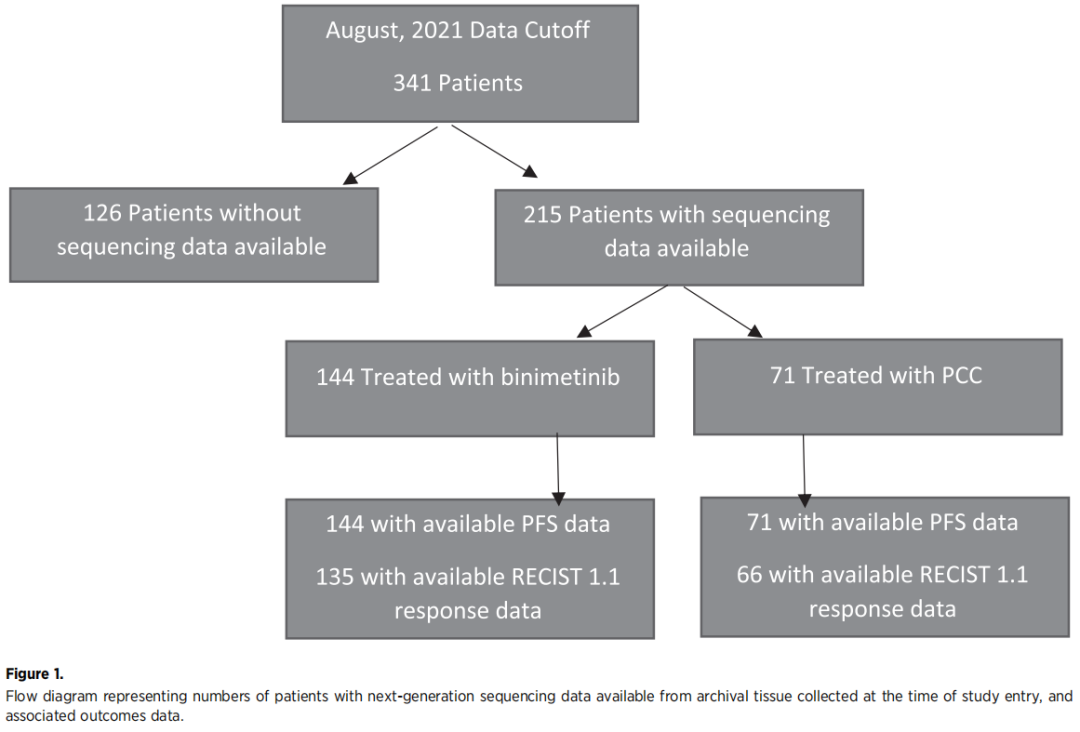
图1
研究分析了变异基因与总缓解率和PFS之间的单变量关联。虽然没有任何基因达到FDR阈值0.05,但在比美替尼组中,KRAS是总缓解率和PFS的最强预测因素。因此,研究者选择关注其效果。研究者还研究了PFS和总体缓解结局的多变量基因组模型。值得注意的是,NRAS是模型中与总体反应独立相关的唯一其他预测因素。与之前的报告一样,在215名患者的总体队列中,NRAS和KRAS是相互排斥的。结合现有的关于MAPK信号通路突变与MEK抑制剂敏感性相关的报道,这促使研究者也研究MAPK信号通路。根据KRAS突变状态,RECIST 1.1以二元方式将最佳反应定义为CR/PR或SD/PD,在接受PCC治疗的患者中,33%(8/24)的KRAS突变患者达到CR/PR,而19%(8/42)的KRAS野生型患者达到CR/PR。在接受比美替尼治疗的患者中,44%(20/45)的KRAS突变患者获得CR/PR,而19%(17/90)的KRAS野生型患者获得CR/PR。携带KRAS突变的患者接受比美替尼治疗的反应率是未携带KRAS突变患者的3.4倍(95%CI,1.57~7.67;p=0.004)。
在比美替尼治疗组中,携带KRAS突变的患者发生进展或死亡的风险比未携带KRAS突变的患者降低50%。PCC组的患者在同一方向上表现出较小的效应大小。治疗类型/KRAS突变之间的相互作用在反应(加法(additive)P=0.8,乘法(multiplicative)P=0.5)或PFS(加法P=0.5,乘法P=0.5)结果的加法或乘法量表上均不显著(图2A)。
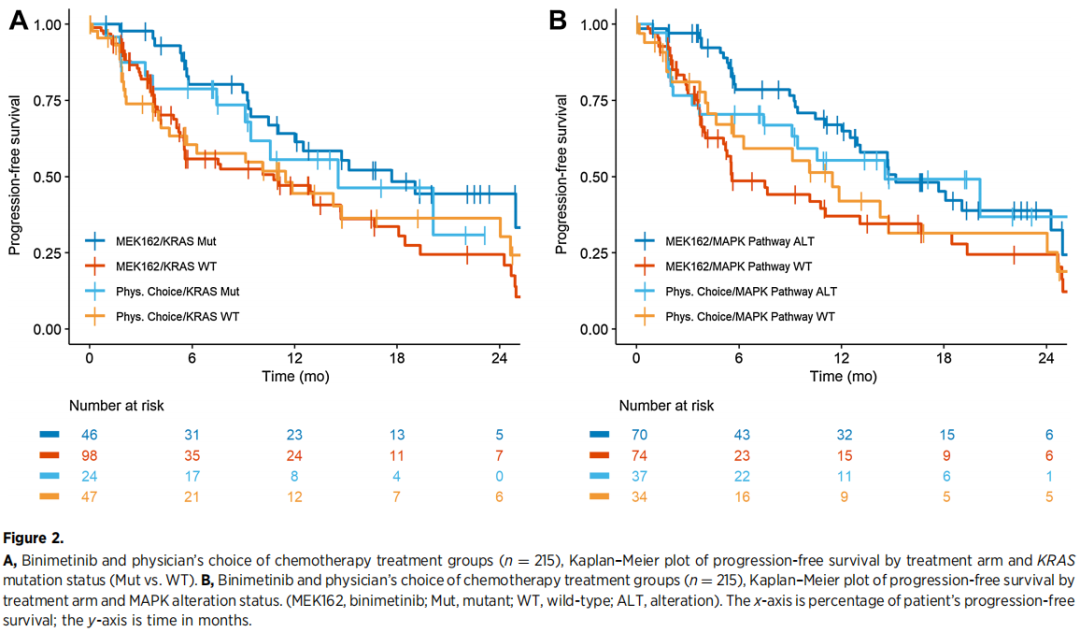
图2
为了研究与其他KRAS点突变相比,KRAS G12V突变是否与更好的结局相关,研究者利用Cox回归评估了与其他KRAS突变患者相比,KRAS G12V突变患者的PFS。采用Fisher精确检验确定KRAS G12V(n=19)与其他KRAS突变(n=26)之间的任何关联,并根据RECIST 1.1确定影像学最佳应答。在接受比美替尼治疗的患者中,在KRAS G12V突变与其他KRAS突变对PFS或最佳影像学缓解的影响方面,未观察到差异(PFS HR,1.08;95%CI,0.45-2.59;P=0.9)。
在135名接受比美替尼治疗且具有RECIST 1.1缓解数据的患者中,其他发现的MAPK通路变异包括:NRAS(n=11,8.1%)、BRAF V600E(n=8,5.9%)、RAF1(n=2,1.5%)和NF1(n=7,5.2%)。在接受比美替尼治疗的患者中,有MAPK通路变异的患者和无MAPK通路变异的患者的缓解率(最佳缓解为CR或PR)分别为41%和13%(表1)。在接受PCC治疗的患者中(n=66),有MAPK通路变异和无MAPK通路变异的患者的缓解率分别为29%和19%。在接受比尼替尼治疗的患者中(n=144),与未发生MAPK通路变异的患者相比,发生MAPK通路变异的患者有较长的PFS(HR,0.50;95%CI,0.31–0.79;P=0.003)。在接受PCC治疗的患者中(n=71),与未发生MAPK通路变异的患者相比,发生MAPK通路变异的患者有延长PFS的趋势(HR,0.82;95%CI,0.43-1.59;P=0.6)。在反应(加法P=0.9,乘法P=0.2)和PFS(加法P=0.4,乘法P=0.3)结局的加法或乘法量表上,治疗和MAPK通路变异之间的交互作用检验均不显著(图2B)。
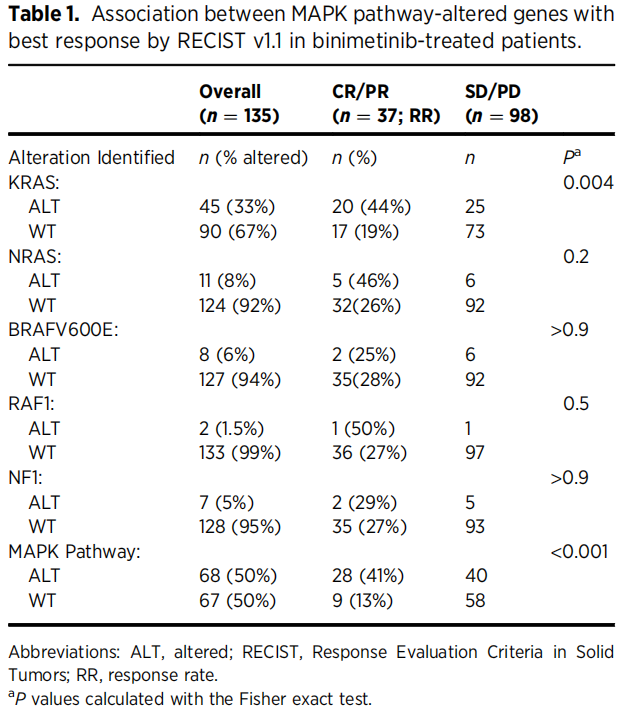
表1
图3显示了在144例接受比美替尼治疗的患者中观察到的治疗持续时间和最佳应答。在2021年8月的数据截止日期,有5例患者仍在接受比美替尼治疗。总体患者达到最佳缓解的中位时间为3.6个月,5例达到CR的患者达到最佳缓解的中位时间为14.6个月。
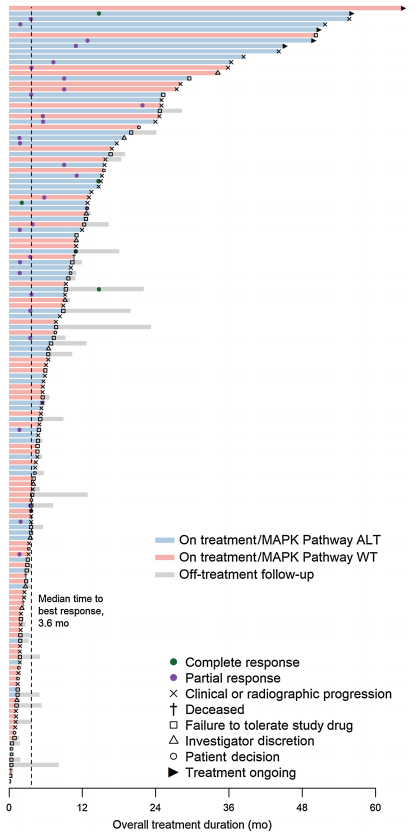

图3
图4显示了1例携带KRAS G12D突变的患者的代表性CT扫描图像,该患者在接受比美替尼治疗期间获得了持续CR。患者最初于2005年被诊断为IIIA期交界性浆液性肿瘤,有非侵入性植入物,当时她接受了经腹全子宫切除术、双侧输卵管切除术和手术分期。2013年患者被诊断为复发性疾病,进展为LGSOC。在剖腹探查和肿瘤减积术后,发现在小肠系膜和大肠系膜上有多个植入物的残留病变。术后,患者接受了静脉给药卡铂和每周紫杉醇+贝伐珠单抗,随后进行了14个周期的贝伐珠单抗维持治疗,直至PET扫描显示疾病多灶进展。疾病进展时进行的活检显示KRAS G12D突变。2015年,患者被纳入MILO/ENGOT-ov11研究,并开始接受比美替尼治疗。治疗16个月后,患者达到CR。2018年,患者心脏射血分数(EF)降低至45%。比美替尼停药直至EF恢复正常,此时患者以较小剂量继续使用比美替尼。在2021年8月数据截止日期时,患者持续获得CR。

图4
讨 论
大多数LGSOC患者表现为晚期疾病,70%最终发展为复发性或持续性疾病。从历史上看,LGSOC既难以治疗,也难以进行前瞻性研究。与高级别疾病患者相比,LGSOC患者具有不同的临床、组织学和分子特征,诊断时的中位年龄较小,对化疗的缓解率较低,且无TP53突变。由于这些原因,在评估卵巢癌新疗法的大多数临床试验中,LGSOC患者通常被排除。此外,限于LGSOC患者的前瞻性治疗试验因该病的罕见性、需要额外的时间、费用以及多中心之间的合作而受到阻碍。
MILO/ENGOT-ov11研究是在组织学证实的LGSOC患者中进行的最大的前瞻性3期临床试验,在102个研究中心纳入了341例患者。本文给出的数据代表了一项事后分析,作为预先计划的探索性分析的一部分,研究者分析了在纳入研究时采集的FFPE组织中进行的肿瘤突变谱与患者结局(基于截止日期2021年8月更新的数据)之间的关系。
这项分析证实,MAPK通路变异常见于复发性LGSOC患者,最常见的是KRAS突变,这与之前报道的LGSOC患者的KRAS(19%-41%)、NRAS(9%-26%)和BRAF(2%-16%)突变率一致。
与未携带KRAS突变的患者相比,携带KRAS突变的患者对比美替尼治疗产生应答(CR或PR)的可能性高出3.4倍(95%CI,1.57-7.67)。在接受比美替尼治疗的患者中,44%(20/45)的KRAS突变患者达到CR/PR,而KRAS WT患者为19%(17/90)。在接受PCC治疗的患者中,33%(8/24)的KRAS突变患者和19%(8/42)的KRAS WT患者获得了CR或PR的最佳反应。在接受比美替尼治疗的患者中,有MAPK通路变异的患者与无这些变异的患者相比,PFS更长(HR,0.50;95%CI,0.31-0.79)。在接受PCC治疗的MAPK通路变异的患者中,观察到PFS改善的类似趋势(HR,0.82;95%CI,0.43-1.59)。有限的体外和体内数据表明,与其他KRAS变异相比,携带KRAS G12V突变的患者可能对MEK抑制更敏感。在本研究中,KRAS G12V突变与其他KRAS突变对PFS或最佳影像学缓解的影响无差异。为了进一步评估有MAPK通路变异与临床结局之间的关系,研究者比较了有MAPK通路变异的患者组与无MAPK通路变异的患者组,发现在接受比美替尼治疗的患者中,有MAPK通路变异与较长的PFS相关(HR,0.50;95%CI,0.31–0.79)。值得注意的是,在获得CR的5例接受比美替尼治疗的患者中,至达到最佳缓解的中位时间为14.6个月,这表明可能需要长期随访才能确定患者的真正最佳缓解。在考虑未来研究的中期分析设计和患者的临床管理时,这一点非常重要。
在GOG-0281研究中,获得了134例患者的测序数据,其中44例(33%)携带活化MAPK通路相关的KRAS、BRAF或NRAS突变。曲美替尼治疗组70例患者中的22例(31%)和标准治疗组64例患者中的22例(34%)被检测出突变。在该研究中,携带MAPK通路突变的患者接受曲美替尼治疗后的PFS和ORR均显著较好[中位PFS分别为13.2个月(95%CI,9.4-20.8)vs 7.3个月(95%CI,5.6-12.7);ORR分别为50%(95%CI,30.2-69.8)vs 8.3%(95%CI,2.9-18.6)]。分析未发现突变状态是PFS的预测因素(多重比较校正P=0.72,交互作用检验)。与本文的结果相似,在GOG-0281研究中,尽管未达到统计学显著性(多重比较校正P=0.11,交互作用检验),MAPK通路突变患者接受曲美替尼治疗的ORR优于标准治疗[11/22(50%)vs. 2/22(9%)],而无MAPK通路突变患者接受曲美替尼治疗的ORR与标准治疗相似[4/45(8%)vs. 3/42(7%)]。
先前的回顾性数据表明,在LGSOC患者中,MAPK通路的变异与铂类药物敏感性和生存期延长相关,支持本研究中观察到的PCC治疗患者结局改善的趋势。另外,在接受MEK抑制剂治疗的患者中,在GOG-0281和MILO/ENGOT-ov11研究中,MAPK通路变异(包括KRAS)与应答情况的显著差异相关。MAPK通路变异的患者接受比美替尼治疗的缓解率(CR/PR)为41%,而MAPK通路无变异的患者为13%。在接受PCC治疗的患者中观察到缓解率改善的趋势较小(分别为29%和19%)。
本研究有几个局限性。本文报告的分析是基于特定基因测序的事后分析,而不是基于全外显子组或全基因组测序。突变发生率低和分析的事后性质限制了寻找统计学显著关联的统计学功效。这一分析主要是产生假设,并受到多重检验的限制。此外,LGSOC患者的活检样本通常具有低肿瘤含量和沙砾样钙化,这限制了对一部分提交的FFPE组织样本进行基因分析的能力。
综上所述,这些数据表明,MEK抑制剂对LGSOC女性有活性,在就临床获益预期向患者提供咨询时,应考虑突变状态。研究发现,有MAPK变异(最常见的是KRAS)的复发性LGSOC患者对PCC和比美替尼治疗均有较高的缓解率,其中有MAPK变异并接受比美替尼治疗的患者的缓解率最高。考虑到MEK抑制剂的潜在毒性(可能包括眼部不良事件、皮疹、水肿和充血性心力衰竭的风险),患者的分子状态可能有助于确定治疗顺序和个体风险/获益分析。目前,靶向LGSOC患者MAPK通路的新型治疗方法正在开发中,这为实现精准治疗带来了新的机遇。未来在LGSOC患者中进行的前瞻性研究应收集有关患者体细胞突变状态的数据,并考虑对这一变量进行分层。
在携带MAPK通路变异的患者中观察到较高的缓解率和较长的PFS,其中携带MAPK通路变异并接受比美替尼治疗的患者缓解率最高。虽然治疗与KRAS/MAPK变异状态之间的交互作用不显著,但比美替尼组的效应更强,相关性更显著,而医师选择化疗组的人数较少。MAPK通路变异可预测比美替尼治疗应答这一假设的支持证据需要功效更充分的研究。然而,这项分析的结果提供了可靠的证据,MAPK通路的变异状态对LGSOC患者的预后有意义。对于复发性LGSOC患者,应常规考虑进行肿瘤体细胞检测,以帮助临床决策,并应在未来的临床试验中加以考虑。
参考文献:
Grisham, Rachel N et al. “Molecular Results and Potential Biomarkers Identified from the Phase 3 MILO/ENGOT-ov11 Study of Binimetinib versus Physician Choice of Chemotherapy in Recurrent Low-Grade Serous Ovarian Cancer.” Clinical cancer research : an official journal of the American Association for Cancer Research vol. 29,20 (2023): 4068-4075. doi:10.1158/1078-0432.CCR-23-0621

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#MAPK通路# #低级别浆液性卵巢癌# #比美替尼#
18