Nature Structural & Molecular Biology:紊乱蛋白质的结构偏差在细胞中很普遍
2024-02-23 Jenny Ou MedSci原创 发表于上海
我们建议,IDP集成的结构敏感性可以用于生物功能,可以成为IDP驱动病理学的根本原因,也可以用于设计基于障碍的生物传感器和执行器。
内在紊乱的蛋白质和蛋白质区域(IDP)在许多细胞途径中起着关键作用,对所有生命王国的细胞功能至关重要。与折叠蛋白质相比,IDP缺乏稳定的三级结构,分子内相互作用较少,并将其序列的更大区域暴露在周围的溶液中。因此,IDP存在于一个高度不同的构象集合中,这些构象可以根据其周围环境的物理化学特性迅速变化。

尽管具有高度动态性,但IDP集合通常包含结构偏差,或对集合中某些构象子集的偏好。这种结构偏差可能来自蛋白质序列中的短程或长程相互作用。大量工作确立了IDP集成结构对其功能的重要性。例如,形成瞬态ɑ-螺旋段的局部偏置调节PUMA6和p53中的结合亲和力以及TDP-43的液相分离特性。
发现远程结构偏差的变化会影响p53中的IDP功能,BMAL1和Myc。然而,除了少数例外,将IDP系综结构与功能联系起来的研究是在体外进行的。水缓冲液和细胞环境之间的差异是巨大的,这让人怀疑与体外功能相关的结构偏差是否在细胞中持续存在。
IDP集合体的结构延展性,加上细胞环境的动态性质,引发了两个主要悬而未决的问题:
(1)在体外观察到的IDP结构偏差在多大程度上保存在细胞内?
(2)IDP结构偏差如何应对动态细胞内环境中的物理化学变化?
回答这些问题需要结合体外和活细胞研究的相关方法。我们建立了一个表征管道,该管道结合了集成荧光共振能量转移(FRET)、分析尺寸排除色谱法(SEC)、小角度X射线散射(SAXS)、溶液成分变化和分子模拟,以识别体外IDP的结构偏差。然后,我们使用FRET显微镜检查活细胞内的相同结构。最后,我们通过使细胞受到渗透挑战来扰乱细胞系综,这些渗透挑战会迅速改变细胞体积,并通过FRET信号的变化测量IDP系综的响应。
2024年1月4日发表在Nature Structural & Molecular Biology的文章中,使用这种方法,我们发现定义体外IDP集合的结构偏差也存在于细胞内。此外,我们强调了IDP以序列依赖的方式对渗透挑战、亚细胞定位的变化或与折叠域的相互作用做出反应的案例。我们的结果表明,IDP结构偏差可以通过蛋白质序列或细胞环境的变化来调整。
本质紊乱的蛋白质和蛋白质区域(IDP)在所有蛋白质组中都很普遍,对细胞功能至关重要。与折叠蛋白质不同,境内流离失所者存在于一系列不同的构象中。尽管有这种结构可塑性,但分子内相互作用会产生序列特定的结构偏差,这些偏差决定了IDP系综的三维形状。
研究结果显示,这种结构偏差可能是IDP功能的关键,通常在体外测量,但这些偏差是否保留在细胞内还不清楚。在这里,我们表明,在体外发现的IDP集合中的结构偏差在人类衍生细胞中重现。我们进一步揭示,由于细胞内环境的变化、亚细胞定位以及与系带良好折叠结构域的分子内相互作用,结构偏差可能会以序列依赖的方式发生变化。
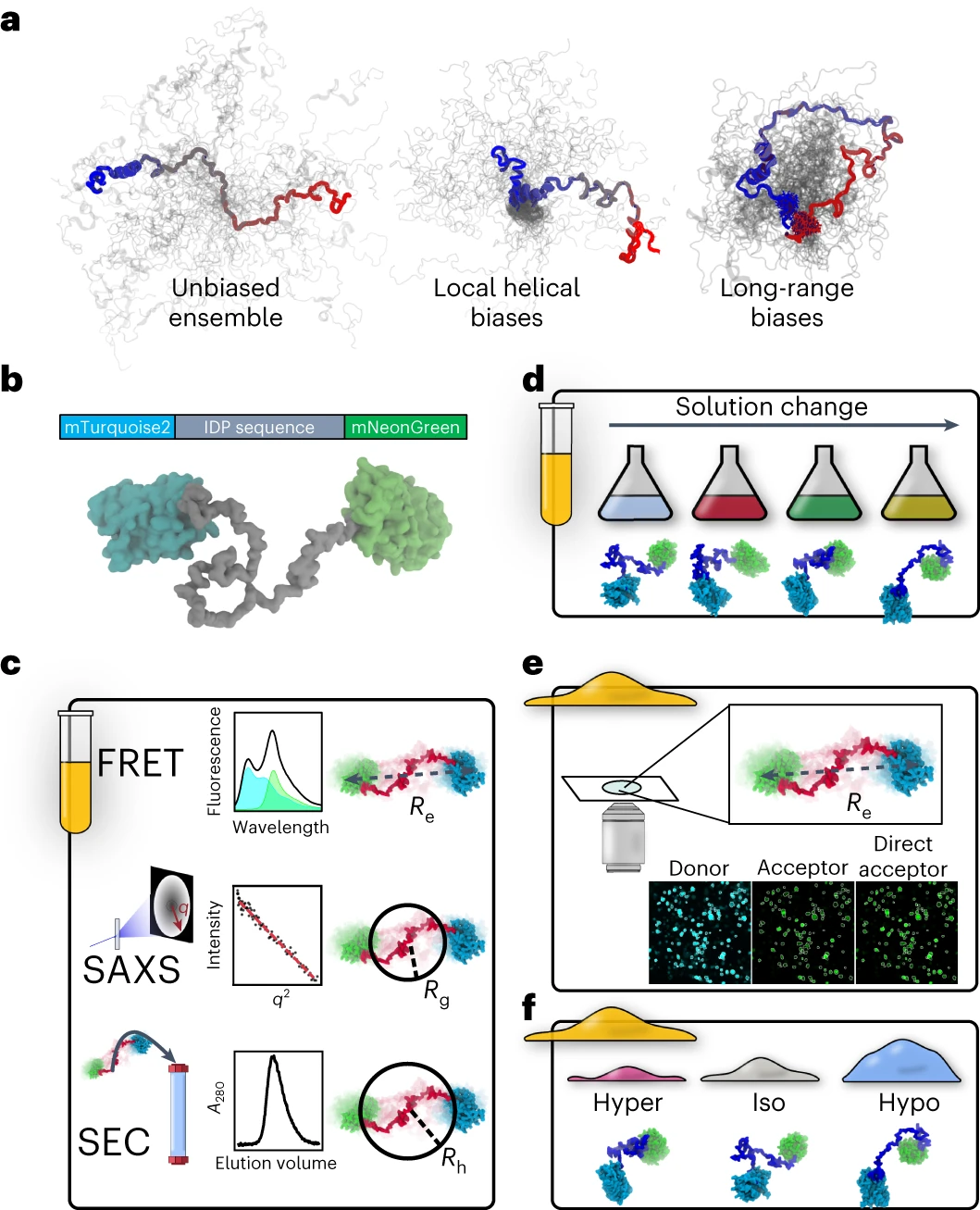
比较体外和细胞内IDP集合的方法
综上所述,对无序蛋白质的研究需要从经典的序列-结构-功能范式转向集合的结构偏差产生功能。虽然大量工作已经确定了体外IDP集合中存在结构偏差,但很少有研究试图以自洽的方式在许多结构的细胞中这样做。我们的结果系统地表明,结构偏差在IDP序列中很普遍,以氨基酸序列而不是成分编码,即使没有局部二级结构偏差也存在。
原文出处
Moses, D., Guadalupe, K., Yu, F. et al. Structural biases in disordered proteins are prevalent in the cell. Nat Struct Mol Biol 31, 283–292 (2024). https://doi.org/10.1038/s41594-023-01148-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#紊乱蛋白质#
15