读书报告 | DAISY 研究:德曲妥珠单抗治疗不同HER2表达水平的转移性乳腺癌的II期研究
2023-12-02 iCombo iCombo 发表于上海
了解这些作用机制和耐药性可以改善患者的治疗选择,并有可能开发出更有效的联合治疗策略。为此作者设计了DAISY试验。
导读
德曲妥珠单抗(Trastuzumab deruxtecan,T-DXd)是用于晚期乳腺癌(mBC)的抗HER2的抗体偶联药物,目前对其作用机制和耐药机制尚不完全清楚。II期DAISY试验评估了T-DXd在HER2过表达(n=72)、HER2低表达(n=74),和HER2不表达(n=40)转移性乳腺癌患者中的疗效。该研究证实了HER2表达水平是决定T-DXd疗效的关键因素,不同HER2表达水平的队列,患者的ORR、PFS以及T-DXd的分布都有一定的差异。值得关注的是,对于HER2阴性的患者,T-DXd仍然显示出了一定的临床疗效,证明了IHC可能不是定义HER2表达边界以预测HER2低表达患者疗效的最佳检测方法,提示可能存在其他的作用机制介导了T-DXd的疗效。T-DXd的耐药可能涉及多种机制,如HER2表达下降、肿瘤微环境改变等,后续仍需深入研究T-DXd的作用机制及获得性耐药的具体机制(Nat Med.2023 Jul 24. doi: 10.1038/s41591-023-02478-2)。
研究背景
既往的DB-03、01、02等研究证实了T-DXd在HER2过表达的mBC患者中的高抗肿瘤活性。在HER2低表达的mBC患者中,T-DXd最近被证明在二线治疗中优于全身化疗,改善了PFS 和OS,但大多数患者最终会经历疾病进展并死亡。
关于T-DXd的作用机制和耐药性仍存在一些问题:包括HER2表达及其空间分布对药物疗效的影响;T-DXd在肿瘤中的分布;对肿瘤微环境的潜在影响以及耐药性的分子机制等。
了解这些作用机制和耐药性可以改善患者的治疗选择,并有可能开发出更有效的联合治疗策略。为此作者设计了DAISY试验。
研究设计与方法
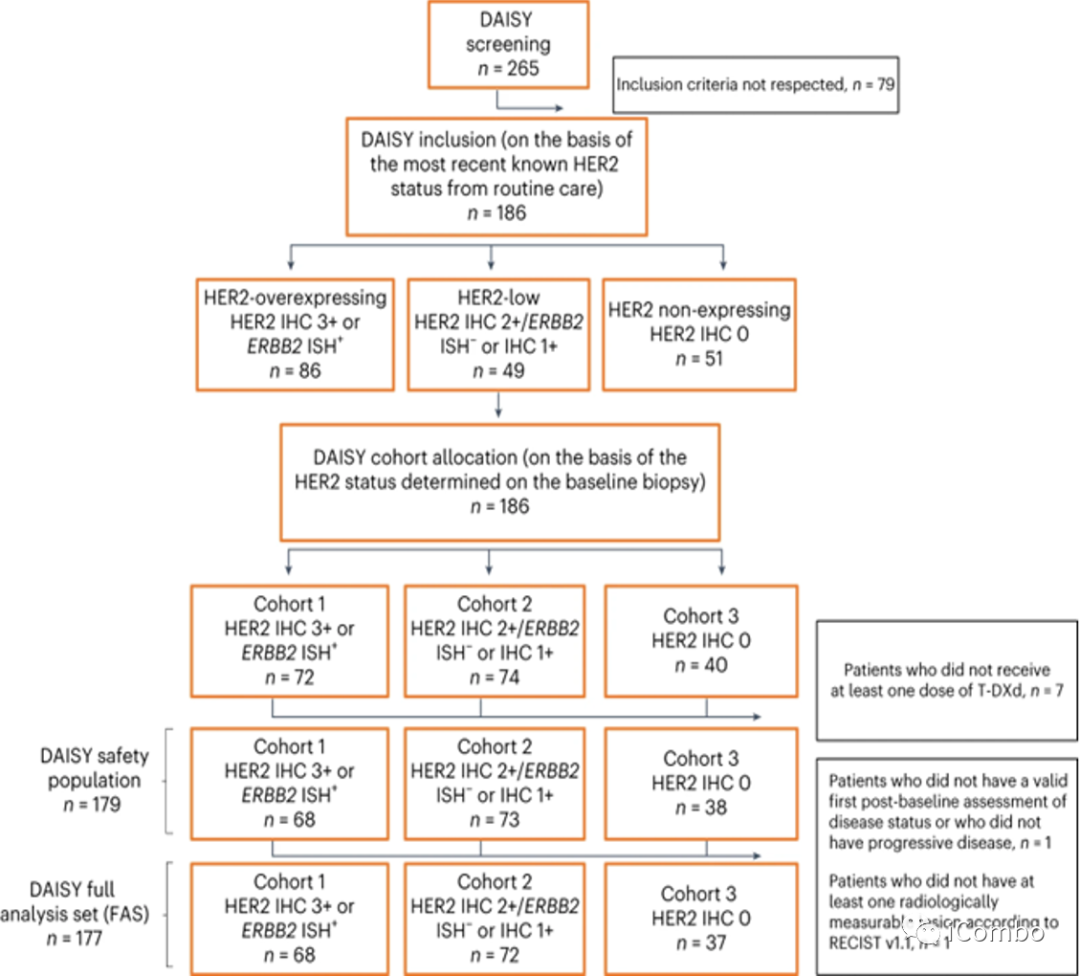
研究纳入2019年11月4日-2021年3月3日来自法国15家研究中心的mBC患者。入组患者在转移性疾病阶段至少接受过一线化疗,并且至少有一个非骨转移灶易于活检。
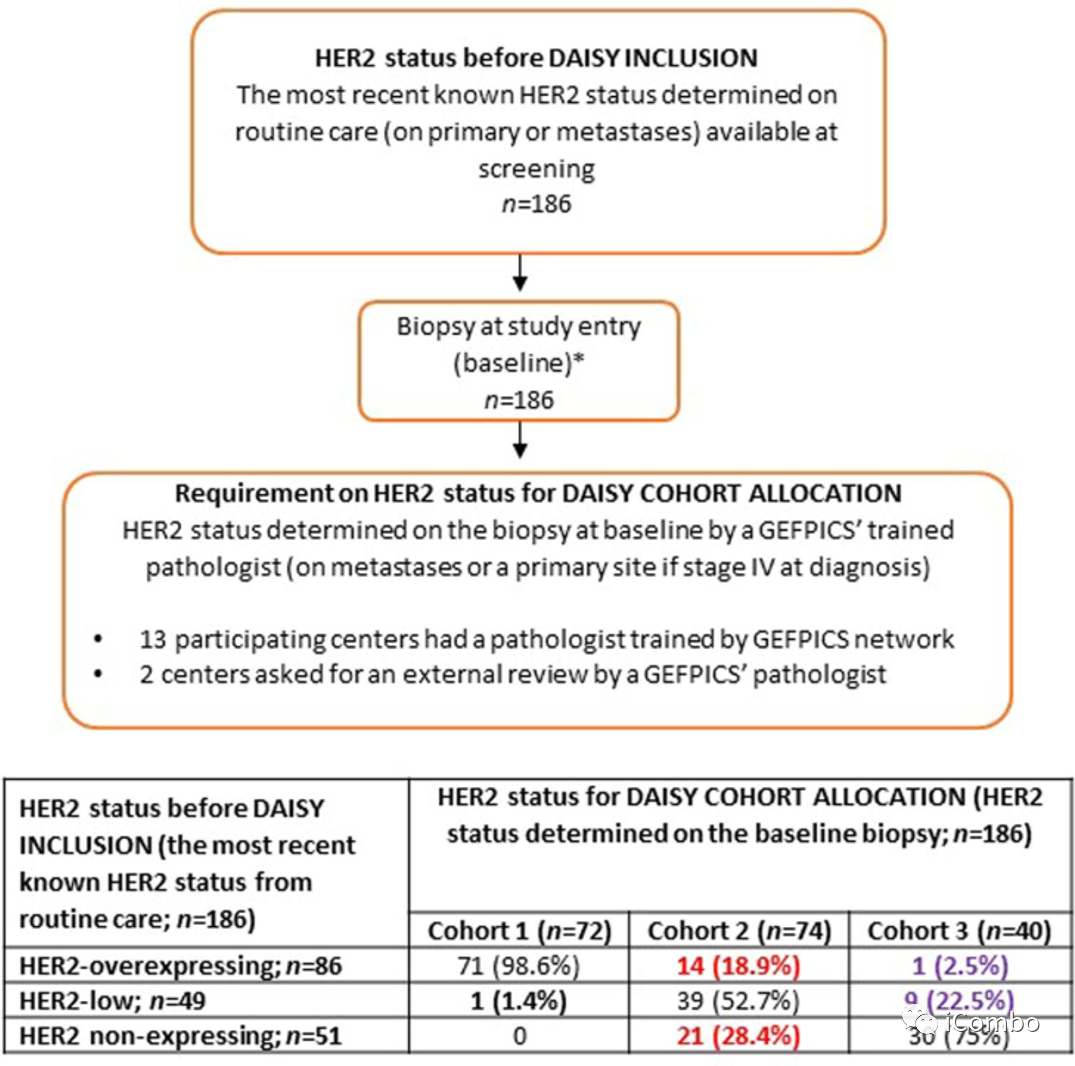
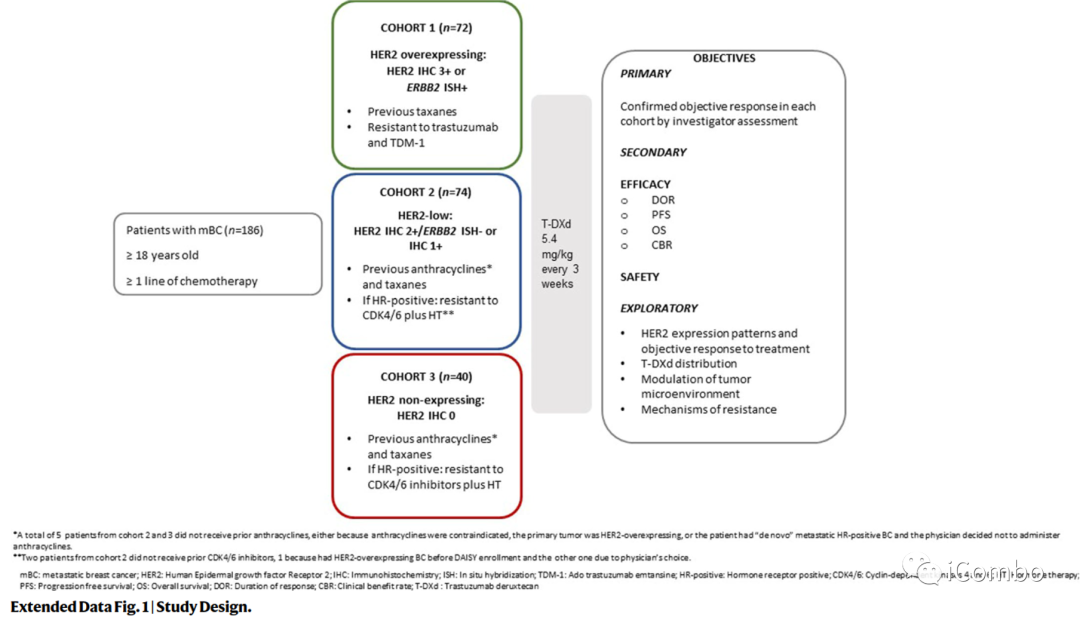
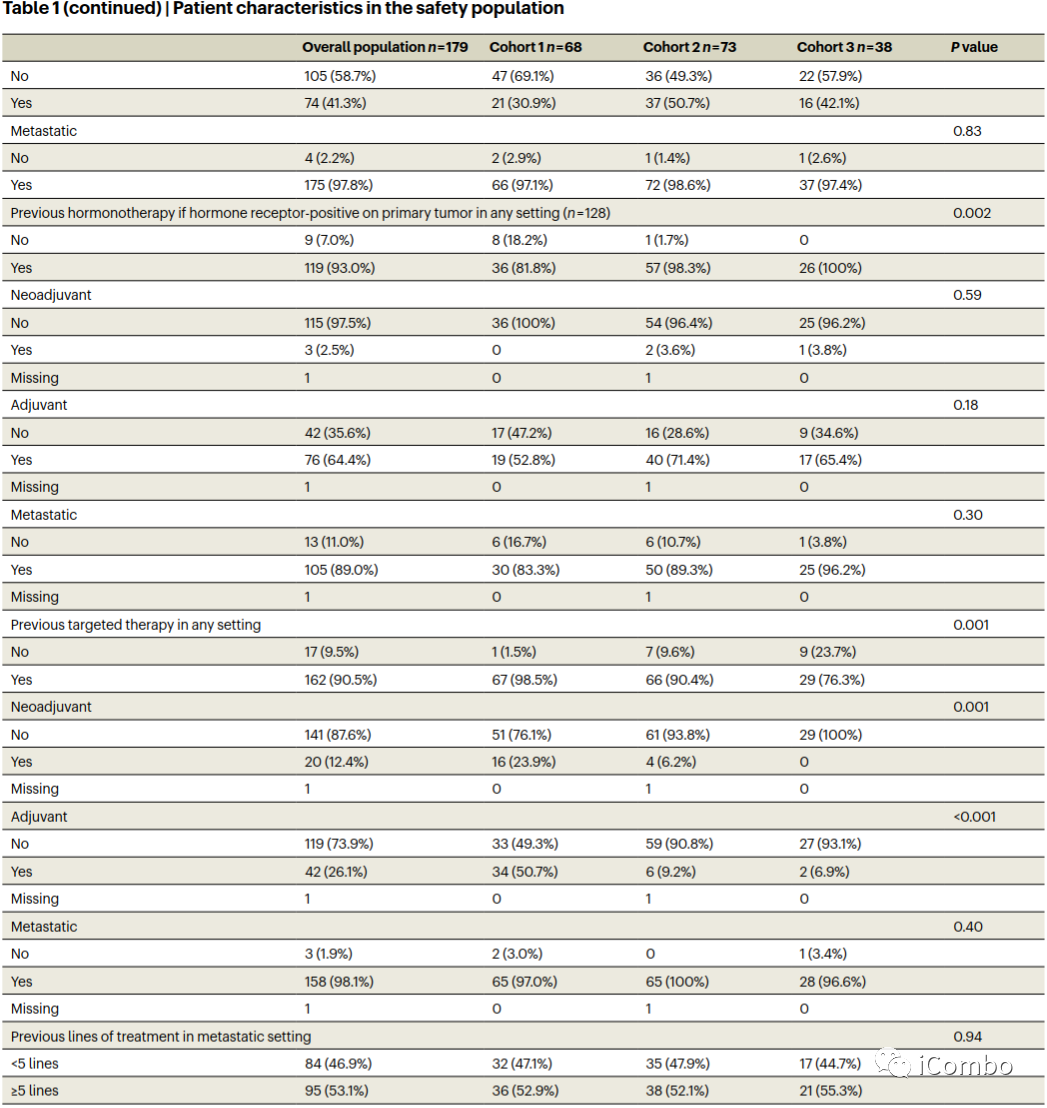
安全人群基线特征
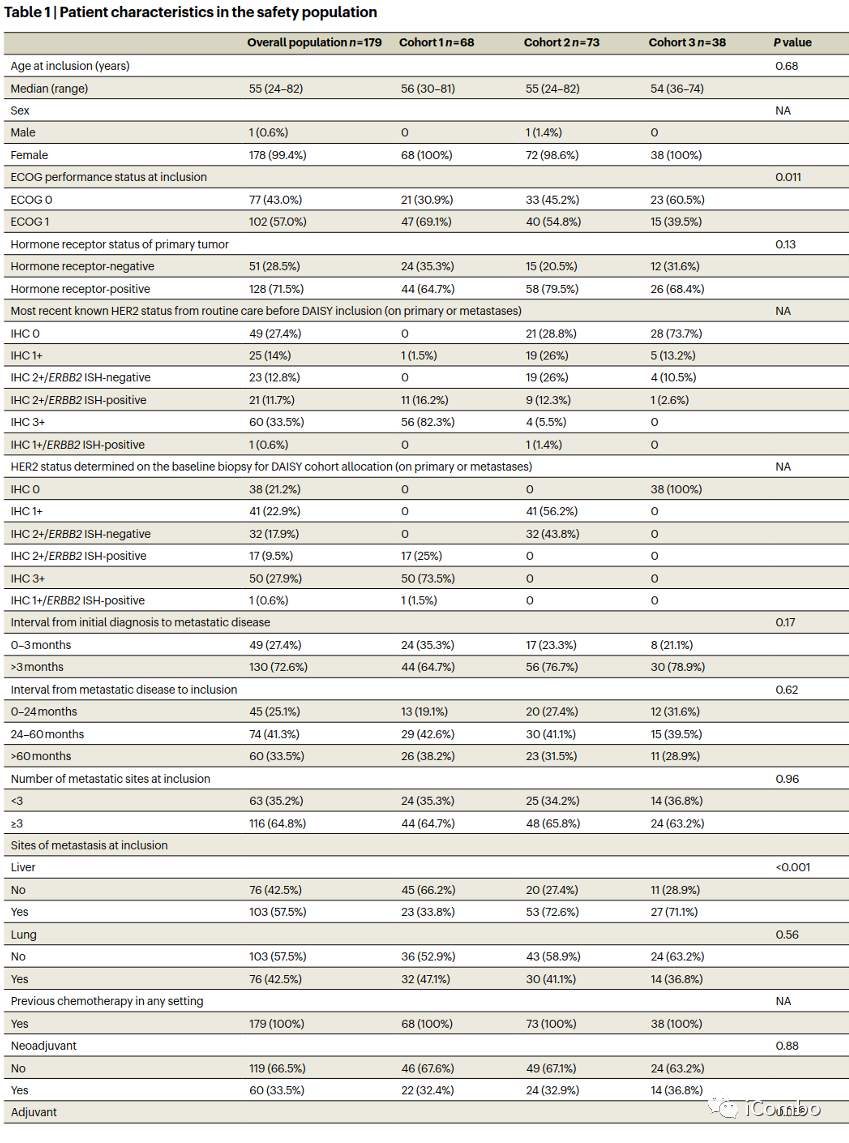
表1报告了安全人群(n=179)的基线患者特征。队列1中有44例(64.7%),队列2中有58例(79.5%),队列3中有26例(68.4%)为激素受体阳性原发性乳腺癌(3组间P=0.13)。大多数患者(53.1%)在转移情况下接受了≥5种既往多线治疗。队列2中有53例(72.6%)患者和队列3中有27例(71.1%)患者出现肝转移,而队列1中有23例(33.8%)患者出现肝转移(P<0.0001)。队列1中21例(30.9%),队列2中33例(45.2%),队列3中23例(60.5%)表现为东部肿瘤合作组(ECOG)0 (P=0.011)。先前的治疗暴露与乳腺癌的分子特征一致。除了转移部位和ECOG外,患者特征在队列中是平衡的。
研究结果
研究结果——主要终点
队列1、2、3的T-DXd中位治疗周期数分别为12.5(范围:2-31)、10(范围:1-29)和6(范围:1-26)
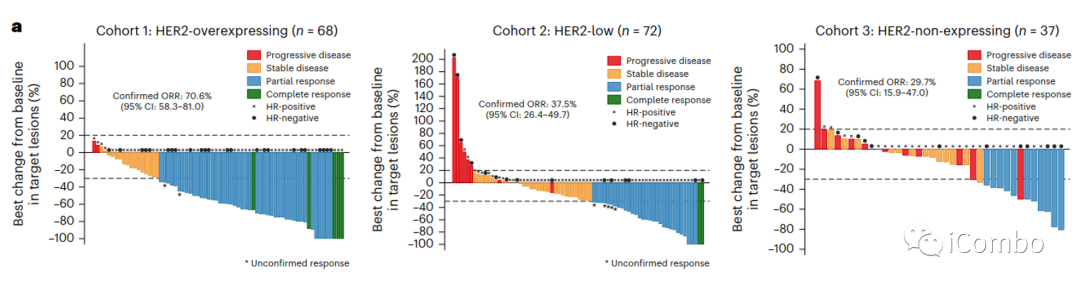
全分析集(FAS)共纳入177例患者,共86例(48.6%)患者发生经证实的客观缓解。队列1有48例患者(70.6%,95%CI 58.3-81)、队列2有27例患者(37.5%,95%CI 26.4-49.7)和队列3由11例患者(29.7%,95%CI 15.9-47)。
队列1、2和3的中位肿瘤缩小百分比分别为-57.2%、-25.3%和-12.5%(P < 0.0001)。
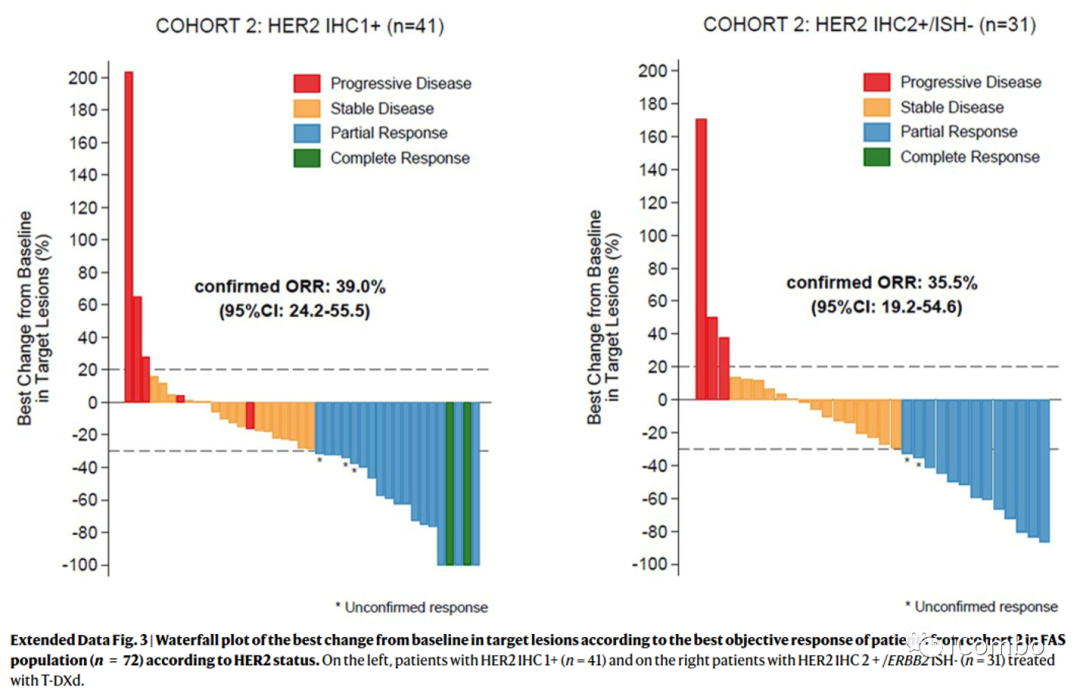
研究还评估了临床特征和ORR之间的相关性是否因队列而不同。在队列2中,入组筛选时存在≥3个转移灶是唯一与无应答显著相关的参数(P=0.018)。
基线活检HER2状态发生变化的患者的ORR情况:初始HER2过表达在基线活检后分配至队列2的14例患者中,6例获得ORR(42.9%,95%CI 17.7-71.1)。21例HER2不表达mBC患者,基线活检后分配至队列2的患者ORR为19%(95%CI 5.4-41.9,n=4/21)。HER2表达(过表达或低表达)基线活检后分配至队列3(IHC 0)的10例患者的ORR为40%(95%CI 12.2-73.8,n=4/10)。
研究结果——次要终点(DOR)
队列1的中位DOR为9.7个月(95%CI 6.8-13),队列2为7.6个月(95%CI 4.2-9.2),队列3为6.8个月(95%CI 2.8-未达到)。
研究结果——次要终点(PFS)
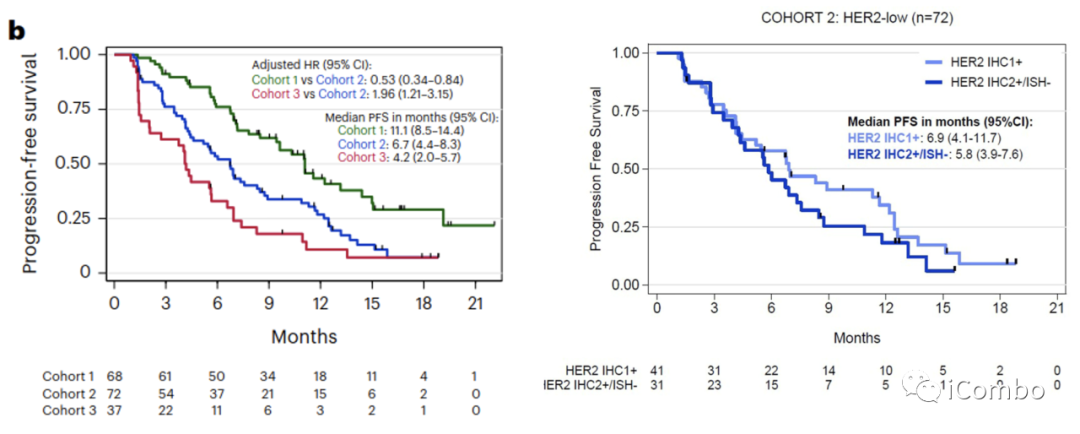
临床特征和PFS之间的相关性:
队列1中从诊断转移性疾病到纳入研究超过24个月的患者PFS更长(HR 24-60个月与0-24个月:0.35,95%CI 0.16–0.79;HR > 60个月与0-24个月: 0.24,95%CI 0.10–0.57;P=0.002)。
队列2中,筛选时存在≥3个转移灶时,PFS更短(HR:2.24,95%CI 1.27-3.93,P=0.004),存在HR表达时,PFS更长(HR:0.48,95%CI 0.26-0.92,P=0.022)。
队列3中,筛选时ECOG体能状态为1的患者PFS较短(HR:2.13,95%CI 1.02-4.44,P=0.037)。
研究结果——次要终点(OS)
中位随访14.1个月(95%CI 13.2–15.2)后,队列1的中位OS未达到(95%CI 16.7–未达到),队列2未达到(95%CI 11.5–未达到),队列3为11.6个月(95%CI 8.3–17.3)。
研究结果——次要终点(CBR)
临床获益率(CBR):队列1为85.3%(95% CI 74.6–92.7),队列2为56.9%(95% CI 44.7–68.6) ,队列3为 35.1%(95% CI 20.2–52.5)。
研究结果——次要终点(安全性)
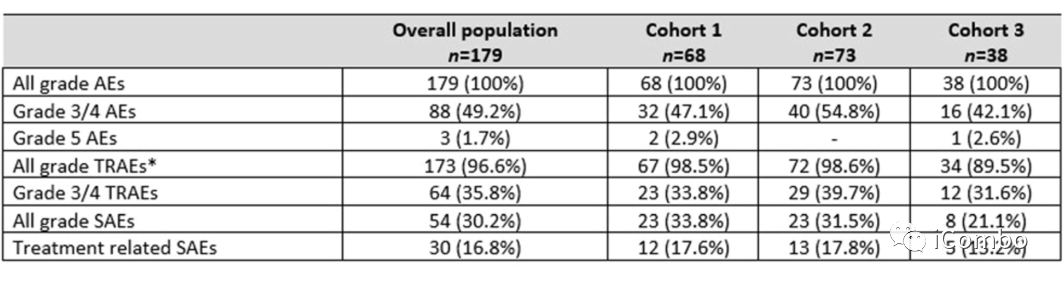
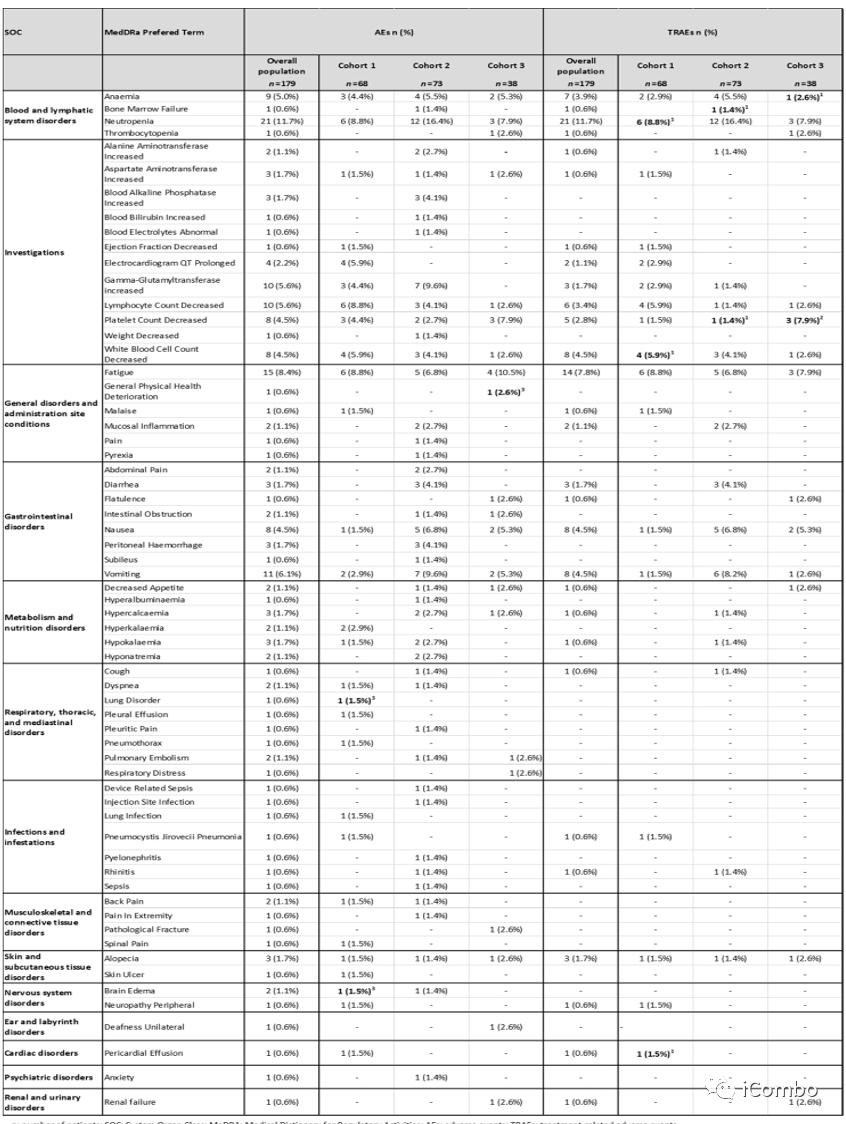
共有145例患者(81%)永久中止治疗:队列1有49例(72.1%),队列2有61例(83.6%),队列3有35例(92.1%),其中125例(86.2%)患者中止治疗的原因是疾病进展,13例(9%)是由于治疗毒性。最常见的≥3级不良反应为中性粒细胞减少症(12%)、疲乏(8%)和呕吐(6%),与TOP1抑制剂的毒性特征一致。9例患者(5%)出现间质性肺病或肺炎,均为1级或2级。3例患者(1.7%)出现射血分数降低(1例3级)。3例患者(1.7%)出现5级不良反应。
HER-2表达模式和治疗反应
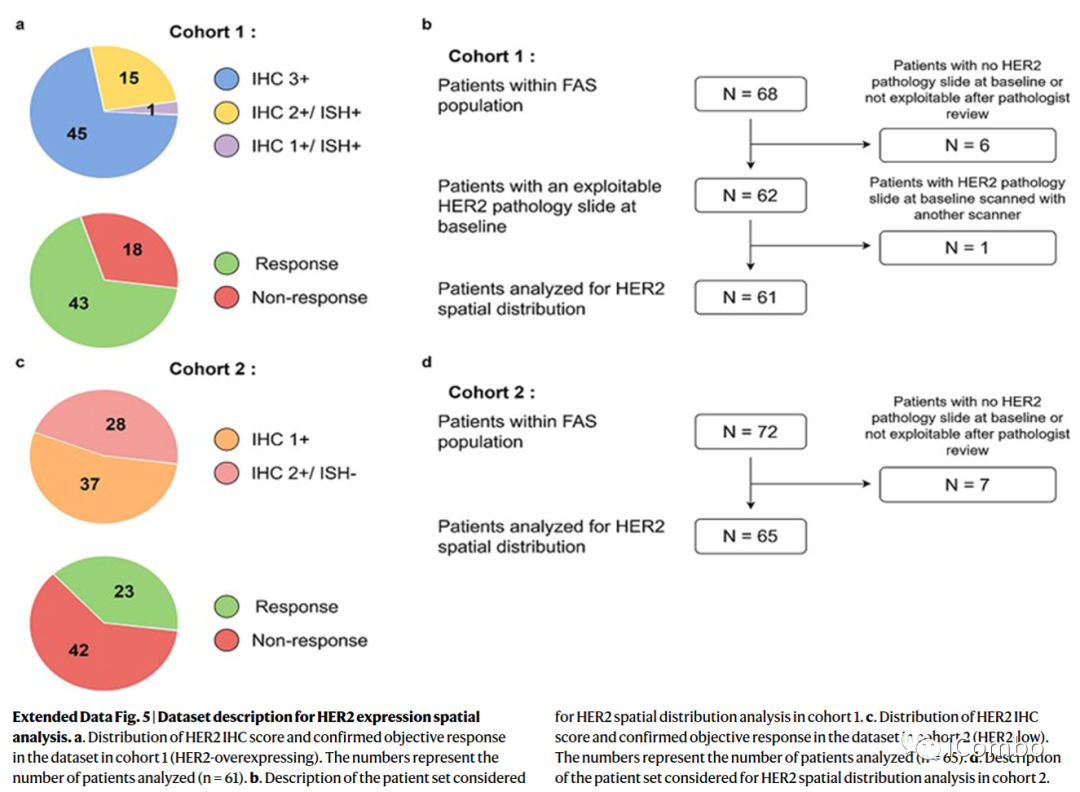
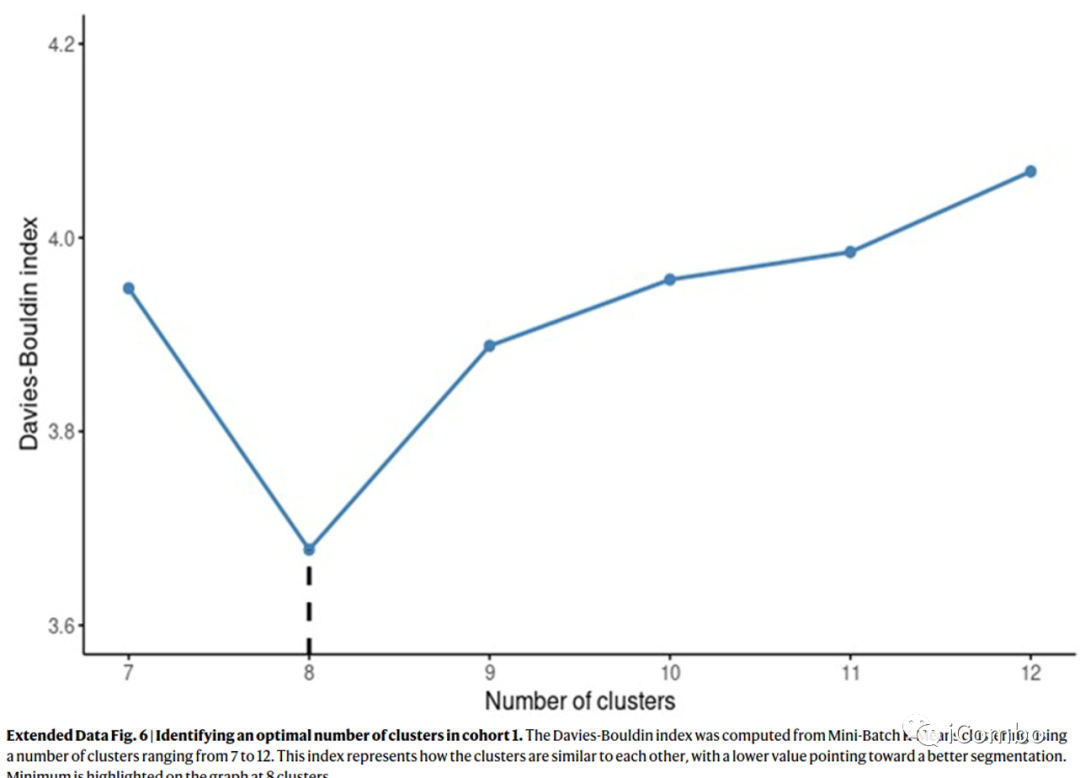
机器学习分析表明,使用无监督聚类算法将队列1中HER2切片分割成8个聚类。二氨基联苯胺(DAB)染色强度(HER2表达)和细胞密度是驱动无监督聚类的两个核心特征。
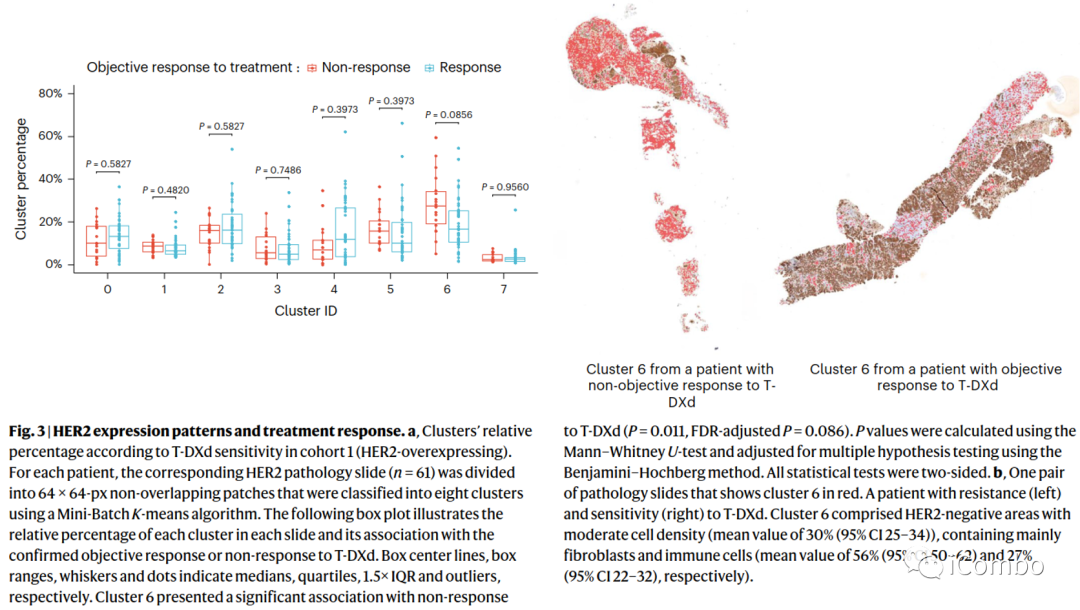
第6簇中无应答者的百分比更高(P=0.011),组间没有其他簇显示具有统计学意义的差异。第6簇的特征是低表达HER2染色(中位数,0.19;四分位数范围(IQR),0.10-0.47)和中等细胞密度(37%的斑块没有细胞,34%的斑块有一个细胞核)。第6簇斑块中存在的细胞主要是成纤维细胞和免疫细胞(平均值分别为56%(95% CI 50-62)和27%(95% CI 22-32)。
作者使用该模型分析了队列2、3,未观察到HER-2与T-DXd疗效有显著关联。
T-DXd的作用机制
研究者对基线和治疗期间获得的7对活检组织中T-DXd的分布做了进一步探索研究,HER2强表达肿瘤(n=4)呈现较强的T-DXd染色。相反,HER2 IHC 0样本(n=3)无T-DXd染色或T-DXd染色极少(Pearson相关系数r=0.75,P=0.053),这3例低水平T-DXd分布的患者中有2例证实部分缓解,PFS分别为17.8个月和12个月。
研究者评估了HER2表达水平是否可以预测队列3患者的药物反应(HER2 IHC 0,n=37),通过逆转录聚合酶链反应(RT-PCR)对基线获得的≥30%肿瘤细胞的24个肿瘤样本评价了ERBB2基因表达。研究发现ERBB2表达低于中位数的14例患者中有5例(35.7%,95%CI:12.8~64.9)出现经证实的客观缓解,而ERBB2表达高于中位数的10例患者中有3例(30%,95%CI:6.7~65.2)出现经证实的客观缓解。
队列3中31例患者基线活检时获得的HER2染色切片,在15份样本(8份“超低”和7份IHC 1+)中检测到一定水平的HER2表达;在15例可检测到HER2表达的患者中的6例(40%,95%CI:16.3~67.7)和16例未检测到HER2表达的患者中的4例(25%,95%CI:7.3~52.4)患者中观察到确认的客观缓解。
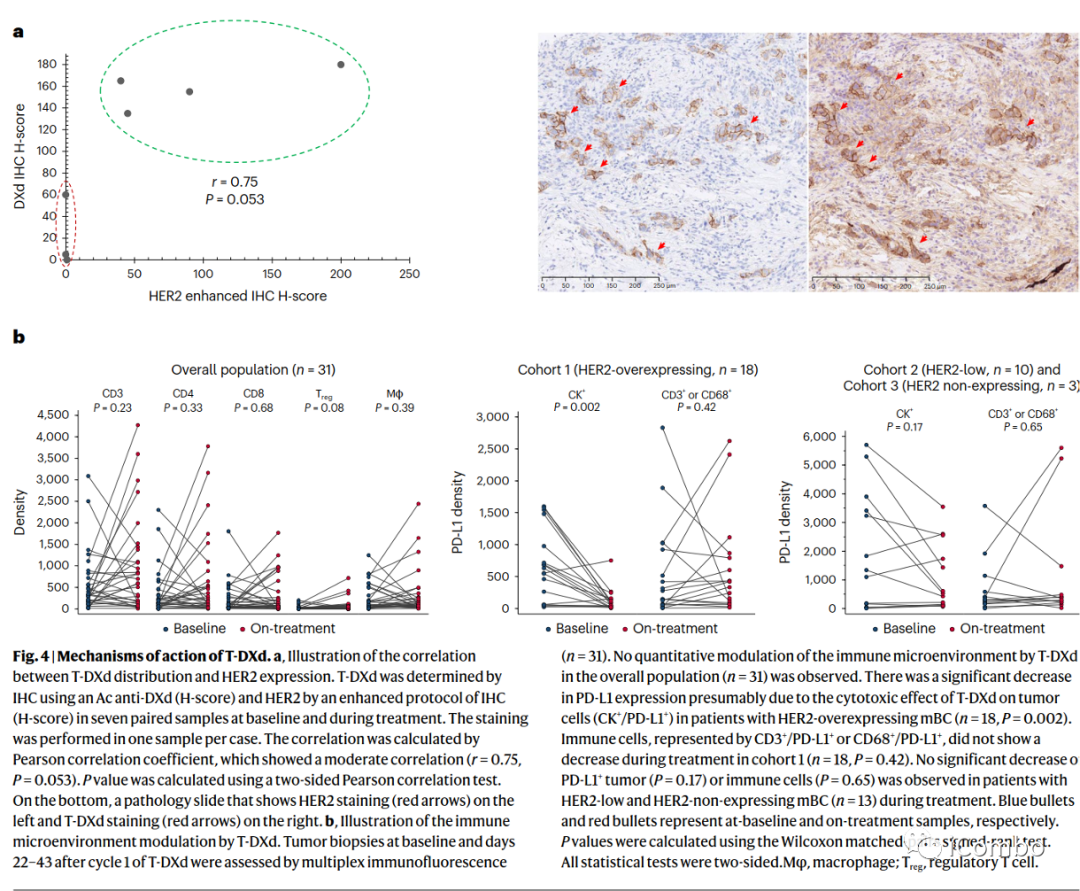
采用多重免疫荧光法评估基线和T-DXd第1周期后22-43天的肿瘤活检样本(n=31)。在整个人群(n=31)中未观察到T-DXd对免疫微环境的定量调节(图4b)。在队列1的患者中观察到PD-L1表达显著下降(n=18, P=0.002),可能是由于T-DXd对肿瘤细胞(PD-L1 +)的细胞毒性作用(图4b)。在队列1中也观察到肿瘤细胞近端巨噬细胞(0-10µm)的减少(n=18,P=0.0305)。在治疗期间,低HER2和不表达HER2的mBC患者(n=13)的PD-L1+肿瘤(P=0.17)和免疫细胞(P=0.65)均未见显著减少。
T-DXd的耐药机制
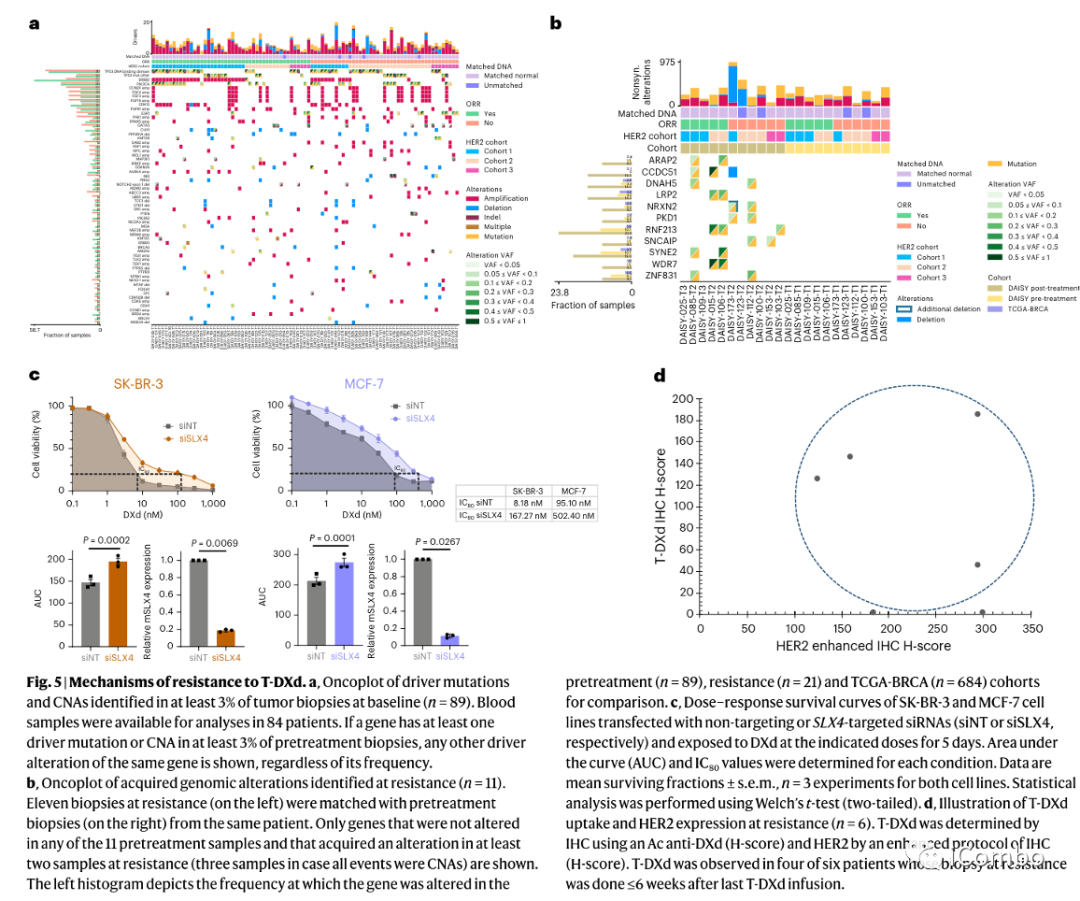
为了明确TDXd原发性和继发性耐药机制,作者对基线时获得的冷冻肿瘤组织进行了全外显子组测序(WES)(n=89:队列1、2、3分别为38例、37例、14例)和耐药时的冷冻肿瘤组织进行了全外显子组测序(WES) (n=21:队列1、2、3分别为 5例、11例、5例)。耐药时的11例活检与基线活检相匹配。
除了ERBB2扩增外,没有观察到驱动基因改变与前期耐药之间的显著相关性。基线时89例患者中有6例(7%)检测到ERBB2半合子缺失,其中有4人对T-DXd没有反应(队列2中有3人,队列3中有1人)。
在11对配对活检样本的基因组图谱分析发现至少2对出现了耐药性改变,21份T-DXd耐药样本中有3份(14%)出现SLX4突变:1份在基线样本中未观察到;第2份存在于基线活检中;第三个病例,基线活检组织不可用。
89例治疗前活检中有3例(3%)存在SLX4突变,癌症基因组图谱(TCGA)乳腺癌(BRCA)中有1.5%存在SLX4突变。作者评估了两种缺乏SLX4的乳腺癌细胞系的细胞活力,并用不同剂量的TDXd治疗5天。在SLX4沉默的SK-BR-3细胞中,达到80%抑制(IC80)所需的TDXd浓度增加了20倍(8.18nM对167.27nM),在SLX4沉默的MCF-7细胞中增加了5倍(95.1nM对502.4nM)。
20例患者中有13例(65%,95% CI 40.8-84.6)在耐药后出现HER2表达下降,其中3例为IHC 3+(2例为IHC 2+,1例为IHC 1+),6例为IHC 2+(3例为IHC 1+,3例为IHC 0),4例为IHC 1+至IHC 0。在队列1的6名耐药患者中,有4名患者(最后一次输注后6周内活检)观察到肿瘤内T-DXd的摄取,这表明T-DXd仍然可以在耐药患者亚群中分布到癌细胞中。
讨论
当HER2高表达时T-DXd的抗肿瘤活性增加,但在HER2 IHC 0患者中也观察到T-DXd具有一定的抗肿瘤活性。这表明HER2极低表达的肿瘤细胞同样能内吞T-DXd,并且也提示了T-DXd的疗效可能部分由不依赖于HER2的机制介导。IHC可能不能完全准确的预测HER2低表达乳腺癌患者对T-DXd治疗的疗效。
HER2 IHC 0和1+评分的一致性水平较低(26%),HER2 IHC 0病例中包括了大量具有一定HER2表达的肿瘤细胞,并且其中一部分患者对T-DXd治疗敏感,也强调了优化HER2检测的重要性。
在HER2非过表达的乳腺癌中,ERBB2 mRNA水平在患者之间变化很小,根据ERBB2基因表达水平来评估T-DXd的疗效可能并不必要。
DAISY试验的中位PFS(11.1个月)低于既往报告临床试验中T-DXd的疗效(DB02研究中报告的PFS 17.8个月,可能与入组患者接受更多线数治疗,ECOG评分更差有关。
T-DXd的安全性特征与既往报告相似。最常见的≥3级不良反应为中性粒细胞减少、疲乏和呕吐。大多数间质性肺病或肺炎和射血分数降低病例为轻度或中度,总体发生率与既往研究报告的发生率一致。
研究没有明显观察到T-DXd对免疫微环境的调控作用。
尽管在T-DXd耐药时观察到HER2表达显著降低,但在研究中没有强有力的证据表明T-DXd被肿瘤细胞内吞的减少是耐药发生的主要机制。
在21例患者中的3例(14%)发现了SLX4耐药突变。SLX4编码一种DNA修复蛋白,能够调节结构特异性核酸内切酶,可能在TOP1抑制剂耐药中发挥作用,但DAISY试验中发现的SLX4突变的性质仍有待确定。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#乳腺癌# #德曲妥珠单抗#
39
学习了,谢谢分享
36