【指南与共识】| 抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)
2023-09-28 中国癌症杂志 中国癌症杂志 发表于上海
本共识专家组以循证医学证据为基础、相关指南为依据,经充分讨论形成《抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)》。
[摘要] 头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,SCCHN)是最常见的一类头颈部肿瘤。由于早期症状不典型,大多数SCCHN患者确诊时已处于局部晚期。以标准剂量顺铂为基础的同期放化疗(chemoradiotherapy,CRT)是局部晚期SCCHN患者的标准非手术治疗模式。但同期CRT的近期和远期毒性问题不容忽视,对于无法耐受标准治疗强度的患者,在治疗策略的选择上要兼顾疗效、器官毒性和器官功能。几乎所有的SCCHN都会存在表皮生长因子受体(epidermal growth factor receptor,EGFR)过表达。抗EGFR单抗通过与EGFR结合,竞争性阻断内源性EGFR天然配体,阻碍EGFR二聚体的形成,抑制肿瘤细胞生长;此外,抗EGFR单抗可通过影响细胞周期、DNA损伤修复及血管生成等多种途径发挥放疗增敏作用。既往Ⅲ期临床研究表明,对比单纯放疗,放疗联合西妥昔单抗可显著改善局部晚期SCCHN患者的局部区域控制,延长总生存期。临床工作中合理地应用抗EGFR单抗仍面临诸多挑战,包括适用人群的判定标准、应用时机、联合方案的选择及不良事件管理等都需要进一步明确和规范。本共识专家组以循证医学证据为基础、相关指南为依据,经充分讨论形成《抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)》。根据本共识的专家建议,局部晚期SCCHN患者在同期CRT前,应评估患者对标准剂量顺铂治疗的耐受性和治疗毒性。对于无法耐受标准剂量顺铂治疗的患者,或在接受多西他赛+顺铂+5-氟尿嘧啶(TPF)方案诱导化疗后出现顺铂相关毒性的患者,可选择放疗联合西妥昔单抗方案。对于有降期或器官功能保留需求、拟行诱导治疗的患者,标准诱导治疗方案为TPF方案,不能耐受TPF方案毒性的患者,可用西妥昔单抗替代5-氟尿嘧啶,采用TPE方案。安全性方面,放疗联合西妥昔单抗相关常见不良反应包括痤疮样皮疹、口腔黏膜炎、放射性皮炎等,可以通过治疗前预防、治疗过程中早期识别和及时干预进行全面、分级管理。
[关键词] 抗EGFR单抗;局部晚期;头颈部鳞状细胞癌;临床共识
[Abstract] Squamous cell carcinoma of the head and neck (SCCHN) is the most common head and neck tumor. Patients are generally diagnosed with advanced stage attributed to no clinically evident symptom at the early stage. For locally advanced SCCHN, cisplatin-based concurrent chemoradiotherapy (CRT) is the standard non-surgical treatment. However, the tolerance to high-dose cisplatin is poor owing to the high prevalence of comorbidities in patients with SCCHN. There are also concerns on the acute and late toxicities of CRT. Epidermal growth factor receptor (EGFR) is proved to be overexpressed in most SCCHN and it is associated with resistance to cytotoxic agents and radiotherapy leading to poor prognosis. Anti-EGFR antibody, which competes with EGFR ligands, can lead to receptor internalization, antibody-receptor complex down-regulation and tumor death. In addition, anti-EGFR antibody can play a role in radiosensitization by affecting cell cycle, DNA damage repair and angiogenesis. Radiotherapy combined with anti-EGFR antibody was demonstrated to improve survival when compared to radiotherapy alone, while consensus on anti-EGFR antibody delivery in the eligible patients, optimal intervention time and the management of adverse effects when combined with radiotherapy are yet warranted. According to the current recommendations, all patients with locally advanced SCCHN should be assessed for the tolerance of standard dose cisplatin prior to CRT. Radiotherapy with cetuximab is an alternative for patients who cannot tolerate. For those who received induction chemotherapy with the purpose of tumor downstaging or organ preservation, the standard regimen is TPF (docetaxel+cisplatin+5-fluorouracil) scheme. TPE scheme, using cetuximab as a substitution for fluorouracil, is an option for toxicities reducing. Managements of skin reactions, oral mucositis and radiation dermatitis are proposed.
[Key words] Anti-EGFR monoclonal antibody; Locally advanced; Squamous cell carcinoma of the head and neck; Clinical consensus
《抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)》
专家组
顾 问
-
李宝生 | 山东第一医科大学附属肿瘤医院
组 长
-
胡超苏 | 复旦大学附属肿瘤医院
副组长
-
郭 晔 | 同济大学附属东方医院
-
陈晓钟 | 浙江省肿瘤医院
-
林少俊 | 福建省肿瘤医院
-
易俊林 | 中国医学科学院肿瘤医院
执笔人
-
许婷婷 | 复旦大学附属肿瘤医院
编 委
(以姓名汉语拼音字母为序)
-
白春梅 | 北京协和医院
-
董 频 | 上海交通大学医学院附属第一人民医院
-
冯 梅 | 四川省第三人民医院
-
高 劲 | 中国科学技术大学附属第一医院
-
韩 非 | 中山大学肿瘤防治中心
-
韩亚骞 | 湖南省肿瘤医院
-
何 侠 | 江苏省肿瘤医院
-
胡广原 | 华中科技大学同济医学院附属同济医院
-
李 光 | 中国医科大学附属第一医院
-
陆雪官 | 复旦大学附属肿瘤医院
-
任国欣 | 上海交通大学医学院附属第九人民医院
-
石 梅 | 空军军医大学西京医院
-
孙 艳 | 北京大学肿瘤医院
-
陶 磊 | 复旦大学附属眼耳鼻喉科医院
-
王佩国 | 天津医科大学肿瘤医院
-
王孝深 | 复旦大学附属眼耳鼻喉科医院
-
杨坤禹 | 华中科技大学同济医学院附属协和医院
-
张欣欣 | 解放军总医院第一医学中心
-
朱国培 | 上海交通大学医学院附属第九人民医院
-
朱小东 | 广西医科大学附属武鸣医院、广西医科大学附属肿瘤医院
1 概述
头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,SCCHN)起源于上皮细胞,常发生于口腔、咽部和喉部等部位[1]。除鼻咽癌外,大部分SCCHN的危险因素与吸烟及饮酒相关,部分口咽癌与人乳头状瘤病毒(human papilloma virus,HPV)感染相关[2]。据统计,2020年全世界范围内唇癌/口腔癌、喉癌、口咽癌和下咽癌的新发病例估计约74万例,死亡病例约36万例[3]。中国国家癌症中心2022年发布的数据显示,中国唇癌/口腔癌、喉癌、口咽癌和下咽癌的新发病例和死亡病例数分别约为7.8万例和4.0万例[4]。
由于病变部位隐蔽,早期症状不典型,大多数SCCHN患者在确诊时已处于局部晚期,单一的治疗手段无法获得令人满意的疗效,通常需要多学科的综合治疗模式[5]。对于无法行根治性手术或有器官功能保留需求的患者,目前的首选治疗是基于标准剂量顺铂的同期放化疗(chemoradiotherapy,CRT)。一项纳入19 805例非转移性SCCHN患者(其中约90%为Ⅲ期或Ⅳ 期)的meta分析[6]表明,同期CRT对比单纯放疗5和10年绝对生存获益分别为6.5%(33.6% vs 27.1%)和3.6%(20.9% vs 17.3%)。然而即便接受了规范治疗,仍有约一半的患者在初次治疗2年内发生复发和(或)转移[2]。另外,CRT相关的近期和远期毒性也不容忽视,在治疗前需要详细评估患者的耐受性,尤其是对于无法耐受标准剂量顺铂治疗的患者,在治疗策略的选择上要兼顾治疗效果、器官毒性和器官功能。
SCCHN中普遍存在表皮生长因子受体(epidermal growth factor receptor,EGFR)高表达,且与较差的生存预后相关[7]。临床前研究显示,EGFR高表达比低表达的肿瘤具有更强的放射抵抗性[8],加入抗EGFR单抗后可增加放疗的敏感性[9],考虑可能与放疗诱导的细胞凋亡增加有关。此外,抗EGFR单抗可通过影响细胞周期、DNA损伤修复及血管生成等多种途径发挥放疗增敏作用[9-12]。
临床上常用的抗EGFR单抗包括西妥昔单抗、尼妥珠单抗和帕尼单抗等。其中西妥昔单抗是人鼠嵌合型免疫球蛋白G1(immunoglobulin G1,IgG1)抗EGFR单抗,通过与细胞外EGFR特异性结合,竞争性阻断内源性EGFR天然配体,阻碍EGFR二聚体的形成,它还能够通过诱导EGFR内吞使受体数量下调,从而阻止肿瘤细胞内因EGFR激活引起下游相关信号转导通路的活化,抑制肿瘤细胞生长[13-15]。除对EGFR的直接阻断作用外,西妥昔单抗还可以通过抗体依赖的细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)[16]或促进T细胞的免疫活化等机制发挥抗肿瘤作用[17]。针对局部晚期SCCHN的Ⅲ期研究显示,对比单纯放疗,放疗联合西妥昔单抗可显著改善局部区域控制(locoregional control,LRC),延长总生存期(overall survival,OS)[18-19]。基于这些研究结果,西妥昔单抗在2004年和2006年分别获得欧洲药品管理局(European Medicines Agency,EMA)、美国食品药品管理局(Food and Drug Administration,FDA)的批准,用于与放疗联合治疗局部晚期SCCHN。2022年6月,西妥昔单抗联合放疗治疗局部晚期SCCHN适应证在中国获批[20],是目前唯一获批治疗SCCHN的抗EGFR单抗。尼妥珠单抗是人源型IgG1抗EGFR单抗[21],作用机制与西妥昔单抗类似,2008年在中国获批用于与放疗联合治疗EGFR表达阳性的Ⅲ~Ⅳ期鼻咽癌[22]。帕尼单抗是全人源的IgG2型抗EGFR单抗,ADCC效应较弱[23],在SCCHN中应用的注册临床试验未取得预期结果,因此目前无相关适应证。
西妥昔单抗与放疗联合的方案为国内局部晚期SCCHN患者提供了有效、低毒的治疗选择。然而,如何在临床工作中合理应用抗EGFR单抗仍面临挑战,包括抗EGFR单抗适用人群的判定标准、应用时机、联合方案的选择及不良事件管理等都需要进一步明确和规范。本共识小组以循证医学证据为基础、相关指南为依据,经充分讨论形成《抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)》,旨在帮助临床医师合理规范应用抗EGFR单抗治疗局部晚期SCCHN患者,使患者的获益最大化。
2 局部晚期SCCHN多学科综合治疗模式
《中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南(2022年版)》[5]建议局部晚期SCCHN患者采用多学科综合治疗模式。如患者适宜手术,可接受手术治疗并根据术后病理学检查结果决定术后辅助放疗或同期CRT。如患者不适宜手术(包括具有严重合并症、自身原因拒绝手术、肿瘤负荷大预计无法完整切除、手术可能造成重要功能缺失等),可选择同期CRT。放疗联合标准剂量顺铂是目前推荐的同期CRT方案。对于不适宜使用顺铂,即无法耐受标准剂量顺铂治疗的人群,可选择单纯放疗或放疗联合西妥昔单抗治疗。
3 无法耐受标准剂量顺铂治疗的参考判定标准
以顺铂为基础的同期CRT是局部晚期SCCHN首选的非手术治疗策略,其中顺铂在放疗同步期间(100 mg/m2,每3周1次)的累积剂量显著影响预后,一般认为总的累积剂量达到200 mg/m2是有效剂量[24-26],但受急性和远期毒性的影响,并非所有患者都能耐受这一强度的治疗[27],治疗相关毒性对长期生存患者生活质量的影响值得重视。一项回顾性研究[28]分析了局部晚期SCCHN患者接受CRT的有效性和安全性,发现与接受单纯放疗的患者(n=73)相比,接受同期CRT的患者(n=90)不良反应发生率显著增加,主要包括2~3级口腔干燥(92.2% vs 37.0%)、3级黏膜炎(74.5% vs 50.7%)、3级吞咽困难(82.2% vs 47.9%)和3级疼痛(28.9% vs 9.6%)等。同样,对于三项美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)研究的合并亚组分析[29]显示,在230例可评估的使用顺铂为基础的同期CRT患者中,99例(43%)患者发生严重的远期毒性。
为降低同期CRT的毒性,有研究曾尝试采用每周1次顺铂方案代替每3周1次顺铂方案。在印度的非劣效性Ⅲ期随机对照研究[30]中,顺铂30 mg/m2单周方案组(n=150)的估计2年LRC率显著低于标准的3周方案组(顺铂100 mg/m2,每3周1次;n=150)(58.5% vs 73.1%,P=0.014)。另一项印度研究[31]发现,单周剂量提高到40 mg/m2后2年LRC率可获得与3周方案(顺铂100 mg/m2,每3周1次)类似的结果(52.6% vs 47.4%)。然而,由于该研究中患者所接受的放疗技术比较落后,70%以上均为钴-60照射,因此该研究的证据级别仍值得商榷。
考虑到顺铂(100 mg/m2)每3周用药仍为标准方案,而药物剂量和频率的调整可能削减疗效,因此在局部晚期SCCHN患者接受同期CRT前,建议对患者进行顺铂治疗的耐受性和治疗毒性的评估,尽早识别不宜使用标准剂量顺铂治疗的患者,进而使临床决策更加合理。2016年由亚太地区头颈部肿瘤专家讨论形成的共识意见[32]对不宜使用顺铂治疗的人群进行了定义。参考该意见,本共识专家组经讨论认为,如果患者存在以下情况则为不宜使用标准剂量顺铂治疗的人群:① 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状态(performance status,PS)评分≥2;② 肾功能不全,内生肌酐清除率(creatinine clearance,Ccr)值<50 mL/min;③ ≥2级神经病变或听力损伤/耳鸣;④ 心功能不全,纽约心脏病协会(New York Heart Association,NYHA)心功能分级≥Ⅱ级;⑤ 对铂类药物过敏。此外,对于存在以下任意一项高危因素的患者,建议使用顺铂治疗时需谨慎:① 年龄>70岁;② ECOG PS评分 ≥1;③ 患者主观整体评估法(Patient-Generated Subjective Global Assessment,PG-SGA)评分≥3分;④ 肾功能不全,Ccr值为50~60 mL/min;⑤ 1级神经病变或听力损伤/耳鸣;⑥ 心功能不全,NYHA心功能分级Ⅰ级,左心室射血分数(left ventricular ejection fraction,LVEF)≤50%;⑦ 人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染和获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)CD4+T淋巴细胞计数<200个/μL;⑧ 既往铂类(包括诱导化疗)药物治疗(累积剂量≥200 mg/m2)。尤其对于存在≥2条上述高危因素的患者应考虑避免使用标准剂量顺铂治疗(表1)。
专家意见 1:建议在CRT前评估患者对标准剂量顺铂治疗的耐受性和治疗毒性。不宜使用标准剂量顺铂治疗的人群为:ECOG评分≥2;Ccr<50 mL/min;存在≥2级神经病变或听力损伤/耳鸣;NYHA心功能分级≥Ⅱ级;对铂类药物过敏。对于存在≥2条高危因素的患者也应避免使用标准剂量顺铂治疗。

4 抗EGFR单抗联合放疗/同步CRT治疗局部晚期SCCHN
Bonner等[18]的随机Ⅲ期临床研究对比了Ⅲ、Ⅳ期[1998年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期系统]SCCHN患者(口咽癌、喉癌和下咽癌)接受放疗联合西妥昔单抗(n=211)及单纯放疗(n=213)的疗效,发现放疗联合西妥昔单抗可显著改善中位LRC时间(24.4个月 vs 14.9个月,P=0.005),并延长患者中位OS(49.0个月 vs 29.3个月,P=0.030)。长期随访[19]发现,放疗联合西妥昔单抗组患者的生存率更高,两组患者5年OS率分别为45.6%和36.4%,安全性方面,放疗联合西妥昔单抗的毒性可控,并未明显增加口腔黏膜炎、放射性皮炎和吞咽困难等的发生率及持续时间,患者依从性较高,未对患者生活质量造成不良影响,并且在接受西妥昔单抗治疗的患者中,出现≥2级皮疹者的OS显著优于未出现皮疹或1级皮疹者(P=0.002)。
一项基于美国国立癌症研究所旗下的监测、流行病学和最终结果(Surveillance,Epidemiology,and End Results,SEER)数据库的回顾性研究[33],在1 335例接受放疗的局部晚期SCCHN患者中,比较了放疗期间同步使用高剂量顺铂(≥200 mg/m2,n=264)、低剂量顺铂(30~40 mg/m2或更低,n=259)或卡铂(n=353)的生存结果,发现低剂量顺铂及卡铂组患者的OS均劣于高剂量顺铂组。日本的回顾性研究[34]在不适合顺铂治疗的局部晚期SCCHN患者中,比较了放疗联合卡铂(n=29)或放疗联合西妥昔单抗(n=18)的疗效和安全性,结果显示,卡铂和西妥昔单抗组的3年LRC率分别为56%和58%(P=0.740),中位OS分别为91.9和35.5个月(P=0.380),差异均无统计学意义,但卡铂联合放疗组3~4级血液学毒性发生率更高(中性粒细胞减少34%,贫血28%,血小板减少28%),而西妥昔单抗组仅发生1例贫血。
CONCERT-2试验[35]是一项多中心随机(2∶3)对照Ⅱ期研究,在151例接受治疗的Ⅲ~Ⅳb期SCCHN患者中,对比放疗联合标准剂量顺铂(100 mg/m2,每3周1次)(n=61)和放疗联合帕尼单抗(n=90)的疗效和安全性。结果显示,两组2年LRC率差异无统计学意义(61% vs 51%,P=0.06),最常见的3~4级不良事件发生率在放疗联合标准剂量顺铂组为40%,放疗联合帕尼单抗组为42%,两组的严重不良反应发生率分别为40%和34%,提示帕尼单抗联合放疗相比放疗联合标准剂量顺铂并不能带来更多获益。
对于经评估不考虑使用标准剂量顺铂治疗的患者,可以选择放疗联合西妥昔单抗或卡铂作为替代方案。
HPV阳性口咽癌是预后较好的口咽癌亚型[36],有研究尝试予以低强度治疗来减轻毒性,提高患者长期生活质量。其中在根治性放疗中替代高剂量顺铂化疗是研究方向之一,如采用西妥昔单抗替代高剂量顺铂与放疗联合用于HPV阳性口咽癌。然而,相关研究并未达到预期终点。RTOG 1016[37]是一项随机、多中心、非劣效研究,纳入了805例HPV阳性的口咽癌患者,旨在证明放疗联合西妥昔单抗(n=399)与放疗联合顺铂(n=406)相比,能否在减少毒性的同时不降低疗效,中位随访4.5年,放疗联合西妥昔单抗未能达到预设的非劣效界值[风险比(hazard ratio,HR)=1.45,非劣效标准为HR=1.4]。另一项放疗联合顺铂或西妥昔单抗治疗低危HPV阳性口咽癌患者(De-ESCALaTE HPV)的研究[38]也获得了类似结论,即接受标准同期CRT(顺铂100 mg/m2,每3周1次)治疗的患者中位OS和无进展生存期(progression-free survival,PFS)均优于放疗联合西妥昔单抗的患者。在Trans-Tasman放射肿瘤学组(Trans-Tasman Radiation Oncology Group,TROG)的一项研究(TROG 12.01)[39]中,每周1次顺铂(40 mg/m2)同步放疗的效果仍然优于西妥昔单抗联合放疗。进一步分析CD103表达水平与HPV阳性口咽癌患者预后相关性的研究[40]表明,在接受西妥昔单抗联合放疗(n=145)的患者中, CD103高表达组(≥30%,n=44)组的3年无失败生存率(failure-free survival,FFS)显著高于CD103低表达组(<30%,n=101)(92% vs 74%,P<0.001),3年OS率(100% vs 86%,P<0.001)也更高;而在接受顺铂联合放疗的患者(n=144)中,未发现CD103表达水平与预后的相关性。因此,在CD103高表达的HPV阳性口咽癌患者中抗EGFR靶向治疗的价值有待进一步探索。目前尚无HPV阴性口咽癌的大样本研究,因此治疗方面同SCCHN。
HPV阳性口咽癌根治性放疗期间尚无证据显示可以用抗EGFR单抗替代标准剂量顺铂。
此外,也有一些Ⅲ期随机对照研究旨在探索在同期CRT的基础上加用抗EGFR单抗可使患者获益。RTOG-0522研究[41]纳入895例局部晚期SCCHN患者(T2N2-3M0或T3-4,任何N,M0),随机接受同期CRT(加速分割放疗:72 Gy/42次,6周完成,其中第1~12天为每天2次照射;顺铂100 mg/m2,第1、22天)或在CRT基础上联合西妥昔单抗治疗,两组完成2个周期顺铂的比例均超过90%,但西妥昔单抗组无生存优势[两组患者的3年PFS率(61.2% vs 58.9%;P=0.76)、3年OS率(72.9% vs 75.8%;P=0.32)差异均无统计学意义],且联合西妥昔单抗显著增加了3 ~ 4级口腔黏膜炎(43% vs 33%,P=0.002)和照射野内皮炎(25% vs 15%,P<0.001)的发生率。该研究进一步分析发现,KRAS突变患者能够从联合西妥昔单抗的治疗中获益,第1年PFS (HR=0.31,95% CI:0.10~0.94,P=0.040)和1~2年OS率(HR = 0.19,95% CI:0.04 ~ 0.86, P=0.030)均有改善 [42]。国内一项针对T4b期下咽癌的小样本回顾性研究 [43]的多因素分析显示,使用抗EGFR单抗治疗的患者OS更优,但是该组患者治疗的异质性较大,结论还有待前瞻性研究的证实。一项印度的Ⅲ期随机研究 [44]表明,与放疗同步顺铂30 mg/m2的周方案相比,在CRT基础上联合尼妥珠单抗组的PFS有所改善(HR=0.69,95% CI:0.53~0.89,P=0.004),但OS差异无统计学意义(HR=0.84,95% CI:0.65~1.08,P=0.163),而尼妥珠单抗组的黏膜炎发生率更高(66.7% vs 55.8%,P=0.010),但该研究采用了非标准剂量的顺铂同步化疗作为对照,因而CRT组3年PFS率仅为45.8%,明显低于以往的对照研究,因此解读研究结果需要谨慎。一项Ⅱ期随机研究(CONCERT-1)[45]同样尝试在CRT(顺铂100 mg/m2,每3周1次)基础上联合帕尼单抗治疗局部晚期SCCHN,结果显示,2年LRC率未见明显提高(68% vs 61%),且帕尼单抗的加入增加了毒性。基于上述研究结果,不常规推荐同期CRT期间联合抗EGFR单抗治疗。
放疗联合西妥昔单抗可作为经诱导化疗后出现顺铂相关毒性患者的治疗选择。由于多西他赛+顺铂+5-氟尿嘧啶(TPF)诱导化疗方案可能引起严重不良反应,后续再进行联合顺铂的同期CRT可能会导致顺铂毒性累积,因此部分研究探讨了诱导化疗后的根治方案的优化。《中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南(2022年版)》[5]指出,考虑到顺铂的累积毒性,在使用以顺铂为基础的诱导治疗后,不推荐再使用标准剂量顺铂的同期化疗方案。意大利的一项研究[46]显示,在同步治疗(CRT或放疗联合西妥昔单抗)前加用TPF诱导化疗可以改善患者生存情况,包括和不包括诱导化疗组患者的中位OS分别为54.7和31.7个月(P=0.031),中位PFS分别为30.5和18.5个月(P=0.013)。亚组分析显示,诱导化疗后同步联合西妥昔单抗获益趋势更大,推测西妥昔单抗可能对经铂类药物诱导化疗后残留的耐药肿瘤细胞具有更好的增敏作用[46]。另一项研究[47]在153例初治Ⅲ或 Ⅳ期喉癌/下咽癌患者中比较了TPF诱导化疗后放疗同期联合顺铂和放疗同期联合西妥昔单抗的疗效和安全性。结果发现,两组3个月时的保喉率相近,分别为93%和95%。该研究的长期随访结果表明,两组的5年OS率差异无统计学意义(66.6% vs 66.9%,P=0.900),但放疗同期联合西妥昔单抗组患者有更好的耐受性和手术挽救成功率(最后1次评估时,放疗联合西妥昔单抗组局部复发后手术成功的患者有6例,而顺铂组为0例)[48]。
因此,经诱导治疗后,如肿瘤达到完全或部分缓解,后续可选择单纯放疗或放疗联合西妥昔单抗治疗,如未达到可考虑手术治疗。
专家意见2:放疗同步联合标准剂量顺铂是包括HPV阳性口咽癌在内的标准非手术治疗。CRT联合抗EGFR单抗不作为常规推荐。对于无法耐受标准剂量顺铂的患者,或在接受TPF诱导化疗后出现顺铂相关毒性的患者,可选择放疗联合西妥昔单抗方案。
5 抗EGFR单抗在含诱导治疗的综合治疗中的应用
欧洲癌症治疗与研究组织(European Organization for Research and Treatment of Cancer,EORTC)24971(TAX 323)和TAX 324研究[49-50]确立了TPF方案成为局部晚期SCCHN的标准诱导化疗方案,但TPF诱导化疗并未在CRT基础上进一步改善生存。Haddad等[51]的研究显示,TPF方案序贯CRT对比单纯CRT未提高OS率,且诱导化疗组中性粒细胞缺乏伴发热的患者更多。之后另两项类似的Ⅲ期研究[52-53]也未能证实诱导化疗在局部晚期SCCHN中的价值,且TPF三药联合方案的毒性如骨髓抑制、胃肠道反应等需引起关注。
但诱导治疗在缩瘤、降期及保喉方面的优势得到多项早期研究[26,54-57]的证实,且TPF方案比PF方案在患者生存方面更有优势[49-50]。在RTOG 91-11研究[57]中,诱导化疗联合放疗(诱导化疗组,n=173)与同步CRT(CRT组,n=172)均较单纯放疗(单纯放疗组,n=173)显著改善无喉切除生存率,而诱导化疗组和CRT组间OS差异无统计学意义,但长期随访发现CRT组非癌症相关的死亡率高于诱导化疗组(10年时分别为69.8%和52.8%,P=0.030)。因此,尽管同期CRT仍是局部晚期SCCHN的标准非手术治疗手段,但其远期毒性也需要引起关注,诱导治疗在综合治疗中的意义仍然值得肯定,尤其是通过优化诱导治疗方案来降低毒性、提高缓解率是研究的重点。
2010年,美国匹兹堡大学的一项小样本研究[58]在诱导化疗方案(多西他赛+顺铂)中加入西妥昔单抗(TPE方案),发现患者可获得长期生存和良好的安全性。后续多项研究陆续证实含西妥昔单抗的诱导治疗方案对于局部晚期SCCHN患者是一种有效且毒性较低的方案。一项德国研究[59]在起初入组的Ⅲ/Ⅳ期喉咽癌患者中比较了TPF±西妥昔单抗诱导方案,希望获得更好的诱导应答率,从而增加保喉患者的比例,研究过程中因毒性问题(64例患者中出现4例治疗相关死亡)而更改方案,后续112例入组患者不再接受5-氟尿嘧啶治疗,方案调整为TP对比TPE,显示两种方案的无喉切除生存率和OS率相似,但TPE方案毒性更低,诱导治疗相关死亡更少。奥地利的一项头对头比较研究[60]结果表明,TPE与TPF方案3个月的客观缓解率差异无统计学意义(74.5% vs 63.3%,P=0.109),治疗400 d后的OS率(86.1% vs 78.5%)和PFS率(70.0% vs 66.5%)接近,TPE组严重不良反应发生率低,证实了在诱导治疗中用西妥昔单抗代替5-氟尿嘧啶的可行性。
因此,在诱导治疗中,对于无法耐受5-氟尿嘧啶毒性的患者,可用西妥昔单抗代替5-氟尿嘧啶,选择TPE作为诱导治疗方案。
专家意见3:对于拟行诱导治疗的局部晚期SCCHN患者,目前的标准诱导方案为TPF,在无法耐受5-氟尿嘧啶毒性的患者中,TPE也是可选择的诱导治疗方案。
6 放疗联合抗EGFR单抗治疗相关不良反应的管理
早期预防、早期识别和及时干预是管理不良反应的总体原则。早期预防应在开始治疗之前进行,以患者宣教和治疗前评估为主,引导患者对不良反应建立正确的认知和有效防护的意识。早期识别要求医师和患者在治疗过程中主动监测相关反应,并进行鉴别诊断,如确认则要及时干预,实施个体化治疗。
6.1 痤疮样皮疹
研究[61-62]发现,应用西妥昔单抗治疗后,超过80%的患者会出现特征性皮肤不良反应,如痤疮样皮疹、甲沟炎、皮肤干燥和瘙痒、黏膜炎等。其中,痤疮样皮疹最为常见,发生率为60%~80%,大多数表现较轻[62]。痤疮样皮疹可在开始治疗后2 d~6周内出现,停止治疗1个月后消退。痤疮样皮疹主要表现为红色毛囊性丘疹和脓疱,应注意与普通痤疮鉴别。治疗前的风险评估包括患者是否存在任何暴露于抗EGFR治疗后可能恶化的先前存在的皮肤病,如牛皮癣、粉刺、红斑痤疮、特应性皮炎、严重干燥症、鱼鳞病和湿疹。主动干预包括:避免穿紧身鞋和衣服;避免直接暴露在阳光下;避免接触可能导致皮肤干燥的产品(如烫水、含乙醇的化妆品);避免胡须过长,定期剃须,事先涂抹剃须膏,之后使用润肤剂和保湿须后水;用洁面乳和温水卸妆;正确剪指甲等。
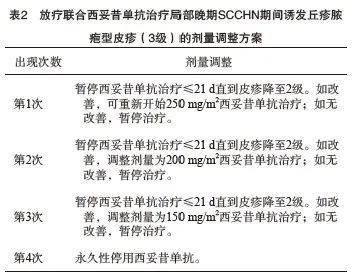
根据皮疹严重度分级进行针对性治疗及调整西妥昔单抗治疗剂量:① 1级皮疹[<10%体表面积(body surface area,BSA),伴或不伴瘙痒和触痛]无需调整药物剂量或停药,可不予处理或局部外用红霉素软膏等抗生素类药物。② 2级皮疹(10%~30%BSA,伴或不伴瘙痒和触痛;或丘疹/脓疱累及范围>30%BSA,但症状轻微者)无需调整药物剂量或停药,可局部外用抗生素、1~2周中效糖皮质激素等药物,直到皮疹消退至1级,如病变以丘疹为主时无需全身治疗,如以脓疱为主时可服用米诺环素100 mg/d,多西环素100 mg/d,连续服药≥4周,直至症状消退,脓疱皮疹消退同时皮疹消退至1级可以恢复西妥昔单抗治疗。③ 3~4级皮疹(3级:丘疹/脓疱累及范围>30%BSA,且伴中到重度症状;4级:危及生命)需暂停西妥昔单抗治疗,同2级皮疹进行针对性治疗,待皮疹改善至2级可重新开始西妥昔单抗治疗(250 mg/m2),如果皮疹再次出现,则相应将西妥昔单抗剂量减量50 mg/m2,第3次出现3级以上皮疹,需等待恢复至2级,西妥昔单抗剂量再减量50 mg/m2,如果皮疹仍反复出现,则需永久停用西妥昔单抗,推荐剂量调整方案见表2[62-64]。④ 4级皮疹需永久停用靶向治疗药物,收治入院,进行皮损处病原生物学培养并开始系统性使用抗生素±糖皮质激素治疗[62-64]。
6.2 口腔黏膜炎
口腔黏膜炎是放疗相关的常见急性毒性反应。在接受放疗的头颈癌患者中,口腔黏膜炎的发生率在80%以上[65-66],其中在接受同期CRT的患者中发生率更高[65]。传统放疗技术联合西妥昔单抗并不显著增加口腔黏膜炎的发生率[18],而接受调强放疗时,暴露于低剂量照射的正常口腔黏膜范围扩大,联合抗EGFR单抗可能增加黏膜对低剂量放射线的敏感性。
放疗前应做好患者宣教工作,加强患者对CRT不良反应的认知,指导其做好相关不良反应的心理准备,在治疗前和治疗中做好皮肤和口腔等护理工作。建议每天检查口腔黏膜,及时消除可引起损伤的隐患,如不合适的义齿等。多饮水或使用人工唾液保持口腔湿润,可短期使用唇膏滋润口唇。每天4~6次采用柔软牙刷、含氟牙膏、牙线及不含乙醇的生理盐水或碱性漱口水清洁口腔[67-68]。如装有金属牙,可在金属牙和口腔黏膜之间填充保护材料以减小摩擦。
放疗期间建议患者戒烟、戒酒,多饮水,避免热性、酸性及辛辣食物[67]。金银花饮剂有助于口腔黏膜炎的恢复,可适当服用。在药物预防和治疗方面,可选择非甾体类抗炎药、锌补充剂、利多卡因漱口水、阿片类药物、口腔黏膜保护剂、生长因子及细胞因子类药物等,如继发感染则应进行局部或全身抗感染治疗[69-71]。不推荐全身使用黏膜保护剂。在口腔黏膜损伤愈合前,尽量少带义齿。如在联合西妥昔单抗时出现3~4级口腔黏膜炎,需暂停西妥昔单抗治疗直至黏膜反应降至2级或以下[72],必要时暂停放疗。
6.3 放射性皮炎
放射性皮炎是放疗过程中常见的皮肤不良反应。与单纯放疗或CRT相比,放疗联合西妥昔单抗相关皮炎出现时间更早、程度更严重,一般在治疗开始后1~2周内出现,并在治疗结束后1~2周内消退[73]。鉴于西妥昔单抗联合放疗相关皮炎与放疗/CRT相关皮炎有所差别,一项欧洲专家共识对放疗联合西妥昔单抗相关皮炎提出了分级和管理意见(表3)[73]。
专家意见4:根据放疗联合西妥昔单抗相关不良反应进行分级管理,1~2级经积极对症处理后可继续治疗,3~4级需暂停西妥昔单抗治疗直至不良反应降至2级以下,必要时暂停放疗。

7 展望
7.1 免疫检查点抑制剂
近年来,多种针对程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)的免疫检查点抑制剂在复发转移SCCHN中的疗效已经获得肯定[74-75],而在CRT或根治性放疗中加用免疫检查点抑制剂能否为局部晚期SCCHN患者带来获益成为近年来的研究热点之一。遗憾的是,已公布的两项免疫检查点抑制剂联合CRT的Ⅲ期临床研究(JAVELIN H&N-100[76]和KEYNOTE-412[77])均未达到研究的主要终点。KEYNOTE-412研究[77]显示,帕博利珠单抗联合CRT与安慰剂联合CRT的2年无事件生存率(主要终点)分别为63.2%和56.2%,差异无统计学意义(HR=0.83,95% CI:0.68~1.03,P=0.043,未达到优效性阈值)。此外,有研究在根治性放疗中同步西妥昔单抗和PD-1/PD-L1单抗治疗,期望能为局部晚期SCCHN患者,尤其是为不能耐受标准剂量顺铂的患者提供一种低毒、有效的选择,然而前期的探索结果令人失望。Ⅲ期GORTEC-REACH研究[78]针对不适合铂类药物治疗的局部晚期SCCHN患者队列,在西妥昔单抗+放疗的基础上联合PD-L1单抗阿维鲁单抗,发现未显著提高患者的2年PFS率(P=0.15)(主要研究终点),且在LRC、远处转移方面也无优势,而在适合铂类药物治疗的队列中,放疗+西妥昔单抗+阿维鲁单抗的方案因中期分析达到无效终点而提前终止。DUCRO研究[79]是一项开放标签、多中心的单臂Ⅰ/Ⅱ期研究,在PD-L1联合阳性评分(combined positive score,CPS)>1的局部晚期SCCHN中评估了抗PD-L1单抗德瓦鲁单抗联合放疗和西妥昔单抗方案的疗效,主要终点是2年PFS率,但研究因为监管问题提前终止。前期公布的数据显示,在中位随访11.5个月时,入组患者(6/9)的1和2年PFS率分别为77.7%和58.3%,但研究样本量太小,该方案的有效性尚需进一步考证[80]。因此,目前在局部晚期SCCHN根治性放疗同步采用抗EGFR单抗+PD-1/PD-L1单抗的价值仍不明确。
此外,也有Ⅰb期研究[81]探索在西妥昔单抗联合放疗方案中加入细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂伊匹木单抗对Ⅲ~ⅣB期SCCHN的毒性和最佳联合剂量,初步证实了在西妥昔单抗联合放疗的基础上加用伊匹木单抗的安全性,有待后续的Ⅱ期研究结果。
7.2 放疗增敏剂
除西妥昔单抗外,另一种在Ⅲ期临床试验中证实有效的放疗增敏药物是尼莫拉唑(nimorazole)。尼莫拉唑是一种可靶向乏氧肿瘤细胞的放疗增敏药物。来自丹麦的一项Ⅲ期研究[82]表明,尼莫拉唑联合放疗可显著提高声门上型喉癌和口咽癌患者的LRC率。目前尼莫拉唑仅在丹麦获批。此外,xevinapant是一种口服的抗凋亡蛋白抑制剂,具有良好的放疗增敏效果,曾获美国FDA突破性疗法认定,用于与标准化疗及放疗方案联合治疗初治无法切除的局部晚期SCCHN,在Ⅱ期随机研究[83]中,xevinapant联合标准CRT显示出更优的疗效,目前Ⅲ期TrilynX研究[84]正在开展,期待未来xevinapant与抗EGFR单抗联合应用于放疗增敏的临床实践。
8 结语
以标准剂量顺铂为基础的同期CRT是局部晚期SCCHN患者的标准非手术治疗模式。但也应注意CRT的毒性和耐受性。与单纯放疗相比,西妥昔单抗联合放疗可显著提高局部晚期SCCHN患者的生存率。本共识建议,对于无法耐受标准剂量顺铂的患者,可选择放疗联合西妥昔单抗的方案。对于有缩瘤、降期或器官功能保留需求、拟行诱导治疗的患者,标准诱导治疗方案为TPF,对于不能耐受TPF毒性的患者,可用西妥昔单抗替代5-氟尿嘧啶,采用TPE方案。考虑到顺铂的累积毒性,在使用含顺铂诱导治疗后,不推荐再使用标准剂量顺铂的同期化疗方案,诱导治疗后肿瘤退缩良好的,后续可选择单纯放疗或放疗联合西妥昔单抗治疗。对于放疗联合西妥昔单抗的相关不良反应,可以通过治疗前预防、治疗过程中早期识别和及时干预进行全面、分级管理。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] MACHIELS J P, RENÉ LEEMANS C, GOLUSINSKI W, et al. Squamous cell carcinoma of the oral cavity, larynx, oropharynx and hypopharynx: EHNS-ESMO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2020, 31(11): 1462-1475.
[2] ARGIRIS A, KARAMOUZIS M V, RABEN D, et al. Head and neck cancer[J]. Lancet, 2008, 371(9625): 1695-1709.
[3] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[4] ZHENG R S, ZHANG S W, ZENG H M, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9.
[5] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南(2022年版)[M]. 北京: 人民卫生出版社, 2022.
Working Committee of the Guidelines of the Chinese Society of Clinical Oncology. Chinese Society of Clinical Oncology (CSCO) Guidelines for the Diagnosis and Treatment of Head and Neck Tumors (2022 Edition)[M]. Beijing: People’s Medical Publishing House, 2022.
[6] LACAS B, CARMEL A, LANDAIS C, et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 107 randomized trials and 19 805 patients, on behalf of MACH-NC group[J]. Radiother Oncol, 2021, 156: 281-293.
[7] CHUNG C H, ELY K, MCGAVRAN L, et al. Increased epidermal growth factor receptor gene copy number is associated with poor prognosis in head and neck squamous cell carcinomas[J]. J Clin Oncol, 2006, 24(25): 4170-4176.
[8] AKIMOTO T, HUNTER N R, BUCHMILLER L, et al. Inverse relationship between epidermal growth factor receptor expression and radiocurability of murine carcinomas[J]. Clin Cancer Res, 1999, 5(10): 2884-2890.
[9] MILAS L, MASON K, HUNTER N, et al. In vivo enhancement of tumor radioresponse by C225 antiepidermal growth factor receptor antibody[J]. Clin Cancer Res, 2000, 6(2): 701-708.
[10] CHEN D J, NIRODI C S. The epidermal growth factor receptor: a role in repair of radiation-induced DNA damage[J]. Clin Cancer Res, 2007, 13(22 Pt 1): 6555-6560.
[11] KURAI J, CHIKUMI H, HASHIMOTO K, et al. Antibodydependent cellular cytotoxicity mediated by cetuximab against lung cancer cell lines[J]. Clin Cancer Res, 2007, 13(5): 1552-1561.
[12] TRIVEDI S, SRIVASTAVA R M, CONCHA-BENAVENTE F, et al. Anti-EGFR targeted monoclonal antibody isotype influences antitumor cellular immunity in head and neck cancer patients[J]. Clin Cancer Res, 2016, 22(21): 5229-5237.
[13] HUANG S M, BOCK J M, HARARI P M. Epidermal growth factor receptor blockade with C225 modulates proliferation, apoptosis, and radiosensitivity in squamous cell carcinomas of the head and neck[J]. Cancer Res, 1999, 59(8): 1935-1940.
[14] HERBST R S, HONG W K. IMC-C225, an anti-epidermal growth factor receptor monoclonal antibody for treatment of head and neck cancer[J]. Semin Oncol, 2002, 29(5 Suppl 14): 18-30.
[15] HERBST R S, LANGER C J. Epidermal growth factor receptors as a target for cancer treatment: the emerging role of IMC-C225 in the treatment of lung and head and neck cancers[J]. Semin Oncol, 2002, 29(1 Suppl 4): 27-36.
[16] KIMURA H, SAKAI K, ARAO T, et al. Antibody-dependent cellular cytotoxicity of cetuximab against tumor cells with wildtype or mutant epidermal growth factor receptor[J]. Cancer Sci, 2007, 98(8): 1275-1280.
[17] SRIVASTAVA R M, LEE S C, ANDRADE FILHO P A, et al. Cetuximab-activated natural killer and dendritic cells collaborate to trigger tumor antigen-specific T-cell immunity in head and neck cancer patients[J]. Clin Cancer Res, 2013, 19(7): 1858-1872.
[18] BONNER J A, HARARI P M, GIRALT J, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2006, 354(6): 567-578.
[19] BONNER J A, HARARI P M, GIRALT J, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival[J]. Lancet Oncol, 2010, 11(1): 21-28.
[20] 国家药品监督管理局. 2022年06月20日药品批准证明文件待领取信息发布[EB/OL]. [2022-12-20]. https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220620141308104.html. National Medical Products Administration. On June 20,2022, the drug approval certificate was issued[EB/OL].[2022]. https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220620141308104.html.
[21] MATEO C, MORENO E, AMOUR K, et al. Humanization of a mouse monoclonal antibody that blocks the epidermal growth factor receptor: recovery of antagonistic activity[J]. Immunotechnology, 1997, 3(1): 71-81.
[22] 国家卫生健康委员会合理用药专家委员会. 新型抗肿瘤药物临床应用指导原则(2021年版)[EB/OL]. [2022-12-20].http://www.nhc.gov.cn/yzygj/s7659/202112/0fbf3f04092b4d67be3b3e89040d8489.shtml. Expert Committee on Rational Drug Use of the National Health Commission. Guiding principles for clinical application of new antitumor drugs (2021 edition)[EB/OL]. [2022-12-20]. http://www.nhc.gov.cn/yzygj/s7659/202112/0fbf3f04092b4d67be3b3e89040d8489.shtml.
[23] SCHNEIDER-MERCK T, LAMMERTS VAN BUEREN J J, BERGER S, et al. Human IgG2 antibodies against epidermal growth factor receptor effectively trigger antibody-dependent cellular cytotoxicity but, in contrast to IgG1, only by cells of myeloid lineage[J]. J Immunol, 2010, 184(1): 512-520.
[24] NGUYEN-TAN P F, ZHANG Q, ANG K K, et al. Randomized phase Ⅲ trial to test accelerated versus standard fractionation in combination with concurrent cisplatin for head and neck carcinomas in the radiation therapy oncology group 0129 trial: long-term report of efficacy and toxicity[J]. J Clin Oncol, 2014, 32(34): 3858-3866.
[25] LE X N, HANNA E Y. Optimal regimen of cisplatin in squamous cell carcinoma of head and neck yet to be determined[J]. Ann Transl Med, 2018, 6(11): 229.
[26] LOONG H H, MA B B, LEUNG S F, et al. Prognostic significance of the total dose of cisplatin administered during concurrent chemoradiotherapy in patients with locoregionally advanced nasopharyngeal carcinoma[J]. Radiother Oncol, 2012, 104(3): 300-304.
[27] NAKANO K, SATO Y, TOSHIYASU T, et al. Predictive factors of head and neck squamous cell carcinoma patient tolerance to high-dose cisplatin in concurrent chemoradiotherapy[J]. Mol Clin Oncol, 2016, 4(2): 303-309.
[28] NUYTS S, DIRIX P, CLEMENT P M, et al. Impact of adding concomitant chemotherapy to hyperfractionated accelerated radiotherapy for advanced head-and-neck squamous cell carcinoma[J]. Int J Radiat Oncol Biol Phys, 2009, 73(4): 1088-1095.
[29] MACHTAY M, MOUGHAN J, TROTTI A, et al. Factors associated with severe late toxicity after concurrent
chemoradiation for locally advanced head and neck cancer: an RTOG analysis[J]. J Clin Oncol, 2008, 26(21): 3582-3589.
[30] NORONHA V, JOSHI A, PATIL V M, et al. Once-a-week versus once-every-3-weeks cisplatin chemoradiation for locally advanced head and neck cancer: a phase Ⅲ randomized noninferiority trial[J]. J Clin Oncol, 2018, 36(11): 1064-1072.
[31] Sharma A, Kumar M, Bhasker S, et al. An open-label, noninferiority phase Ⅲ RCT of weekly versus three weekly cisplatin and radical radiotherapy in locally advanced head and neck squamous cell carcinoma (ConCERT trial)[J]. J Clin Oncol, 2022, 40(16_suppl):6004-6004.
[32] AHN M J, D'CRUZ A, VERMORKEN J B, et al. Clinical recommendations for defining platinum unsuitable head and neck cancer patient populations on chemoradiotherapy: a literature review[J]. Oral Oncol, 2016, 53: 10-16.
[33] MCCUSKER M G, MEHRA R, AMR S, et al. Comparison of efficacy and toxicity of chemoradiation regimens for head and neck squamous cell carcinoma primary treatment[J]. Head Neck, 2022, 44(3): 749-759.
[34] HAMAUCHI S, YOKOTA T, MIZUMACHI T, et al. Safety and efficacy of concurrent carboplatin or cetuximab plus radiotherapy for locally advanced head and neck cancer patients ineligible for treatment with cisplatin[J]. Int J Clin Oncol, 2019, 24(5): 468-475.
[35] GIRALT J, TRIGO J, NUYTS S, et al. Panitumumab plus radiotherapy versus chemoradiotherapy in patients with unresected, locally advanced squamous-cell carcinoma of the head and neck (CONCERT-2): a randomised, controlled, open label phase 2 trial[J]. Lancet Oncol, 2015, 16(2): 221-232.
[36] ANG K K , HARRIS J , WHEELER R , et al . Human papillomavirus and survival of patients with oropharyngeal cancer[J]. N Engl J Med, 2010, 363(1): 24-35.
[37] GILLISON M L, TROTTI A M, HARRIS J, et al. Radiotherapy plus cetuximab or cisplatin in human papillomaviruspositive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial[J]. Lancet, 2019, 393(10166): 40-50.
[38] MEHANNA H , ROBINSON M , HARTLEY A , et al . Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial[J]. Lancet, 2019, 393(10166): 51-60.
[39] RISCHIN D, KING M, KENNY L, et al. Randomized trial of radiation therapy with weekly cisplatin or cetuximab in low-risk HPV-associated oropharyngeal cancer (TROG 12.01)-a Trans-Tasman radiation oncology group study[J]. Int J Radiat Oncol Biol Phys, 2021, 111(4): 876-886.
[40] RISCHIN D, MEHANNA H, YOUNG R J, et al. Prognostic stratification of HPV-associated oropharyngeal cancer based on CD103+ immune cell abundance in patients treated on TROG 12.01 and De-ESCALaTE randomized trials[J]. Ann Oncol, 2022, 33(8): 804-813.
[41] ANG K K, ZHANG Q, ROSENTHAL D I, et al. Randomized phase Ⅲ trial of concurrent accelerated radiation plus cisplatin with or without cetuximab for stage Ⅲ to Ⅳ head and neck carcinoma: RTOG 0522[J]. J Clin Oncol, 2014, 32(27): 2940-2950.
[42] WEIDHAAS J B, HARRIS J, SCHAUE D, et al. The KRASvariant and cetuximab response in head and neck squamous cell cancer: a secondary analysis of a randomized clinical trial[J]. JAMA Oncol, 2017, 3(4): 483-491.
[43] 顾 湘, 刘 坤, 苟浩成, 等. T4b期下咽癌非手术综合治疗77例回顾性分析[J]. 中华耳鼻咽喉头颈外科杂志, 2022, 57(1): 22-28.
GU X, LIU K, GOU H C, et al. Retrospective analysis on 77 cases of T4b hypopharyngeal carcinoma treated by non-surgical treatments[J]. Chin J Otorhinolaryngol Head Neck Surg, 2022, 57(1): 22-28.
[44] PATIL V M, NORONHA V, JOSHI A, et al. A randomized phase 3 trial comparing nimotuzumab plus cisplatin
chemoradiotherapy versus cisplatin chemoradiotherapy alone in locally advanced head and neck cancer[J]. Cancer, 2019, 125(18): 3184-3197.
[45] MESÍA R, HENKE M, FORTIN A, et al. Chemoradiotherapy with or without panitumumab in patients with unresected, locally advanced squamous-cell carcinoma of the head and neck (CONCERT-1): a randomised, controlled, open-label phase 2 trial[J]. Lancet Oncol, 2015, 16(2): 208-220.
[46] GHI M G, PACCAGNELLA A, FERRARI D, et al. Induction TPF followed by concomitant treatment versus concomitant treatment alone in locally advanced head and neck cancer. A phase Ⅱ-Ⅲ trial[J]. Ann Oncol, 2017, 28(9): 2206-2212.
[47] LEFEBVRE J L, POINTREAU Y, ROLLAND F, et al. Induction chemotherapy followed by either chemoradiotherapy or bioradiotherapy for larynx preservation: the TREMPLIN randomized phase Ⅱ study[J]. J Clin Oncol, 2013, 31(7): 853-859.
[48] JANORAY G, POINTREAU Y, ALFONSI M, et al. Induction chemotherapy followed by cisplatin or cetuximab concomitant to radiotherapy for laryngeal/hypopharyngeal cancer: long-term results of the TREMPLIN randomised GORTEC trial[J]. Eur J Cancer, 2020, 133: 86-93.
[49] VERMORKEN J B, REMENAR E, VAN HERPEN C, et al. Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer[J]. N Engl J Med, 2007, 357(17): 1695-1704.
[50] POSNER M R, HERSHOCK D M, BLAJMAN C R, et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer[J]. N Engl J Med, 2007, 357(17): 1705-1715.
[51] HADDAD R, O'NEILL A, RABINOWITS G, et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial[J]. Lancet Oncol, 2013, 14(3): 257-264.
[52] COHEN E E, KARRISON T G, KOCHERGINSKY M, et al. Phase Ⅲ randomized trial of induction chemotherapy in patients with N2 or N3 locally advanced head and neck cancer[J]. J Clin Oncol, 2014, 32(25): 2735-2743.
[53] GEOFFROIS L, MARTIN L, DE RAUCOURT D, et al. Induction chemotherapy followed by cetuximab radiotherapy is not superior to concurrent chemoradiotherapy for head and neck carcinomas: results of the GORTEC 2007-02 phase Ⅲ randomized trial[J]. J Clin Oncol, 2018, 36(31): 3077-3083.
[54] Department of Veterans Affairs Laryngeal Cancer Study Group, WOLF G T, FISHER S G, et al. Induction chemotherapy plus radiation compared with surgery plus radiation in patients with advanced laryngeal cancer[J]. N Engl J Med, 1991, 324(24): 1685-1690.
[55] LEFEBVRE J L, CHEVALIER D, LUBOINSKI B, et al. Larynx preservation in pyriform sinus cancer: preliminary results of a European Organization for Research and Treatment of Cancer phase Ⅲ trial. EORTC Head and Neck Cancer Cooperative Group[J]. J Natl Cancer Inst, 1996, 88(13): 890-899.
[56] FORASTIERE A A, GOEPFERT H, MAOR M, et al. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer[J]. N Engl J Med, 2003, 349(22): 2091-2098.
[57] FORASTIERE A A, ZHANG Q, WEBER R S, et al. Longterm results of RTOG 91-11: a comparison of three nonsurgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer[J]. J Clin Oncol, 2013, 31(7): 845-852.
[58] ARGIRIS A, HERON D E, SMITH R P, et al. Induction docetaxel, cisplatin, and cetuximab followed by concurrent radiotherapy, cisplatin, and cetuximab and maintenance cetuximab in patients with locally advanced head and neck cancer[J]. J Clin Oncol, 2010, 28(36): 5294-5300.
[59] DIETZ A, WICHMANN G, KUHNT T, et al. Induction chemotherapy (IC) followed by radiotherapy (RT) versus
cetuximab plus IC and RT in advanced laryngeal/hypopharyngeal cancer resectable only by total laryngectomy-final results of the larynx organ preservation trial DeLOS-Ⅱ[J]. Ann Oncol, 2018, 29(10): 2105-2114.
[60] KEIL F, HARTL M, ALTORJAI G, et al. Docetaxel, cisplatin and 5-FU compared with docetaxel, cisplatin and cetuximab as induction chemotherapy in advanced squamous cell carcinoma of the head and neck: results of a randomised phase Ⅱ AGMT trial[J]. Eur J Cancer, 2021, 151: 201-210.
[61] LACOUTURE M E. Mechanisms of cutaneous toxicities to EGFR inhibitors[J]. Nat Rev Cancer, 2006, 6(10): 803-812.
[62] PINTO C, BARONE C A, GIROLOMONI G, et al. Management of skin reactions during cetuximab treatment in association with chemotherapy or radiotherapy: update of the Italian expert recommendations[J]. Am J Clin Oncol, 2016, 39(4): 407-415.
[63] 郭 晔, 张陈平. 抗EGFR单抗治疗复发/转移性头颈部鳞状细胞癌临床共识(2021年版)[J]. 中国癌症杂志, 2021, 31(12): 1220-1232.
GUO Y, ZHANG C P. Expert consensus on the treatment of recurrent/metastatic squamous cell carcinoma of the head and neck with anti-EGFR monoclonal antibody(2021 edition)[J]. China Oncol, 2021, 31(12): 1220-1232.
[64] 王 刚, 项蕾红, 袁 瑛, 等. 抗EGFR单抗治疗相关皮肤不良反应临床处理专家共识[J]. 实用肿瘤杂志, 2021, 36(3): 195-201.
WANG G, XIANG L H, YUAN Y, et al. Expert consensus on management of skin toxicities induced by anti-EGFR monoclonal antibody[J]. J Pract Oncol, 2021, 36(3): 195-201.
[65] VERA-LLONCH M, OSTER G, HAGIWARA M, et al. Oral mucositis in patients undergoing radiation treatment for head and neck carcinoma[J]. Cancer, 2006, 106(2): 329-336.
[66] ELTING L S, COOKSLEY C D, CHAMBERS M S, et al. Risk, outcomes, and costs of radiation-induced oral mucositis among patients with head-and-neck malignancies[J]. Int J Radiat Oncol Biol Phys, 2007, 68(4): 1110-1120.
[67] 中国临床肿瘤学会抗肿瘤药物安全管理专家委员会, 中国临床肿瘤学会肿瘤支持与康复治疗专家委员会. 抗肿瘤治疗引起急性口腔黏膜炎的诊断和防治专家共识[J]. 临床肿瘤学杂志, 2021, 26(5): 449-459.
Expert Committee of Antitumor Drug Safety Management of Chinese Society of Clinical Oncology, Expert Committee of Cancer Support and Rehabilitation Therapy of Chinese Society of Clinical Oncology. Expert consencus on diagnosis, prevention and treatment of acute oral mucositis induced by anti-tumor therapy[J]. Chin Clin Oncol, 2021, 26(5): 449-459.
[68] PETERSON D E, BENSADOUN R J, ROILA F, et al. Management of oral and gastrointestinal mucositis: ESMO clinical practice guidelines[J]. Ann Oncol, 2011, 22(Suppl 6): vi78-vi84.
[69] 吴 桐, 程 斌. 肿瘤放化疗性口腔黏膜炎的防与治[J].中华口腔医学杂志, 2022, 57(4): 436-440.
WU T, CHENG B. Prevention and control strategy of radiotherapy-/chemotherapy-induced oral mucositis[J]. Chin J Stomatol, 2022, 57(4): 436-440.
[70] DUNCAN G G, EPSTEIN J B, TU D S, et al. Quality of life, mucositis, and xerostomia from radiotherapy for head and neck cancers: a report from the NCIC CTG HN2 randomized trial of an antimicrobial lozenge to prevent mucositis[J]. Head Neck, 2005, 27(5): 421-428.
[71] ELAD S, CHENG K K F, LALLA R V, et al. MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy[J]. Cancer, 2020, 126(19): 4423-4431.
[72] 中华医学会放射肿瘤治疗学分会. 放射性口腔黏膜炎防治策略专家共识(2019)[J]. 中华放射肿瘤学杂志, 2019, 28(9): 641-647.
Radiation Oncology Branch of the Chinese Medical Association. Expert consensus on prevention and control strategy of radiotherapy-induced oral mucositis (2019)[J]. Chin J Radiat Oncol, 2019, 28(9): 641-647.
[73] BERNIER J, RUSSI E G, HOMEY B, et al. Management of radiation dermatitis in patients receiving cetuximab and radiotherapy for locally advanced squamous cell carcinoma of the head and neck: proposals for a revised grading system and consensus management guidelines[J]. Ann Oncol, 2011, 22(10): 2191-2200.
[74] FERRIS R L, BLUMENSCHEIN G Jr, FAYETTE J, et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2016, 375(19): 1856-1867.
[75] BURTNESS B, HARRINGTON K J, GREIL R, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study[J]. Lancet, 2019, 394(10212): 1915-1928.
[76] LEE N Y, FERRIS R L, PSYRRI A, et al. Avelumab plus standard-of-care chemoradiotherapy versus chemoradiotherapy alone in patients with locally advanced squamous cell carcinoma of the head and neck: a randomised, double-blind, placebocontrolled, multicentre, phase 3 trial[J]. Lancet Oncol, 2021, 22(4): 450-462.
[77] MACHIELS J P, TAO Y, BURTNESS B, et al. LBA5 primary results of the phase Ⅲ KEYNOTE-412 study: pembrolizumab (pembro) with chemoradiation therapy (CRT) vs placebo plus CRT for locally advanced (LA) head and neck squamous cell carcinoma (HNSCC)[J]. Ann Oncol, 2022, 33: S1399.
[78] BOURHIS J, TAO Y, SUN X, et al. LBA35 Avelumab cetuximab-radiotherapy versus standards of care in patients with locally advanced squamous cell carcinoma of head and neck (LA-SCCHN): randomized phase Ⅲ GORTEC-REACH trial[J]. Ann Oncol, 2021, 32: S1310.
[79] BONOMO P, DESIDERI I, LOI M, et al. Anti PD-L1 DUrvalumab combined with Cetuximab and RadiOtherapy in locally advanced squamous cell carcinoma of the head and neck: a phase Ⅰ/Ⅱ study (DUCRO)[J]. Clin Transl Radiat Oncol, 2018, 9: 42-47.
[80] BONOMO P, DESIDERI I, MANGONI M, et al. Durvalumab with cetuximab and radiotherapy for locally advanced squamous cell carcinoma of the head and neck: a phase 1/2 trial[J]. Radiother Oncol, 2022, 169: 64-70.
[81] FERRIS R L, MOSKOVITZ J, KUNNING S, et al. Phase Ⅰ trial of cetuximab, radiotherapy, and ipilimumab in locally advanced head and neck cancer[J]. Clin Cancer Res, 2022, 28(7): 1335-1344.
[82] OVERGAARD J, HANSEN H S, OVERGAARD M, et al. A randomized double-blind phase Ⅲ study of nimorazole as a hypoxic radiosensitizer of primary radiotherapy in supraglottic larynx and pharynx carcinoma. Results of the Danish head and neck cancer study (DAHANCA) protocol 5-85[J]. Radiother Oncol, 1998, 46(2): 135-146.
[83] SUN X S, TAO Y G, LE TOURNEAU C, et al. Debio 1143 and high-dose cisplatin chemoradiotherapy in high-risk locoregionally advanced squamous cell carcinoma of the head and neck: a double-blind, multicentre, randomised, phase 2 study[J]. Lancet Oncol, 2020, 21(9): 1173-1187.
[84] BOURHIS J, BURTNESS B, LICITRA L F, et al. Xevinapant or placebo plus chemoradiotherapy in locally advanced squamous cell carcinoma of the head and neck: TrilynX phase Ⅲ study design[J]. Future Oncol, 2022, 18(14): 1669-1678.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言