AJPS:南方医科大学等揭示了雷公藤红素脂质体通过靶向VDAC2诱导肝细胞癌铁死亡和细胞凋亡的机制
2024-01-04 网络 网络 发表于上海
雷公藤红素(Cel)是一种从中药雷公藤的根皮中提取获得的天然产物,研究表明其具有抗炎、抗动脉粥样硬化等药理学作用。近年来,Cel在多种肿瘤中的应用受到了广泛关注。
图8 AGCL能有效抑制异种移植瘤的生长
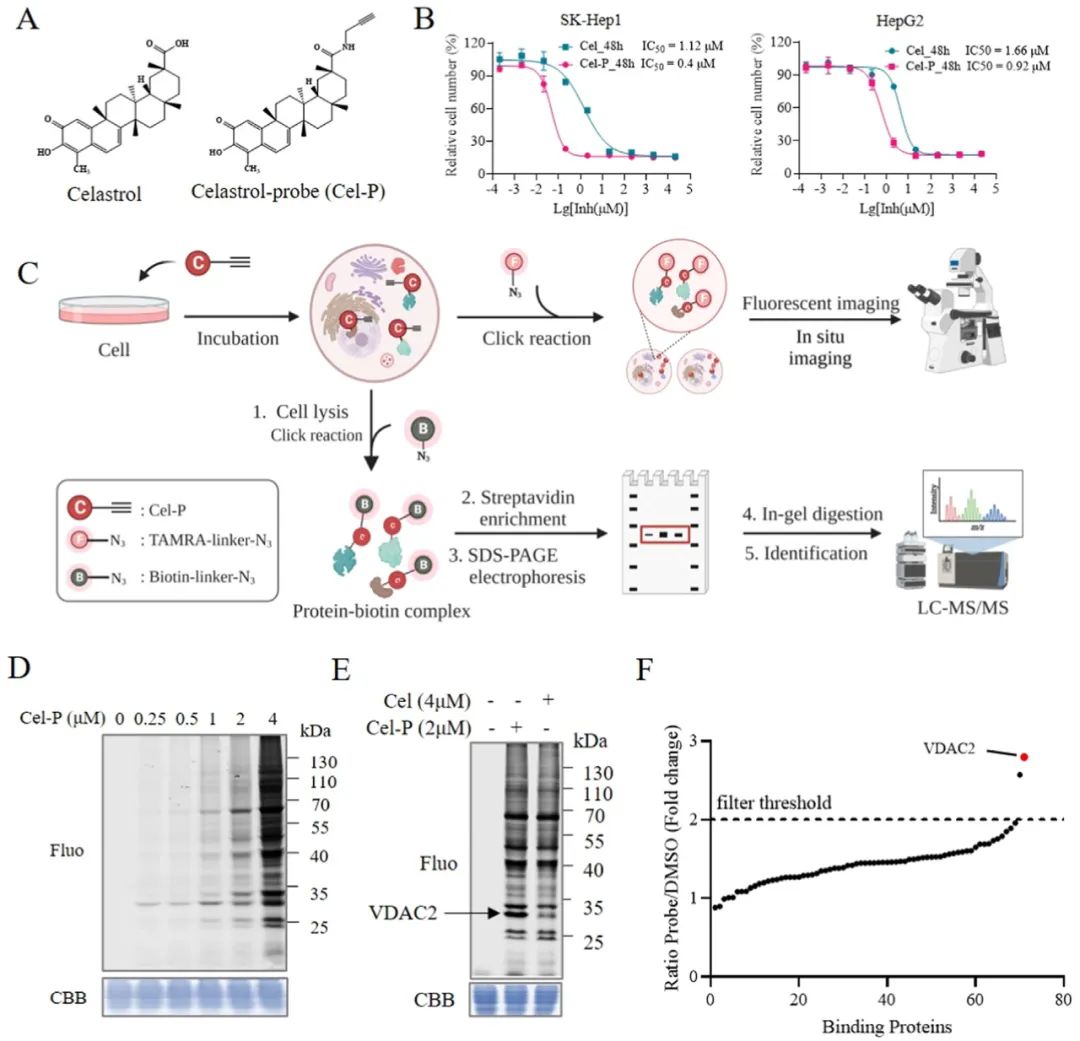
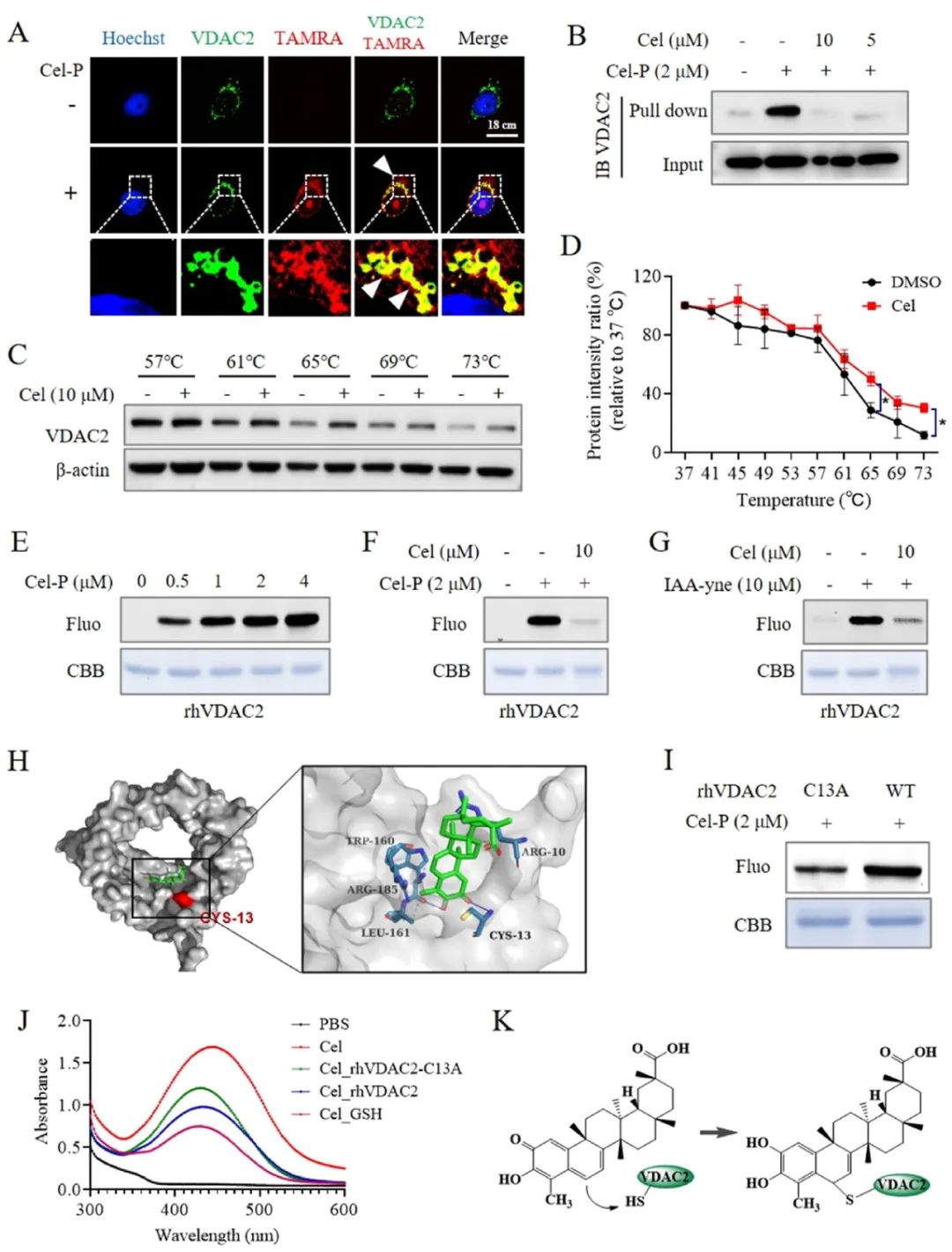
 图3 Cel可以引起线粒体膜结构的紊乱
图3 Cel可以引起线粒体膜结构的紊乱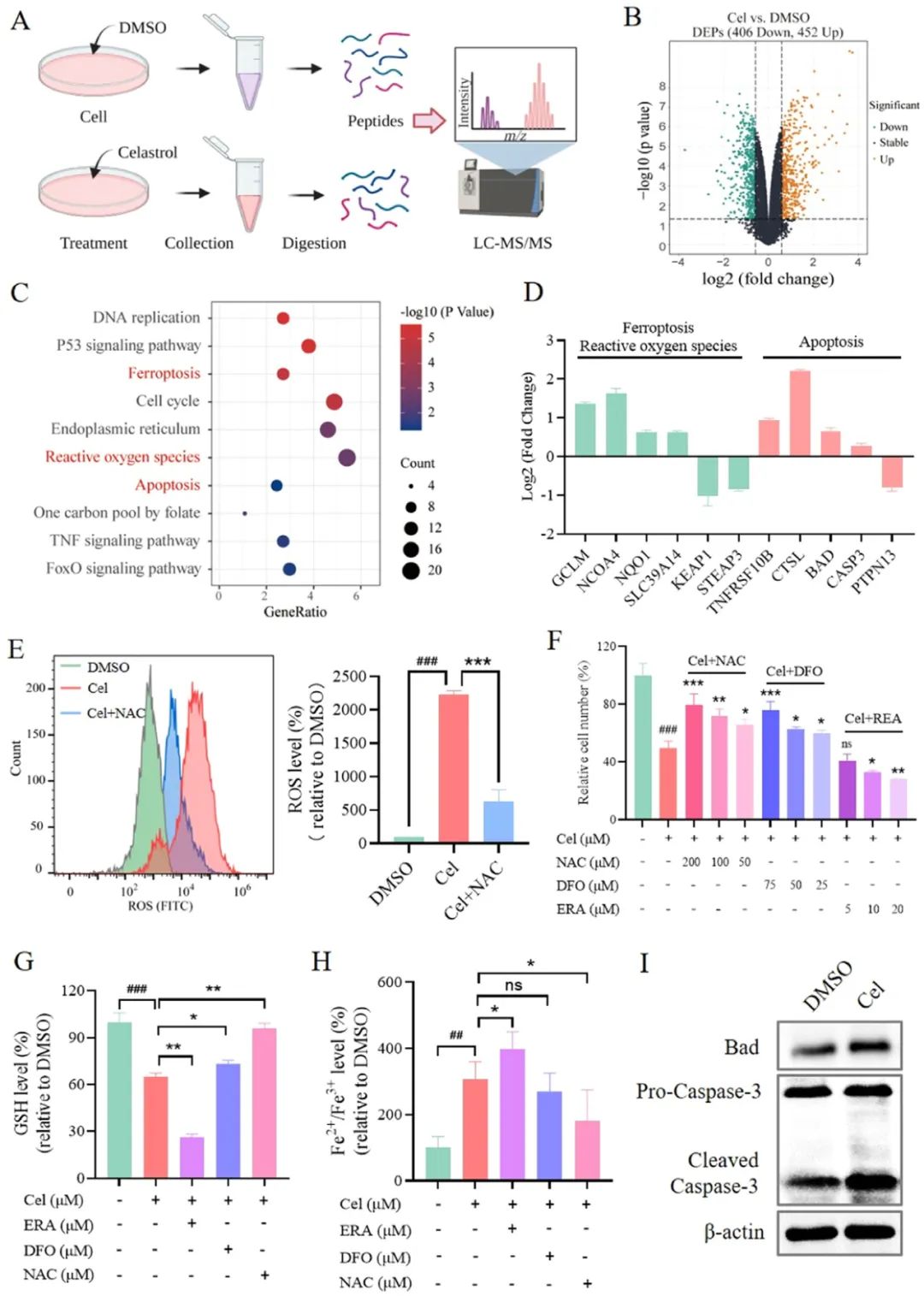
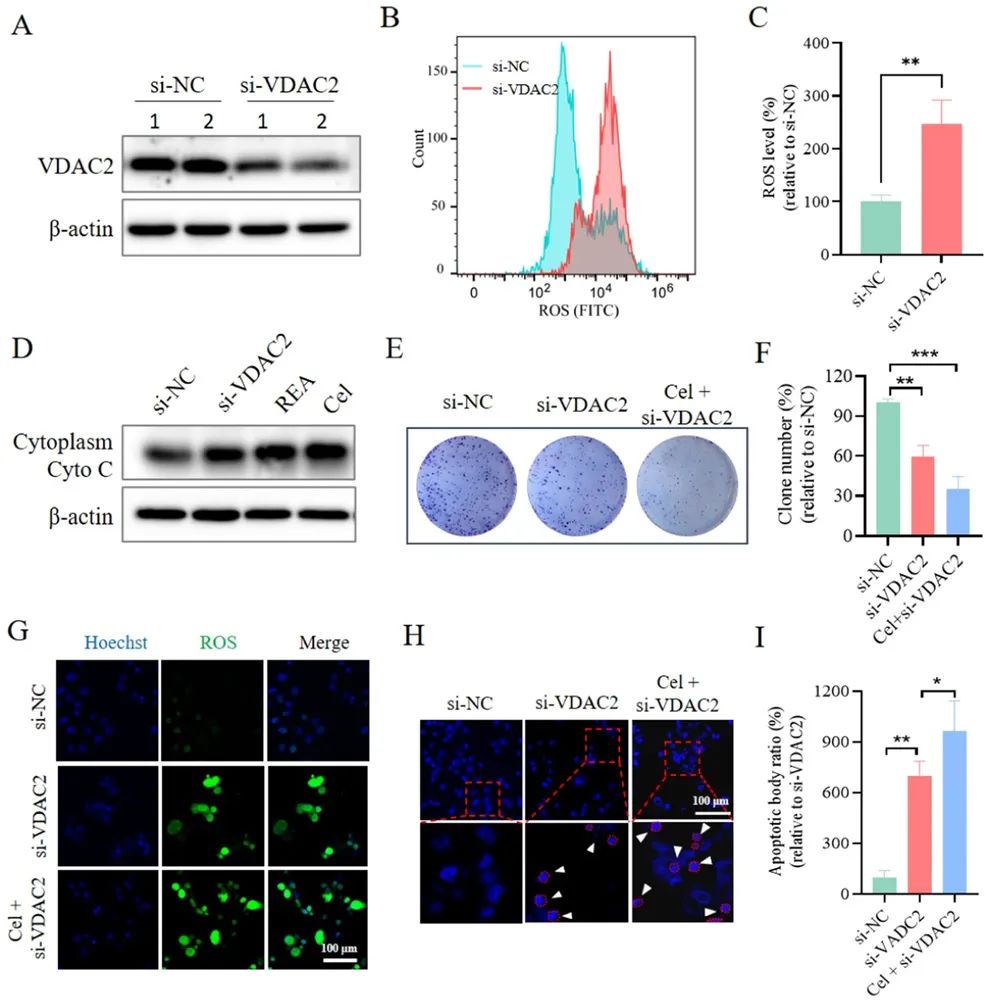
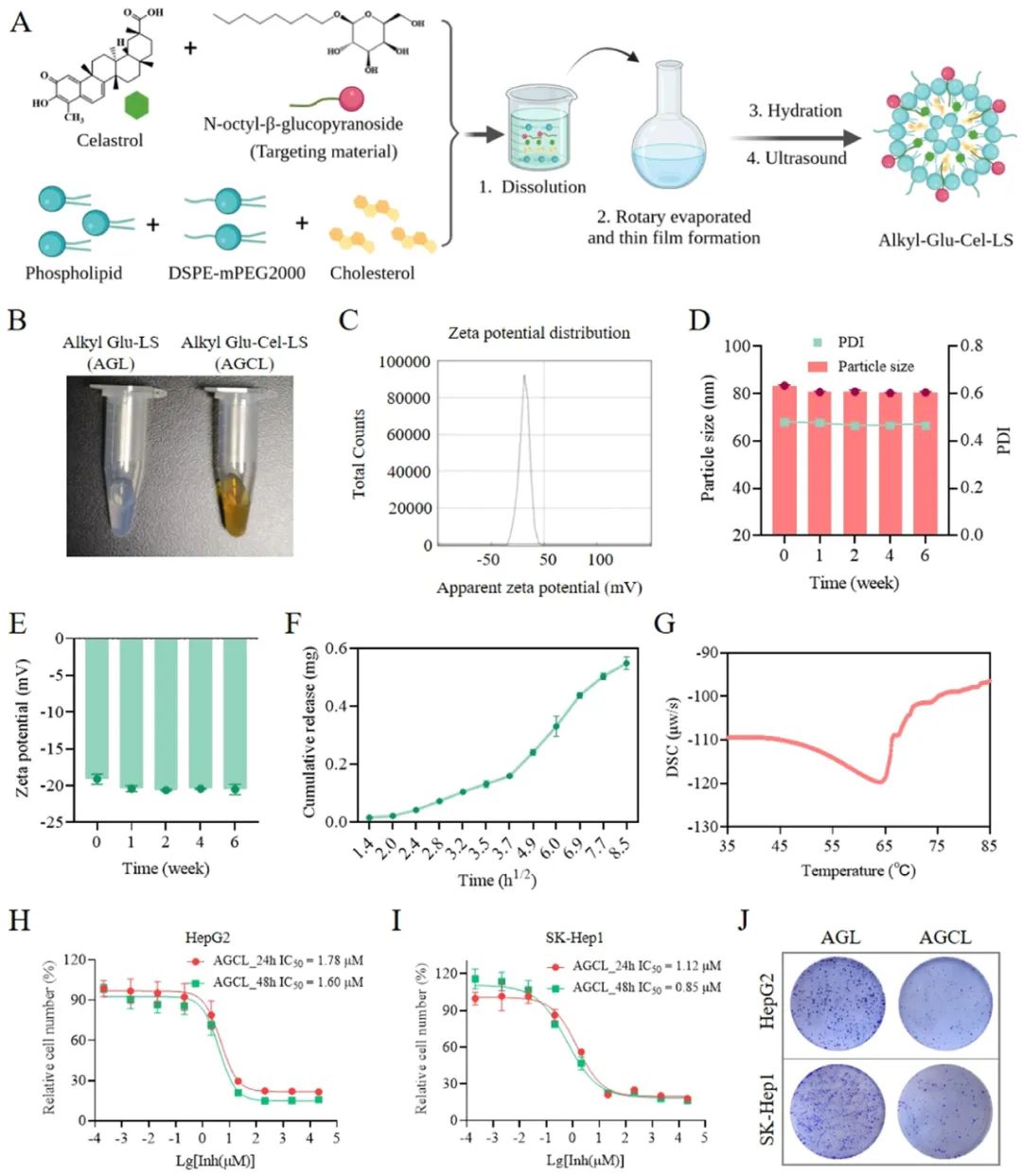 图6 AGCL的构建
图6 AGCL的构建

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






