CD:北京大学张哲团队揭示叶酸转运蛋白SLC19A1底物识别的分子机制
2022-12-30 iNature iNature 发表于上海
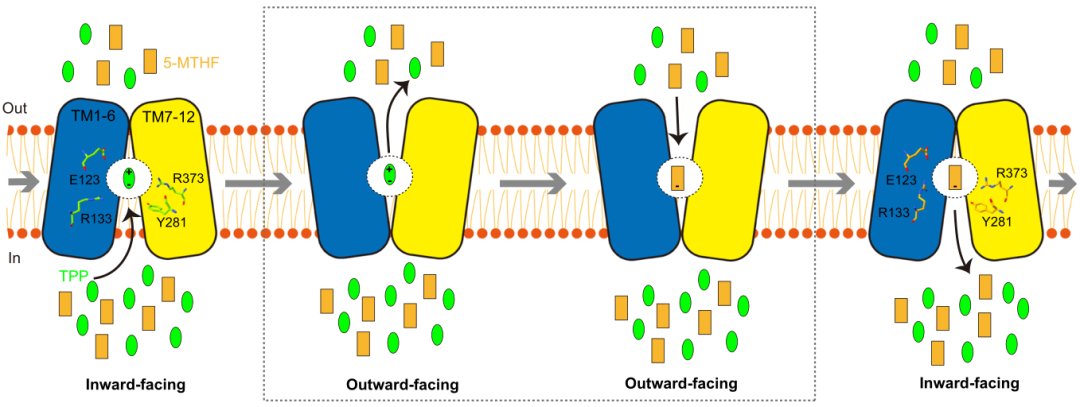
该研究报道了人类SLC19A1及其与5-MTHF配合物在3.5-3.6 Å分辨率下的冷冻电镜结构,并展示了底物结合的关键残基。
叶酸(维生素B9)是参与细胞生存和增殖所必需的单碳转移生化反应的辅酶,叶酸不足会导致发育缺陷或严重疾病。值得注意的是,哺乳动物细胞缺乏从头合成叶酸的能力,而是依赖于通过特定的转运体或受体从细胞外来源摄取叶酸,其中SLC19A1在组织中普遍表达。然而,SLC19A1识别底物的机制尚不清楚。
2022年12月28日,北京大学张哲团队在Cell Discovery(IF=38)在线发表题为“Molecular mechanism of substrate recognition by folate transporter SLC19A1”的研究论文,该研究揭示了叶酸转运蛋白SLC19A1识别底物的分子机制。
该研究报道了人SLC19A1及其与5-甲基四氢叶酸配合物在3.5-3.6 Å分辨率下的冷冻电镜结构,并阐明了底物识别的关键残基。揭示了SLC19亚家族成员中的两个变体残基指定了叶酸的特异性。此外,该研究发现细胞内的硫胺焦磷酸是SLC19A1转运叶酸的最佳偶联底物。总之,这项工作建立了叶酸转运体识别底物的分子基础。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言