【论著】| 恶性肿瘤患者血流感染病原分析及血糖检测的临床意义
2023-11-12 中国癌症杂志 中国癌症杂志 发表于上海
本研究分析恶性肿瘤合并BSI患者感染菌群分布情况,在此基础上进一步评估空腹血糖检测对此类患者的诊断意义;探索BSI患者治疗期间血糖水平的变化趋势,进而建立能够评估肿瘤合并BSI预后的血糖动态变化参数。
[摘要]
背景与目的:恶性肿瘤患者合并血流感染(bloodstream infection,BSI)的发病率逐渐增高,其治疗结果与感染病原密切相关,同时血糖对该类患者病情发生、发展亦有重要影响。本研究旨在分析恶性肿瘤患者合并BSI时的病原菌分布特征,并探讨合并BSI时血糖检测的临床意义、变化趋势及其对患者的预后价值。
方法:回顾性分析2019年10月—2022年12月在复旦大学附属肿瘤医院诊治的434例患恶性肿瘤合并BSI及同时期409例患恶性肿瘤未并发BSI患者的临床特征,统计患者合并BSI病原菌情况、空腹血糖、降钙素原(procalcitonin,PCT)等指标,并收集患者的随访信息。采用SPSS 26.0、Graphpad等软件进行数据分析。
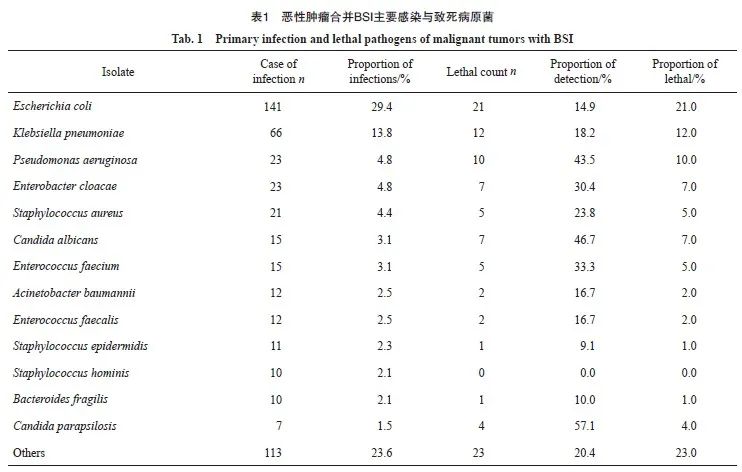
结果:恶性肿瘤合并BSI最常见病原菌前3位是大肠埃希菌(29.4%)、肺炎克雷伯菌(13.8%)、铜绿假单胞菌(4.8%)。8.5%的患者存在两种及以上病原菌混合感染。最终与致死有关菌株100株,大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌仍列前3位,分别占21.0%、12.0%和10.0%。生存分析显示两种及以上病原菌混合感染与单一感染相比预后较差(P=0.000)。恶性肿瘤合并BSI患者症状初期空腹血糖水平(中位数为7.39 mmol/L,四分位区间为5.95~9.88 mmol/L) 显著高于未发生BSI患者(中位数为5.97 mmol/L,四分位区间为5.25~7.06 mmol/L,P=0.000)。疾病初期空腹血糖水平判定患者发生BSI的受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under the curve,AUC)为0.718,高于经典诊断标志物PCT(AUC=0.708);两者联合可进一步提高诊断效能(AUC=0.761)。生存分析结果显示,BSI初期空腹血糖水平较高的患者预后较差(HR = 3.067,95% CI:1.375~6.838,P=0.000)。此外,BSI初期空腹血糖变化程度越大,患者死亡风险越高(HR=2.150,95% CI:1.125~4.109,P<0.01)。
结论:临床怀疑BSI患者应结合病原菌分布使用抗生素,并监测血糖水平以早期了解感染情况,采取干预措施,使患者获益。
[关键词] 恶性肿瘤;血流感染;血清葡萄糖;病原分布特点
恶性肿瘤严重危害人民健康,中国恶性肿瘤发病率和死亡率还在逐年上升[1],已成为中国城乡居民主要死因之一[2-3]。
血流感染(bloodstream infection,BSI)是一种临床常见、进展迅速、预后差、病死率高的系统性全身重症感染性疾病。其本质为各种病原体侵入血液系统引起全身多脏器受损,甚至进展为感染性休克、多器官衰竭、弥散性血管内凝血从而危及患者生命[4]。而恶性肿瘤患者由于自身免疫失衡、接受外科手术、介入治疗、放化疗、创伤性操作等,极易引起感染,尤其是引起BSI[5]。伴随着恶性肿瘤逐年增长,恶性肿瘤合并BSI发病率也呈增加趋势,总体占恶性肿瘤感染的10%,病死率则高达18%~42%。恶性肿瘤患者合并BSI会拖延化疗药物使用,延缓治疗进度、增加医疗费用,甚至造成患者死亡[6]。
已有研究[7-8]报道,在尿路感染相关BSI、神经外科患者及老年重症监护室(intensive care unit,ICU)病房患者并发BSI中,血糖水平升高是感染的危险因素,血糖控制不佳会增加BSI感染的风险,提示监测血糖水平对于肿瘤患者合并BSI及进展具有潜在预测价值。目前恶性肿瘤患者合并BSI时血糖检测的具体临床价值鲜有报道。粒细胞减少、肿瘤分期、低蛋白血症、留置管、感染性休克、菌血症评分、革兰氏染色、多重耐药菌感染等因素与恶性肿瘤合并BSI患者生存时间显著相关[9-10],但实际临床效用仍不突出。探索血糖能否作为预后指标,以及血糖的变化规律能否提示患者治疗转归将具有重要意义。
本研究分析恶性肿瘤合并BSI患者感染菌群分布情况,在此基础上进一步评估空腹血糖检测对此类患者的诊断意义;探索BSI患者治疗期间血糖水平的变化趋势,进而建立能够评估肿瘤合并BSI预后的血糖动态变化参数。通过检测血糖水平,为临床提供一种简单、可靠的BSI诊断及预后预测方法。
1 资料和方法
1.1 临床资料
收集2019年10月—2022年12月在复旦大学附属肿瘤医院就诊的恶性肿瘤合并BSI患者的临床资料。共434例患者入组为阳性组,其中男性259例,女性175例,中位年龄64岁(四分位区间:55~70)岁。阳性组中消化系统肿瘤占57.1%,肺癌及食管癌等胸腔肿瘤占10.1%,妇科肿瘤占9.4%,泌尿系统肿瘤占6.2%,淋巴瘤占3.2%,其他系统实体肿瘤占14.0%;纳入同期患有恶性肿瘤但未发生BSI的患者,依次对其赋予编号后,使用Excel软件随机抽取409例患者作为阴性组,患者中位年龄63岁(四分位区间:54~68)岁。其中,消化系统肿瘤占54.1%,肺癌及食管癌等胸腔肿瘤占20.2%,妇科肿瘤占6.1%,泌尿系统肿瘤占2.7%,淋巴瘤占2.0%,其他系统实体肿瘤占14.9%,肿瘤类型基本一致。所有患者自血培养采集日起,短期随访120 d。本研究经复旦大学附属肿瘤医院伦理委员会审核批准(伦理编号:050432-4-2108*)。
1.1.1 BSI临床诊断标准
发热>38 ℃或者体温<36 ℃,可伴有寒战,同时合并有下列情况之一:有入侵门户或者迁徙病灶;有全身中毒症状,无明显感染灶;有皮疹或者出血点、肝脾肿大、外周血中性粒细胞增多伴细胞核左移,且无其他原因可解释;血压收缩压<12 kPa,或较原收缩压下降>5.3 kPa 。病原学诊断标准:在临床诊断基础上,符合以下条件:血培养分离出病原微生物。
1.1.2 入组标准
⑴ 阳性入组标准:患者经影像学、病理学等检查确诊为恶性肿瘤;并依据《医院感染诊断标准》[11]确诊BSI,血培养分离出病原菌。
⑵ 阴性入组标准:患者经影像学、病理学等检查确诊为恶性肿瘤;并依据《医院感染诊断标准》[11]认为不属于BSI,血培养未分离出病原菌。
1.1.3 排除标准
血培养分离出常见皮肤或环境定植菌:如芽孢杆菌、丙酸杆菌属、微球菌属等,直接认为是污染菌。分离出凝固酶阴性葡萄球菌时,若培养超过72 h后阳性,仅单次或单瓶检出。符合以下至少1项可认为是污染:无明显发热及其他危险因素;敏感抗生素治疗无效;发热可由其他原因解释,如肿瘤热、药物热,且无明显感染指征[12]。
1.2 样本收集
回顾性分析恶性肿瘤疑似合并BSI患者感染病原菌菌种、报阳时间、指定时间空腹血糖及降钙素原(procalcitonin,PCT)。所有患者均已按《全国临床检验操作规程》[13]采集血培养标本,每次采集做到双侧双瓶,每瓶采集全血8~10 mL。血糖指定时间为两组患者血培养采样前1天至后1天,血培养采样第4~6天的空腹血清标本,采样前满足末次葡萄糖输注或进食后满8 h。本研究将血培养当日前后的空腹血糖均值称为初次血糖(Glu0 d),把第4~6日的空腹血糖均值称为二次血糖(Glu5 d)。
1.3 实验方法
1.3.1 病原菌分离与鉴定
血培养标本按《全国临床检验操作规程》[13]采集培养分离鉴定,使用法国生物梅里埃Vitros血培养仪进行培养。血培养阳性标本分离菌株后采用Vitek2-Compact全自动分析仪进行鉴定和药敏试验。使用生物梅里埃基质辅助激光解吸电离飞行时间质谱系统对所有鉴定结果进行复核。鉴定试验质控菌株均购自上海市临床检验中心:金黄色葡萄球菌(ATCC29213)、大肠埃希菌(ATCC25922)、铜绿假单胞菌(ATCC27853)、粪肠球菌(ATCC29212)、白色假丝酵母菌(ATCC14053)、腐生葡萄球菌(ACTT BAA-750)、霍氏肠杆菌(ATCC 700323)、流感嗜血杆菌(ATCC9007)。
1.3.2 血清指标检测
采集患者血液标本,在4~8 ℃条件下,以4 000 r/min的速率离心10 min后分离血清,用Roche Cobas 8000 c702全自动生化分析仪及Roche Cobas e801全自动电化学发光分析仪进行血糖及PCT检测。上海市临检中心质控作为血清指标质控品。
1.4 资料随访
对所有阳性组患者回顾短期生存随访,观察时间从诊断BSI至其死亡或好转出院。最后一位患者血培养采集日后第120天终止本研究随访部分。以治疗结局分两组:感染好转且存活者为预后良好组,因感染出现死亡者为预后不良组。
1.5 统计学处理
采用Microsoft Excel对已有数据进行管理建库,并用于分析恶性肿瘤患者BSI感染菌种分布。本研究实验数据采取非参数检验、Kaplan-Meier曲线、受试者特征曲线(receiver operating characteristic,ROC)分析及log-rank检验,P <0.05为差异有统计学意义。采用SPSS 26.0、Graphpad、MedCalc、X-tile统计软件对数据进行统计学分析。
2 结 果
2.1 恶性肿瘤合并BSI感染菌种分布及特征分析
2.1.1 恶性肿瘤合并BSI菌种分布
在434例阳性组患者中,共分离出479株病原菌。其中革兰氏阴性菌327株(占总菌株数的68.3%),革兰氏阳性菌122株(25.5%),真菌30株(6.3%)。常见菌种排名前十的依次为:大肠埃希菌141株,肺炎克雷伯菌66株,铜绿假单胞菌23株,阴沟肠杆菌23株,金黄色葡萄球菌21株,白色假丝酵母菌15株,屎肠球菌15株,鲍曼不动杆菌12株,粪肠球菌12株,表皮葡萄球菌11株(表1)。
所有菌株中,最终引起患者死亡的菌株共计100株,其中革兰氏阴性菌63株(占其检出总数的19.3%),革兰氏阳性菌23株(18.9%),真菌14株(46.7%)。主要致死菌株分布见表1。
2.1.2 恶性肿瘤合并BSI患者的生存分析
本研究中有多位患者感染两种及以上病原菌,感染4种病原菌患者中1例死亡。感染3种病原菌患者6例,其中3例死亡。感染2种病原菌患者30例,14例死亡。感染1种病原菌患者397例,死亡59例。具体的患者生存情况见图1。
本研究认定仅感染一种病原菌为单纯感染,感染2~4种病原菌为混合感染,以此将恶性肿瘤合并BSI患者分为单纯感染组与混合感染组。两组患者生存情况结果显示差异有统计学意义(图2,P<0.001)。

图1 恶性肿瘤合并BSI感染不同菌株数患者的生存情况
Fig. 1 Survival of malignant tumor patients with BSI of different pathogen numbers
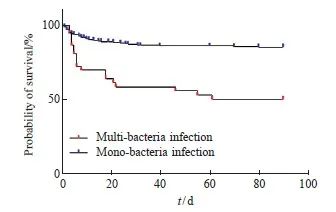
图2 混合感染与单纯感染组生存曲线
Fig. 2 Survival curve of multi-bacteria infection and mono-bacteria infection groups
2.2 恶性肿瘤合并BSI患者的空腹血糖水平分析
2.2.1 恶性肿瘤合并BSI患者血培养采集当日初次空腹血糖水平与未发生BSI患者的比较
本研究将初次血培养送检时间点定义为BSI发生初期。恶性肿瘤合并BSI患者在此时间点上的空腹血糖水平(7.39 mmol/L,范围:5.95~9.88 mmol/L;n=346)显著高于恶性肿瘤未发生BSI的患者(5.97 mmol/L,范围:5.25~7.06 mmol/L;n=409,P<0.001,图3)。因两组人群年龄分布分别为阳性组(中位年龄64岁,范围:55~70岁)。阴性组(中位年龄63岁,范围:54~68岁),差异无统计学意义(P>0.05)。故可排除两组间年龄对血糖的影响(图4)。
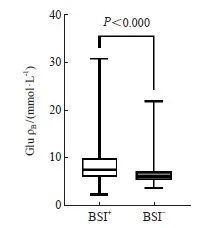
图3 恶性肿瘤合并BSI与未发生BSI患者血糖水平
Fig. 3 Blood glucose levels in patients with malignant tumors combined with BSI and those without BSI
Glu: Blood glucose.

图4 恶性肿瘤合并BSI与未发生BSI患者组间年龄比较结果
Fig. 4 Age comparison results between malignant tumor patients with BSI and those without BSI
ns: No significance.
2.2.2 患者血糖水平检测对恶性肿瘤合并BSI的诊断价值
基于恶性肿瘤合并BSI患者的初次血糖水平显著升高,本研究采用ROC曲线评估BSI发生初期空腹血糖检测对恶性肿瘤患者发生BSI的诊断潜能进行评估。结果显示,BSI初期空腹血糖水平诊断肿瘤合并BSI的曲线下面积(area under the curve,AUC)为0.718,灵敏度为62.5%,特异度为73.4%,阳性预期值为70.8%,阴性预期值为65.5%(表2)。高于常用诊断标志物PCT(AUC=0.708);当联合应用血糖与PCT检测时,诊断效能进一步提高,AUC达0.761(图5),且整体阳性预期值与阴性预期值均有提高。
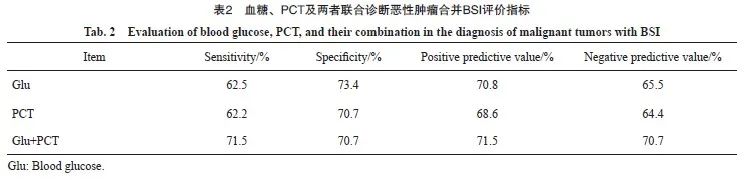
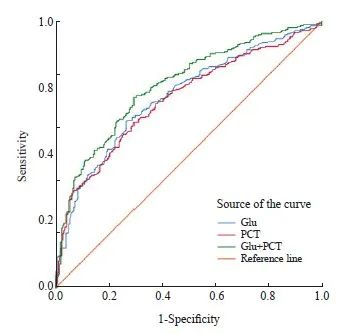
图5 血糖、PCT及两者联合诊断恶性肿瘤合并BSI的ROC曲线
Fig. 5 ROC curve of blood glucose, PCT, and their combination in the diagnosis of malignant tumors with BSI
Glu: Blood glucose.
2.2.3 不同预后的恶性肿瘤合并BSI患者的初期空腹血糖水平差异比较
按照患者最终是否死亡,将入组患者划分为预后不良组(77例)与预后良好组(357例),并比较两组间BSI发生初期空腹血糖水平差异。结果显示,恶性肿瘤合并BSI患者中,预后不良组初次血糖水平(9.26 mmol/L,范围:7.13~11.37 mmol/L)显著高于预后良好组(7.07 mmol/L,范围:5.83~9.23 mmol/L;P<0.001;图6)。进一步采用log-rank分析结果显示,患者空腹血糖值越高,预后越差(HR=3.067,95% CI:1.375~6.838,P <0.001)。

图6 不同预后的恶性肿瘤合并BSI患者血糖水平
Fig. 6 Blood glucose levels of malignant tumors patients with BSI in different prognosis groups
Glu: Blood glucose.
2.2.4 恶性肿瘤合并BSI患者血糖变化程度(Δglucose,ΔGlu)与疾病转归
进一步探究BSI发生后,血糖改变对于预后的影响,本研究设定患者ΔGlu为5 d后二次血糖对初次血糖的变化程度,即 ΔGlu=[(Glu0d-Glu5d)/Glu0d]×100%,得到变化程度百分比。其结果正值为降低程度,负值为增高程度。
本研究结果发现,在恶性肿瘤合并BSI患者中,预后不良组15.5%的患者出现升高情况,84.5%出现下降,平均血糖变化程度为22.25%(6.24%~38.50%),预后良好组中21.7%的患者血糖水平升高,78.3%的患者血糖水平下降,血糖变化程度为13.41%(2.88%~29.06%)。预后不良组血糖降低程度显著优于预后良好组(P <0.05,图7)。
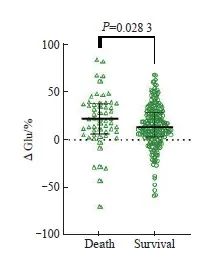
图7 不同转归的恶性肿瘤合并BSI患者的血糖变化程度比较
Fig. 7 Comparison of blood glucose variability in malignant tumors patients with BSI of different outcomes
Glu: Blood glucose.
在此基础上,利用X-tile软件分析,当ΔGlu=33.6%是评估恶性肿瘤合并BSI患者预后的最佳截断值。并以log-rank检验分析显示,ΔGlu>33.6%的患者,倾向较差预后(HR=2.150;95% CI:1.125~4.109)。以ΔGlu=33.6%为Cut-off将恶性肿瘤合并BSI患者分为两组,绘制生存曲线,结果见图8(P <0.01)。
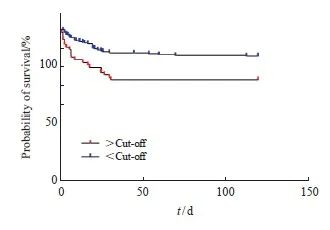
图8 不同ΔGlu组别的生存曲线
Fig. 8 Survival curves of different ΔGlu groups
Glu: Blood glucose.
3 讨 论
目前,大多数关于血糖及BSI的研究集中在重症或者急性炎症合并感染的患者,对恶性肿瘤患者人群的报道较少。本研究总结并分析了复旦大学附属肿瘤医院3年多恶性肿瘤合并BSI患者感染病原菌的菌种分布。革兰氏阴性菌约占感染分离菌株的68%,革兰氏阳性细菌约占26%,而真菌类约占6%。该结果与吴春兰等[10]的报道结果相似(革兰氏阴性菌占63%、革兰氏阳性细菌占31%、真菌占6%)。郑州大学附属肿瘤医院的常彦敏等[14]报道,革兰氏阴性菌感染率占65%、革兰氏阳性菌占29%、真菌占5%。Amanati等[15]对肿瘤患者合并细菌感染引起的BSI做了相应统计(革兰氏阴性菌占63%,革兰氏阳性菌占37%)。可见恶性肿瘤患者合并BSI病原菌分布大类基本相似,这可能与多数恶性肿瘤患者接受如手术、机械通气、静脉置管等有创操作从而引起导管相关感染或其他院内感染有关。常检出的单菌种排名主要为:大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、阴沟肠杆菌、金黄色葡萄球菌、白色假丝酵母菌等。此顺序与上述研究结果稍有出入,吴春兰等[10]与常彦敏等[14]研究中BSI病原菌中凝固酶阴性葡萄球菌占据了前3位,而本研究为回顾性研究,剔除了高度怀疑污染的病例,以纠正污染引起的偏倚;同时,本研究细菌分布结果更倾向于肠杆菌目革兰氏阴性菌,与全国耐药监测网报道BSI常见病原菌分布[16]有所不同。可能的原因在于,恶性肿瘤患者接受有创操作或机体免疫功能下降,易出现以革兰氏阴性菌为主的条件致病菌侵袭;此外,恶性肿瘤合并BSI患者多以消化道或呼吸道恶性肿瘤为基础疾病,易发生肠杆菌目细菌感染。故临床上怀疑合并BSI时,经验性用药应重点覆盖革兰氏阴性菌,以改善患者的预 后。
此外,本研究还对BSI感染病原菌引起死亡的病例进行了详细统计。结果发现,虽然大肠埃希菌与肺炎克雷伯菌在检出率和致死总数上位居前两位,但其感染后致死率均<20%。相反,铜绿假单胞菌和真菌虽然感染率不高,但是两者感染后致死率均超过40%。真菌血症中近平滑假丝酵母菌致死率为57%,而热带假丝酵母菌致死率高达67%,白色假丝酵母菌也达到了47%,反映出铜绿假单胞菌血症与真菌血症患者预后极差。Maschmeyer等[17]报道,肿瘤患者铜绿假单胞菌血症死亡率为33%。Carreras等[18]则报道,实体肿瘤患者合并真菌BSI 30 d粗死亡率亦达45%。本研究中这两类病原菌感染情况也分别与王一栋等[19]、张黎等[20]的研究结果一致。临床上应高度重视上述两类病原菌的BSI,一旦怀疑感染需及时送检并对应处理。本研究还发现恶性肿瘤合并BSI患者若出现两种以上病原菌混合感染,致死率明显高于单一感染,患者的生存期缩短。
本研究发现恶性肿瘤合并BSI患者初期空腹血糖水平显著高于未发生BSI患者。综合各类基础疾病合并BSI的报道所示,发生BSI组血糖明显高于未发生组[21],血糖升高是发生BSI合并症的危险因素[8-10,22-23]。本研究与其他研究结果一致。本研究还通过ROC分析发现,早期空腹血糖检测可作为恶性肿瘤合并BSI的辅助诊断指标,有预测BSI发生的作用,其特异度与PCT相近,灵敏度甚至略高于PCT。早期空腹血糖越高,患者合并BSI的概率越大。早期空腹血糖与PCT联合检测AUC可达0.761,可以作为诊断的联 合指标。
Patel等[24]也认为,存在铜绿假单胞菌血症,阳性血培养48 h内平均血糖浓度更高的患者30 d死亡率更高。感染初期机体高血糖状态可能更有利于病原菌在循环中生长繁殖,与此同时,患者血糖过高可继发氧化应激增加,影响机体的免疫功能。脓毒症患者高血糖可影响人白细胞抗原(human leukocyte antigen,HLA)-DR的活化且CD4+/CD8+比值异常;邵素华等[25]则报道急性胰腺炎患者血清免疫球蛋白(immunoglobulin,Ig)IgA与IgG水平受到高血糖的影响而降低;邓其浪等 [26]的动物体内实验也佐证持续高血糖可导致大鼠体内IgG水平显著降低。Casqueiro等[27]同样认为高血糖状态会损害中性粒细胞功能,抑制抗氧化并影响体液免疫。这些情况可能是恶性肿瘤合并BSI患者高空腹血糖及预后较差的原因。
本研究还发现,患者发生BSI后,其血糖变化程度与感染后转归相关,变化程度较大的患者预后不良,这与Atamna等[28]的研究一致,其结果显示,急性感染住院患者血糖变化程度较大的1/3人群30 d和90 d死亡率显著高于其他人群,且变化程度位于中上2/3的人群的5年生存率也显著降低。主要原因:① 血糖变化使体内活性氧自由基被大量激活;② 血糖水平的波动促使血管内皮功能受损。Plummer等[29]证实血糖波动与BSI患者死亡率相关,认为血糖明显波动与氧化应激诱导内皮功能障碍及内皮细胞凋亡有关。
综上所述,本研究建议临床控制恶性肿瘤患者的血糖水平。怀疑恶性肿瘤合并BSI时,应考虑病原菌的分布规律,早期合理用药,关注血培养结果。同时主动监测患者的血糖水平,以协助判断感染与预后,调整治疗方案。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]黄 璜, 孙培元, 邹开勇, 等. 中国恶性肿瘤一级预防现状与展望[J]. 中华肿瘤杂志, 2022, 44(9): 942-949.
HUANG H, SUN P Y, ZOU K Y, et al. Current situation and prospect of primary prevention of cancer in China[J]. Chin J Oncol, 2022, 44(9): 942-949.
[2]WANGW J, ZHANGX L. Stat-quo and disease burden of cancer in China[J]. China Policy Review, 2019, (4): 63-73.
[3]QIU H B, CAO S M, XU R H. Cancer incidence, mortality, and burden in China: a time-trend analysis and comparison with the United States and United Kingdom based on the global epidemiological data released in 2020[J]. Cancer Commun (Lond), 2021, 41(10): 1037-1048.
[4]SØGAARD M, NØRGAARD M, DETHLEFSEN C, et al. Temporal changes in the incidence and 30-day mortality associated with bacteremia in hospitalized patients from 1992 through 2006: a population-based cohort study[J]. Clin Infect Dis, 2011, 52(1): 61-69.
[5]GUSTINETTI G, MIKULSKA M. Bloodstream infections in neutropenic cancer patients: a practical update[J]. Virulence, 2016, 7(3): 280-297.
[6]HIONG A, THURSKY K A, VENN G, et al. Impact of a hospital-wide sepsis pathway on improved quality of care and clinical outcomes in surgical patients at a comprehensive cancer centre[J]. Eur J Cancer Care (Engl), 2019, 28(3): e13018.
[7]陈竹凤, 林友成, 杨文韬, 等. 尿路感染相关血流感染的相关因素分析[J]. 中国卫生标准管理, 2018, 9(15): 31-33.
CHEN Z F, LINC C Y, YANG W T, et al. Analysis of related factors of urinary tract infection related bloodstream infection[J]. Chin Heal Standard Management, 2018, 9(15): 31-33.
[8]谢朝云, 熊 芸, 李忠华, 等. 神经外科病人血流感染危险因素分析[J]. 中国临床神经外科杂志, 2019, 24(1): 31-34.
XIE Z Y, XIONG Y, LI Z H, et al. Analysis of risk factors of bloodstream infection in Department of Neurosurgery[J]. Chin J Clin Neurosurg, 2019, 24(1): 31-34.
[9]张力苹, 谢维宁, 林 卉, 等. 恶性肿瘤合并血流感染患者的短期预后的影响因素[J]. 分子影像学杂志, 2021, 44(2): 370-377.
ZHANG L P, XIE W N, LIN H, et al. Influencing factors of short-term prognosis in patients with malignant tumor complicated with bloodstream infection[J]. J Mol Imaging, 2021, 44(2): 370-377.
[10]吴春兰. 恶性肿瘤合并血流感染的临床特点[J]. 中国医学创新, 2019, 16(27): 168-172.
WU C L. Clinical characteristics of malignant tumors complicated with bloodstream infection[J]. Med Innov China, 2019, 16(27): 168-172.
[11]中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320.
Ministry of Health of the People's Republic of China. Diagnostic standards for hospital infection (trial) [J]. Chin J Med, 2001, 81(5): 314-320.
[12] LAMY B, SUNDQVIST M, IDELEVICH E A, et al. Blood stream infections-standard and progress in pathogen diagnostics[J]. Clin Microbiol Infect, 2020, 26(2): 142-150.
[13] 尚 红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 4版.北京: 人民卫生出版社, 2015.
SHANG H, WANG Y S, SHEN Z Y, National clinical laboratory operating regulations [M]. Version 4. Beijing: People's Health Publishing House, 2015.
[14] 常彦敏, 肖伟强, 孙明月, 等. 肿瘤患者血流感染病原菌分布及耐药性分析[J]. 实验与检验医学, 2022, 40(3): 268-270, 279.
CHANG Y M, XIAO W Q, SUN M Y, et al. Distribution of pathogens and analysis on resistance in bloodstream infection of patients with cancer[J]. Exp Lab Med, 2022, 40(3): 268-270, 279.
[15] AMANATI A, SAJEDIANFARD S, KHAJEH S, et al. Bloodstream infections in adult patients with malignancy, epidemiology, microbiology, and risk factors associated with mortality and multi-drug resistance[J]. BMC Infect Dis, 2021, 21(1): 636.
[16] 全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年血标本病原菌耐药性变迁[J]. 中国感染控制杂志, 2021, 20(2): 124-133.
China Antimicrobial Resistance Surveillance System. Change in antimicrobial resistance of pathogens from blood specimens: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chin J Infect Control, 2021, 20(2): 124-133.
[17] MASCHMEYER G, BRAVENY I. Review of the incidence and prognosis of Pseudomonas aeruginosa infections in cancer patients in the 1990 s[J]. Eur J Clin Microbiol Infect Dis, 2000, 19(12): 915-925.
[18] CARRERAS E, VÁZQUEZ L, RODRÍGUEZ TUDELA J L, et al. Update on fungemia in oncology and hematology[J]. Enferm Infecc Microbiol Clin, 2011, 29(Suppl 4): 42-47.
[19] 王一栋, 王双双, 郑永克. 铜绿假单胞菌血流感染临床特点和死亡危险因素分析[J]. 浙江临床医学, 2018, 20(7): 1244-1246.
WANG Y D, WANG S S, ZHENG Y K. Clinical characteristics and risk factors of death of Pseudomonas aeruginosa bloodstream infection[J]. Zhejiang Clin Med J, 2018, 20(7): 1244-1246.
[20] 张 黎, 刘正印, 徐英春, 等. 70例真菌血症的临床特点分析[J]. 中华内科杂志, 2012, 51(12): 952-956.
ZHANG L, LIU Z Y, XU Y C, et al. The clinical characteristics of 70 cases of fungemia[J]. Chin J Intern Med, 2012, 51(12): 952-956.
[21] 王学满, 陈中举, 田 磊, 等. 泌尿系统感染合并血流感染高危因素探讨[J]. 中国实验诊断学, 2021, 25(9): 1285-1287.
WANG X M, CHEN Z J, TIAN L, et al. Investigation of the high risk factors of urinary tract infection combined with bloodstream infection[J]. Chin J Lab Diagn, 2021, 25(9): 1285-1287.
[22] 李晓东, 李欣悦, 李宝新, 等. 保定地区维持性血液透析糖尿病患者带cuff透析导管相关性血流感染的危险因素研究[J]. 临床肾脏病杂志, 2021, 21(5): 353-357.
LI X D, LI X Y, LI B X, et al. Risk factors of catheter-related bloodstream infection associated with chronic hemodialysis diabetics with cuffed dialysis catheter in Baoding area[J]. J Clin Nephrol, 2021, 21(5): 353-357.
[23] JEON C Y, FURUYA E Y, SMALDONE A, et al. Postadmission glucose levels are associated with healthcareassociated bloodstream infections and pneumonia in hospitalized patients with diabetes[J]. J Diabetes Complications, 2012, 26(6): 517-521.
[24] PATEL T S, COTTREAU J M, HIRSCH E B, et al. Impact of hyperglycemia on outcomes of patients with Pseudomonas aeruginosa bacteremia[J]. Diagn Microbiol Infect Dis, 2016, 84(2): 155-158.
[25] 邵素花, 万娅莉, 林 莉, 等. 急性胰腺炎患者应激性高血糖与免疫功能以及临床预后的关系研究[J]. 华南国防医学杂志, 2021, 35(4): 262-265.
SHAO S H, WAN Y L, LIN L, et al. Effects of stress hyperglycemia on immune dysfunction and clinical prognosis in acute pancreatitis patients[J]. Mil Med J South China, 2021, 35(4): 262-265.
[26] 邓其浪, 杨 煌, 梁 丹, 等. 糖尿病高血糖持续时间对大鼠体液免疫功能的影响[J]. 广东医学, 2018, 39(14): 2114-2116, 2121.
DENG Q L, YANG H, LIANG D, et al. Effects of duration of hyperglycemia on the humoral immune function in diabetic rats[J]. Guangdong Med J, 2018, 39(14): 2114-2116, 2121.
[27] CASQUEIRO J, CASQUEIRO J, ALVES C. Infections in patients with diabetes mellitus: a review of pathogenesis[J]. Indian J Endocrinol Metab, 2012, 16(Suppl1): S27-S36.
[28] ATAMNA A, AYADA G, AKIROV A, et al. High blood glucose variability is associated with bacteremia and mortality in patients hospitalized with acute infection[J]. QJM, 2019, 112(2): 101-106.
[29] PLUMMER M P, DEANE A M. Dysglycemia and glucose control during sepsis[J]. Clin Chest Med, 2016, 37(2): 309-319.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









可否尝试用中医的方法试一下。
23