J Hepatol:中国科学技术大学刘连新/王嘉倍/胡青松等合作鉴定肝细胞癌微环境中的肿瘤免疫屏障
2023-01-30 iNature iNature 发表于上海
肝细胞癌(Hepatocellular carcinoma,HCC)是肝癌最常见的组织学亚型,也是导致癌症相关死亡的第三大原因。
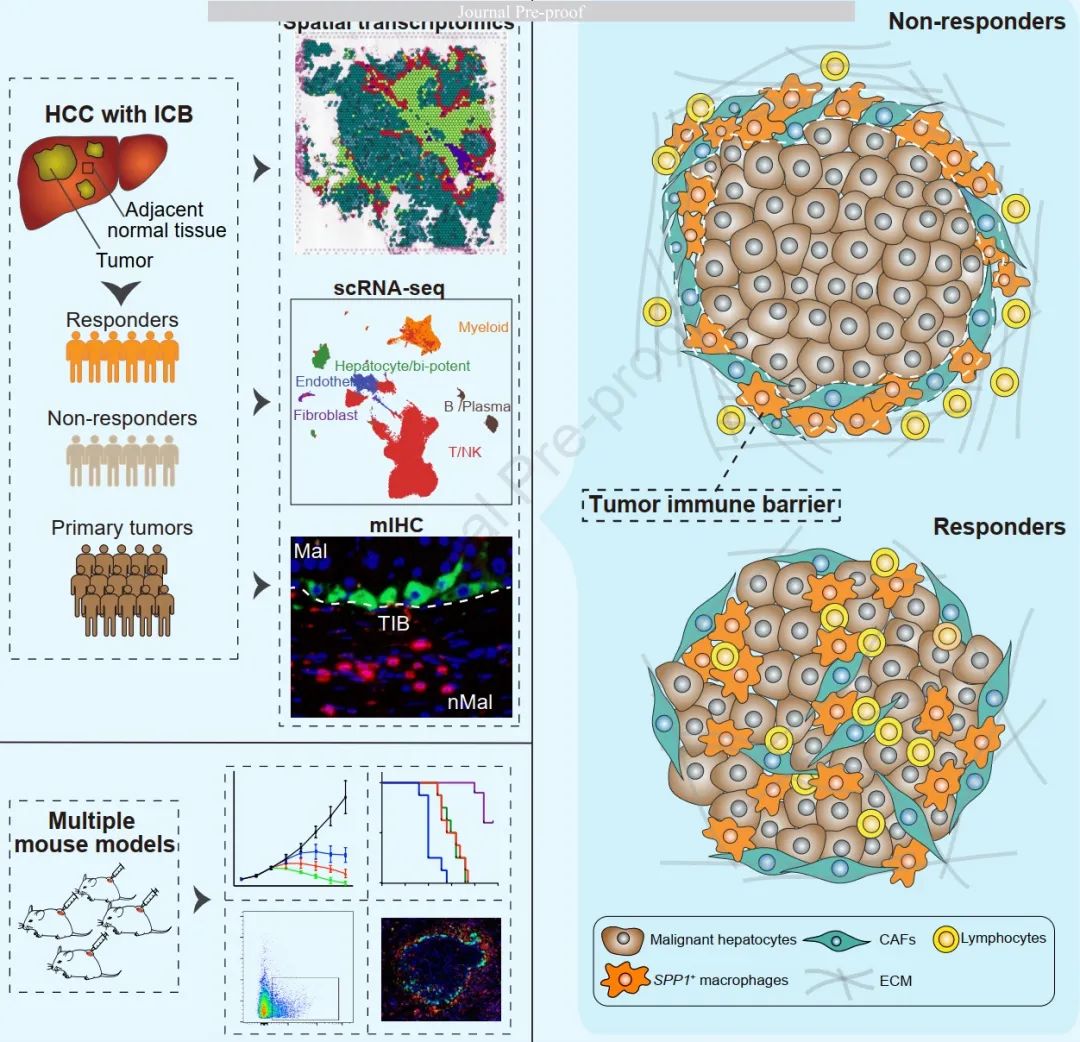
肝细胞癌(Hepatocellular carcinoma,HCC)是肝癌最常见的组织学亚型,也是导致癌症相关死亡的第三大原因。虽然可切除的HCC患者可通过手术切除或肝移植治疗,晚期不可切除的HCC患者可使用索拉非尼治疗,但这些肿瘤在治疗后容易复发。免疫检查点封锁(immune checkpoint blockade,ICB)治疗的革命性进展,如抗PD-1/L1和抗CTLA4抗体,延长了多种癌症患者的生存期。尽管人们已经做出了许多努力来提高HCC免疫治疗的临床获益,特别是具有不同细胞溶解活性的T细胞,但ICB在HCC患者中的反应仍然有限。 肿瘤微环境(tumour microenvironment,TME)是肿瘤进展和治疗结果的重要中介。在多种癌症中,TME亚型与患者对免疫治疗的反应相关。以往的研究大多集中在与免疫治疗疗效相关的TME中不同细胞成分的作用。然而,TME的具体结构及其在免疫治疗疗效中的作用在很大程度上仍然未知。 2023年1月25日,中国科学技术大学刘连新、王嘉倍、胡青松与上海交通大学叶幼琼合作在Journal of Hepatology 杂志在线发表题为“Identification of a tumour immune barrier in the HCC microenvironment that determines the efficacy of immunotherapy”的研究论文,该研究发现SPP1+巨噬细胞与CAFs相互作用形成的TIB结构与免疫治疗疗效相关。因此,通过阻断SPP1破坏TIB结构可能被认为是增强ICB治疗HCC疗效的相关治疗方法。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言