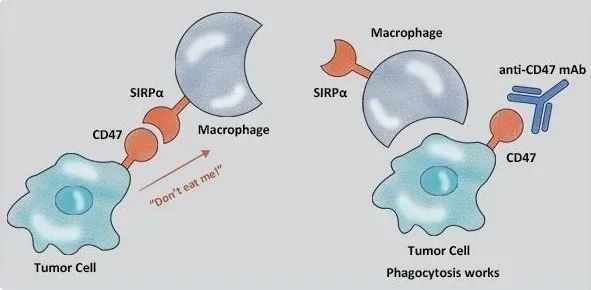
精准医学的价值——罕见肿瘤末线疗效优于前线
2023-04-24 NCCGCP1962 网络 发表于上海
精准原则指导下的临床研究为患者带来显著获益,也希望后续积累更多的临床病例,为KIT突变的罕见肿瘤患者提供治疗借鉴。
基因突变是导致肿瘤的重要因素,精准的基因检测对肿瘤的临床诊疗至关重要。当前,基于基因分型指导下的精准诊疗可以为肿瘤患者带来更多的获益。采用分子分型指导后续治疗,可能突破瘤种的限制,为标准治疗失败的晚期或转移性罕见实体瘤患者的治疗提供新思路。在此分享基因分型指导精准治疗中国罕见肿瘤的平台(PLATFORM)研究的一例晚期黑色素瘤病例,初诊即存在肺部多发转移,快速出现脑转移,多线治疗效果均不佳,根据基因检测结果:KIT 外显子17 N822K突变及KIT扩增,入组后给予瑞派替尼(新型KIT/PDGFRA开关控制酪氨酸激酶抑制剂)治疗,肺部病灶及脑转移病灶稳定控制近10个月,且安全性和耐受性好。精准原则指导下的临床研究为患者带来显著获益,同时为KIT突变的罕见肿瘤患者提供治疗借鉴。
病例简介
基本情况
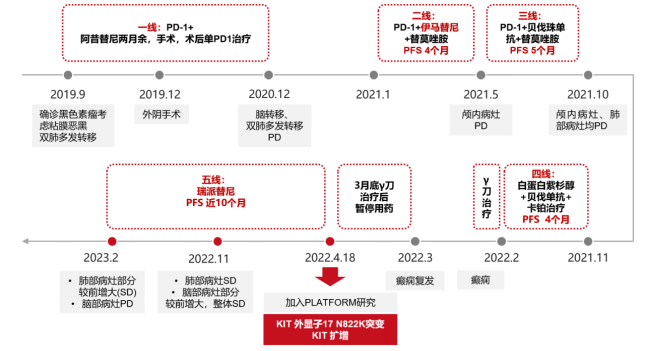
女,38岁,2019年9月发现外阴肿物,活检病理示明确粘膜恶性黑色素瘤。分期检查提示肺部多发转移。
治疗经过
-
2019年10月,入组PD-1联合阿昔替尼的粘膜恶性黑色素瘤的临床研究。
-
2019年12月,行外阴手术,术后继续接受单药PD-1治疗。
-
2020年12月,MRI示右侧颞叶外侧裂处可见类圆形病灶影,考虑颅内转移;PFS=12个月。
-
2021年1月,开始二线PD-1+伊马替尼+替莫唑胺治疗。
-
2021年3月,MRI示右侧颞叶结节状强化信号,直径约0.6cm,;CT示双肺结节,最大者位于左上肺,约1.1*1.1cm,综合评效SD。
-
2021年5月,MRI示右侧颞叶病灶较前增大,直径约1.45cm,右侧颞部硬脑膜、大脑镰中部增厚并强化,不除外转移;CT示双肺结节,左上肺结节1.4cm,脑转移和肺转移病灶均进展,综合评效PD。二线治疗PFS=4个月。更换为三线治疗方案:PD-1+贝伐珠单抗+替莫唑胺。
-
2021年10月,MRI示颅内病灶较前增大,CT示肺部病灶较前增大,左上肺小结节约1.7cm,较前增大,综合评效PD。PFS=5个月。
-
2021年11月,开始四线白蛋白紫杉醇+贝伐单抗+卡铂治疗。
-
2022年2月,MRI示右侧颞叶病灶增大至2.5cm,行γ刀治疗后出现癫痫。
-
2022年3月,复查MRI示右侧颞叶占位缩小(直径1.3cm),双侧额顶叶、右侧半卵圆中心高信号影考虑转移,3月30号 行γ刀治疗治疗后停止四线治疗;PFS=4个月。
-
基因检测:KIT 外显子17 N822K突变,KIT 扩增,入组罕见肿瘤研究筛选“基因分型指导精准治疗中国罕见肿瘤的平台(PLATFORM)研究”。
-
2022年4月18日,五线瑞派替尼 150mg QD治疗。
-
2022年5月27日,疗效评估SD,不良反应均为1级,耐受性良好;每月复查,肺部病灶及脑部病灶均SD。
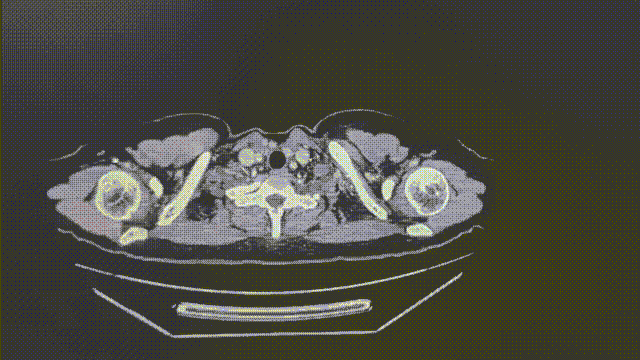
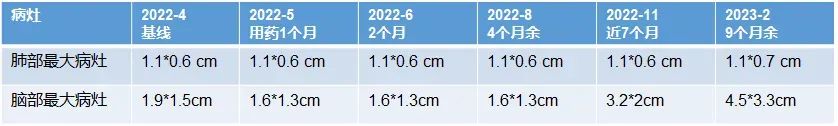
2022-4-11(基线)
1.1*0.6cm
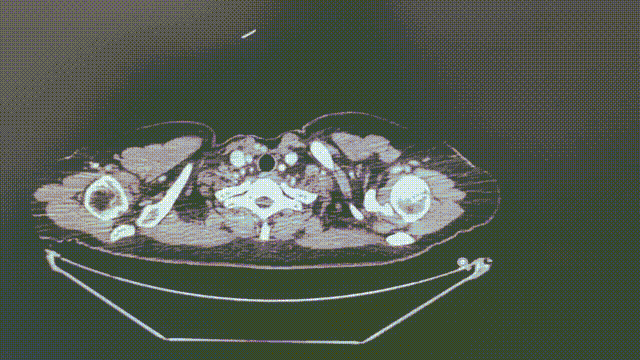
2022-5-17(1个月)
1.1*0.6cm
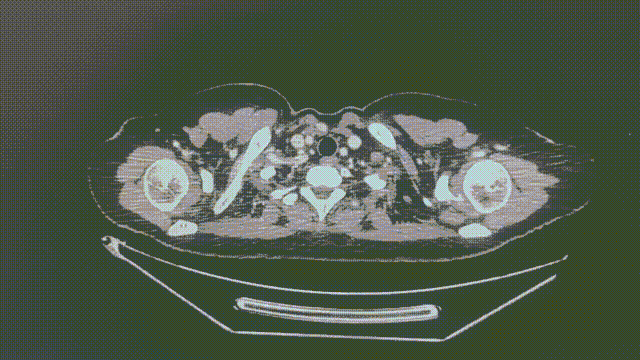
2022-6-27(2个月)
1.1*0.6cm
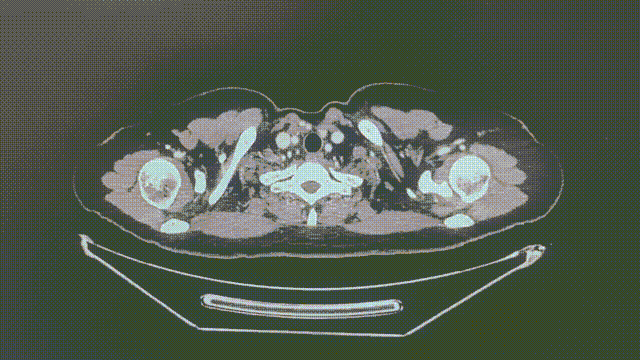
2022-8-29 (4个月余)
1.1*0.6cm
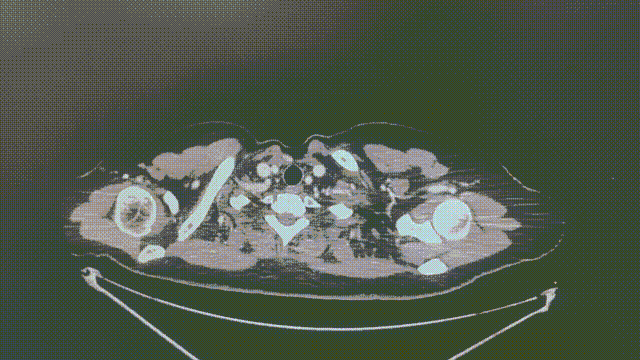
2022-11-8 (近7个月)
1.1*0.6cm
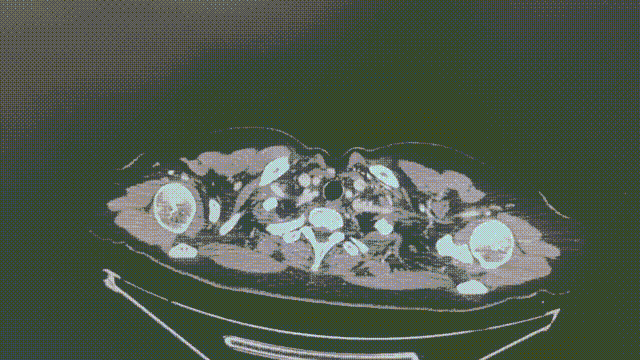
2023-2-2 (9月余)
1.1*0.7cm
瑞派替尼治疗经过
CT增强扫描—肺部病灶稳定
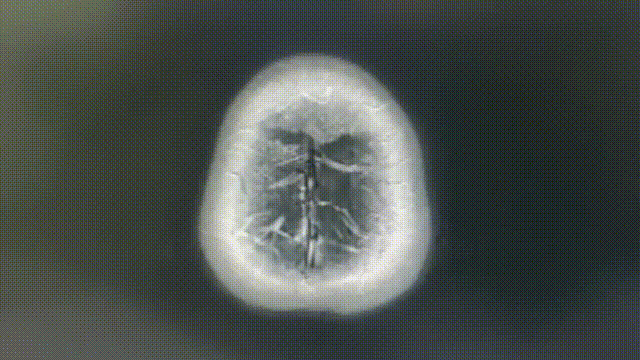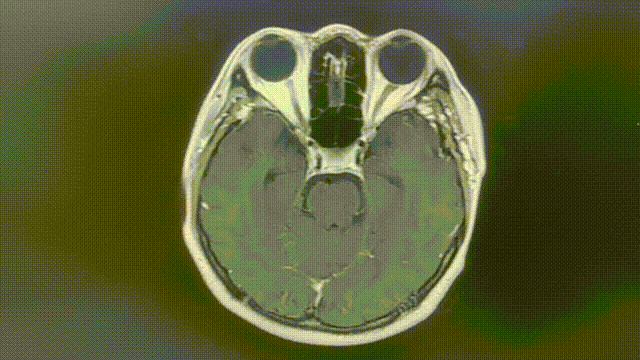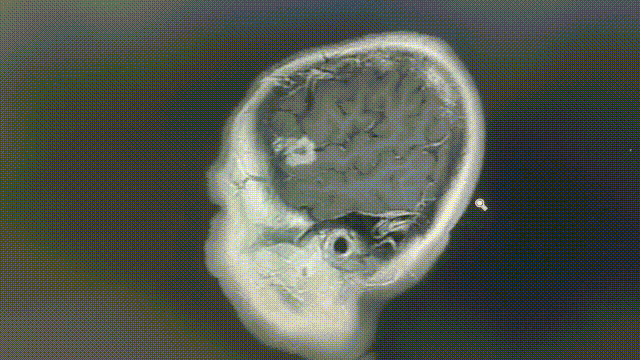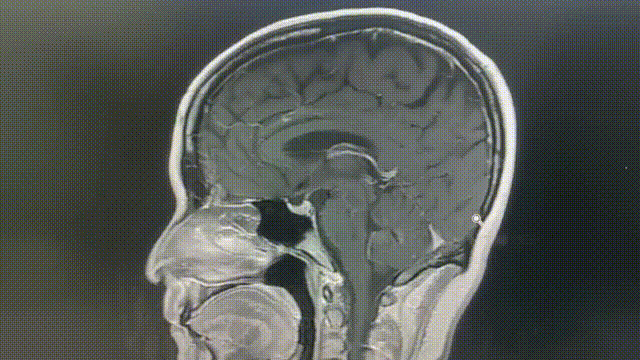
2022-4-12(基线)
1.9*1.5cm

2022-5-18(1个月)
1.6*1.3cm
2022-6-28(2个月)
1.6*1.3cm

2022-8-31(4个半月)
1.6*1.3cm
2022-11-9(近7个月)
3.2*2cm
瑞派替尼治疗经过
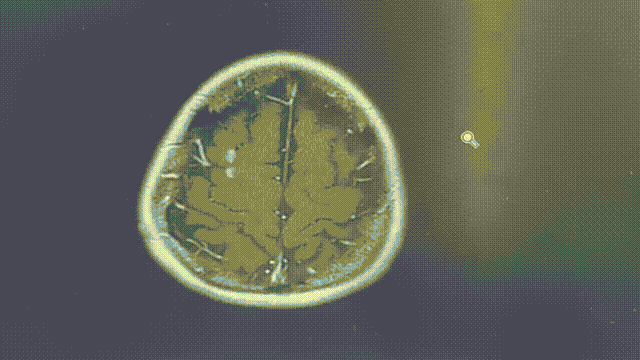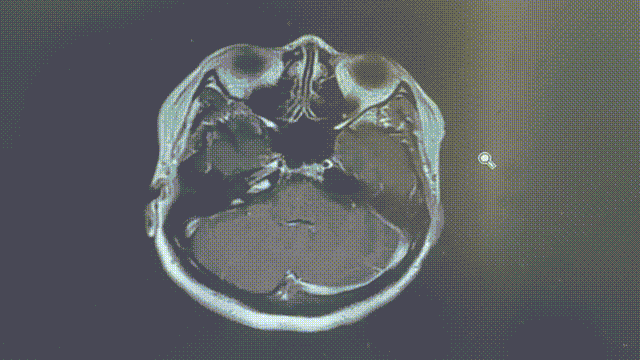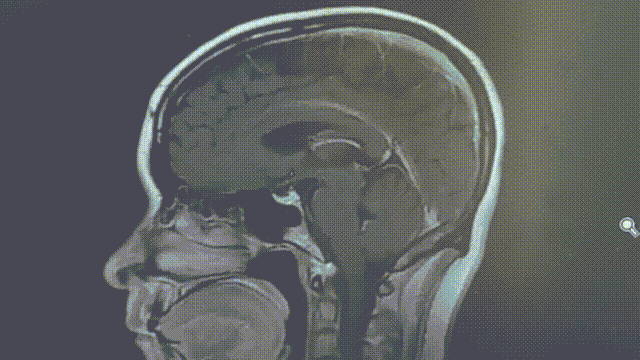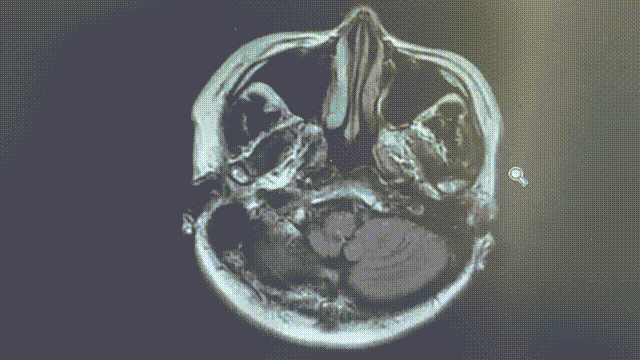
MRI——脑部病灶稳定
-
2022年11月8/9日,胸部CT示双肺多发转移瘤同前相仿,MRI示双侧大脑半球多发转移瘤,部分较前增大,大者约3.2cm。综合评效SD。
-
2023年1月31日,MRI示双侧大脑半球多发转移瘤,大部分较前增大,部分同前大致相仿,个别较前减小,大者约4.5cm;2023年2月7日,胸部CT示双肺多发转移灶部分较前增大,左上肺 1.1*0.7cm。综合评效考虑PD。
-
五线瑞派替尼PFS近10个月。
瑞派替尼使用期间患者肺部、脑部最大病灶变化
患者诊疗小结
专家点评
李宁教授:
罕见肿瘤单病种发病率低,存在诊断难、治疗难、试验难、共识难,但中国罕见实体瘤整体发病率较高,依据中国发病率情况分析,前18位的常见肿瘤占85.8%,而发病率低于2.5/100,000患者的肿瘤共有77种,总计560830人,占全部肿瘤患者的14.2%(数据来自国家癌症中心,肿瘤登记办公室)。中国罕见肿瘤发病总数量并不低,且整体治疗效果不佳。目前靶向治疗是肿瘤治疗的重要手段,cBioPortal数据库中的4901例罕见肿瘤患者可以检索到的治疗靶点突变率为20.4%,而中国人群中的突变率更高为53.43%,中国罕见肿瘤的可作用靶点变异发生率高。
本研究是一项在既往接受过标准治疗或无标准治疗的晚期罕见实体瘤中的开放性、非随机、多组别、单臂、单中心II期临床研究(PLATFORM),采用分子分型指导后续治疗,突破瘤种的限制,解决随机对照临床试验(Randomized Clinical Trial,RCT)研究对象的招募困难的问题。同时,平台研究综合了篮子研究和伞式研究的优势,通过跨瘤种多药物同时筛选的模式,进一步提高了研究效率,在较大程度上解决了罕见肿瘤研究难的问题。
瑞派替尼是一种新型的广谱KIT和PDGFRA开关控制酪氨酸激酶抑制剂1,高效、精准、低毒。2021年3月31日,中国国家药品监督管理局批准瑞派替尼用于胃肠间质瘤的≥四线治疗,目前NCCN指南、CSCO指南、ESMO指南中均对瑞派替尼作为GIST四线治疗的一级推荐,且CSCO和NCCN指南推荐瑞派替尼作为晚期GIST患者的二线治疗选择。
王书航教授:
目前已公布的临床数据显示,瑞派替尼具有令人鼓舞的抗肿瘤活性,可精准且广谱的抑制KIT和PDGFRA突变,且具有很好的安全性,患者耐受性好2-4,因此在治疗KIT突变的罕见肿瘤方面是一个值得尝试的研究方向。
约3%黑色素瘤患者发生KIT突变(突变或扩增),常见于粘膜型(约30%)、肢端型(20%)和慢性日光损伤型皮肤(20%)的黑色素瘤5,6。中国黑色素瘤患者KIT突变发生率较高(约为10.8%),生存结局相对较差7。既往研究评估了KIT抑制剂(如伊马替尼、舒尼替尼、达沙替尼和尼洛替尼)用于KIT突变转移性黑色素瘤患者的疗效,客观缓解率(ORR)为16%-30%,中位无进展生存期(PFS)为3-6个月8,9。瑞派替尼I期研究(NCT102571036)扩展阶段中,入组了26例KIT突变的转移性黑色素瘤患者接受瑞派替尼起始剂量150mg每日一次(QD)治疗,结果显示,瑞派替尼用于KIT突变转移性黑色素瘤患者具有良好的疗效,确认的ORR为23%,中位PFS为7.3个月,中位缓解持续时间为9.1个月10。瑞派替尼对肿瘤缓解因既往KIT抑制剂治疗的暴露而不同:在未接受过KIT抑制剂治疗的17例患者中,确认的ORR为29.4%(1例CR,4例PR),中位PFS为10.2个月(95% CI 1.8,NE);在既往接受过KIT抑制剂治疗的9例患者中,确认的ORR为11.1%(1例PR),中位PFS为2.9个月(95%CI 0.6,NE)。瑞派替尼用于KIT突变转移性黑色素瘤具有可接受的安全性,与获批GIST适应症中一致,也表明,瑞派替尼用于治疗KIT突变转移性黑色素瘤患者可能有重要的临床作用。
黑色素瘤中的KIT突变类型呈现高度异质性,热点突变(包括靶向L576、K642、F483和V559的突变)仅占KIT突变的40%左右,还包括KIT 外显子13和17等多个位点的突变7,11,而基于晚期胃肠间质瘤中的研究表明,KIT 外显子13和17突变,常常是伊马替尼的继发耐药位点,这些位点的突变对伊马替尼是不敏感的12,13,而瑞派替尼是一个靶向KIT和PDGFRA开关控制抑制剂,可广泛的抑制KIT/PDGFRA各种原发和继发突变类型1,2,14
另外,既往数据显示黑色素瘤脑转移 (MBM) 患者的预后较差,预期总生存期 (OS) 较短,取决于突变状态等因素,多种疗法对黑色素瘤脑转移病灶均疗效有限,替莫唑胺 (TMZ) 化疗单药治疗的 PFS 为1.9个月,如果联合WBRT,改善至4.7个月,免疫治疗单药治疗的加权中位 PFS 为3.1个月等15。
本例黑色素瘤患者,初诊即存在肺部多发转移,快速出现脑转移,多线治疗效果均不佳,根据基因检测结果:KIT 外显子17 N822K突变及KIT扩增,入组后给予瑞派替尼(新型KIT/PDGFRA开关控制酪氨酸激酶抑制剂)治疗,肺部病灶及脑转移病灶稳定控制近10个月,且安全性和耐受性好。精准原则指导下的临床研究为患者带来显著获益,也希望后续积累更多的临床病例,为KIT突变的罕见肿瘤患者提供治疗借鉴。
特别致谢:
北京大学肿瘤医院 黑色素瘤与肉瘤内科 斯璐教授
再鼎医药
参考文献:
1. Smith BD, Kaufman MD, Lu WP, et al. Ripretinib (DCC-2618) Is a Switch Control Kinase Inhibitor of a Broad Spectrum of Oncogenic and Drug-Resistant KIT and PDGFRA Variants. Cancer Cell 2019; 35(5): 738-51.e9.
2. Blay JY, Serrano C, Heinrich MC, et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2020; 21(7): 923-34.
3. Li J, Cai S, Zhou Y, et al. Efficacy and Safety of Ripretinib in Chinese Patients with Advanced Gastrointestinal Stromal Tumors as a Fourth- or Later-Line Therapy: A Multicenter, Single-Arm, Open-Label Phase II Study. Clin Cancer Res 2022; 28(16): 3425-32.
4. Mehren M, Heinrich M, George S, et al. 1540P Ripretinib as ≥4th-line treatment in patients with advanced gastrointestinal stromal tumor: Long-term update from the phase III INVICTUS study. Annals of Oncology 2021; 32: S1120-S1.
5. Curtin JA, Busam K, Pinkel D, Bastian BC. Somatic activation of KIT in distinct subtypes of melanoma. J Clin Oncol 2006; 24(26): 4340-6. Beadling C, Jacobson-Dunlop E, Hodi FS, et al. KIT gene mutations and copy number in melanoma subtypes. Clin Cancer Res 2008; 14(21): 6821-8.
7. Kong Y, Si L, Zhu Y, et al. Large-scale analysis of KIT aberrations in Chinese patients with melanoma. Clin Cancer Res 2011; 17(7): 1684-91.
8. Yang J, Komatsubara KM, Carvajal RD. JAK-ing up the Response to KIT Inhibition. J Invest Dermatol 2018; 138(1): 6-8.
9. McKean M, Oba J, Ma J, et al. Tyrosine Kinase Inhibitor and Immune Checkpoint Inhibitor Responses in KIT-Mutant Metastatic Melanoma. J Invest Dermatol 2019; 139(3): 728-31.
10. Janku F, Bauer S, Shoumariyeh K, et al. 1082P Phase I study of ripretinib, a broad-spectrum KIT and PDGFRA inhibitor, in patients with KIT-mutated or KIT-amplified melanoma. Annals of Oncology 2021; 32: S896-S7.
11. Woodman SE, Davies MA. Targeting KIT in melanoma: a paradigm of molecular medicine and targeted therapeutics. Biochem Pharmacol 2010; 80(5): 568-74.
12. Blay JY, Kang YK, Nishida T, von Mehren M. Gastrointestinal stromal tumours. Nat Rev Dis Primers 2021; 7(1): 22.
13. Dermawan JK, Rubin BP. Molecular Pathogenesis of Gastrointestinal Stromal Tumor: A Paradigm for Personalized Medicine. Annu Rev Pathol 2022; 17: 323-44.
14. Bauer S, Heinrich MC, George S, et al. Clinical Activity of Ripretinib in Patients with Advanced Gastrointestinal Stromal Tumor Harboring Heterogeneous KIT/PDGFRA Mutations in the Phase III INVICTUS Study. Clin Cancer Res 2021; 27(23): 6333-42.
15. van Opijnen MP, Dirven L, Coremans IEM, Taphoorn MJB, Kapiteijn EHW. The impact of current treatment modalities on the outcomes of patients with melanoma brain metastases: A systematic review. International Journal of Cancer 2020; 146(6): 1479-89.
作者:李宁教授、王书航教授
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言