【绘真科普】聚焦遗传病基因检测,细说全外和医学全外检测的临床应用
2024-01-04 苏州绘真医学 苏州绘真医学 发表于陕西省
在各种导致出生缺陷的原因中,单基因遗传病占有相当比例。强调了单基因遗传病的诊断和预防不容小视。
白化病、血友病、红绿色盲、佝偻病...这一个个单基因遗传病的背后实则隐藏了无数患者家庭的痛苦。在2012年的《中国出生缺陷防治报告》中提到[1],我国出生缺陷发生率在5.6%左右,每年将新增90万的新生缺陷儿。在各种导致出生缺陷的原因中,单基因遗传病占有相当比例。强调了单基因遗传病的诊断和预防不容小视。

一、怎样理解单基因遗传病?
所谓单基因遗传病,是指受一对等位基因控制,能够稳定遗传的先天性疾病。也就是说,仅一个基因的变异就能够导致疾病的发生。现阶段,已经明确了将近一万种单基因遗传病,并且每年仍在持续增多中。
单基因遗传病具有哪些发病特点?
-
发病率低,整体发病率约为1/100;
-
伤害性大,单基因遗传病会致死、致残、致畸率高;
-
治疗率低,仅5%的疾病有治疗药物,且费用昂贵;
-
遗传模式多,具备一定的遗传特征,如伴性遗传,遗传概率多样;
-
涉及范围广,正常人也可能携带致病基因突变(隐性遗传携带者)。
单基因遗传病具有哪些遗传方式?
-
常染色体显性遗传(AD):携带即患病,遗传与性别无关,男女发病机会均等;
-
常染色体隐性遗传(AR):遗传自父母双方突变才患病,与性别无关,男女发病机会均等;
-
伴X连锁显性遗传(XLD):携带即患病,母亲遗传儿子和女儿,父亲只遗传女儿;
-
伴X连锁隐性遗传(XLR):女儿同时遗传父母双方突变才患病,母亲患病儿子也患病;
-
伴Y连锁遗传(Y-link):父系遗传,只发生在男性,且在男性家系中世代遗传;
-
线粒体遗传(mtDNA):母系遗传,母亲遗传给子女,且在女性家系中世代遗传。
针对单基因遗传病的诊断,传统上依赖于系谱分析、生化、影像等手段评估,但由于疾病间的共性,导致精准度不佳,往往出现误诊、漏诊的可能,并且诊断周期长。近年来,Sanger、NGS等分子诊断技术通过基因层面,为遗传病提供了更精准的诊断依据,成为其主要辅助诊断方式。与此同时,基因检测还能为一些遗传病的预后危险分层、治疗策略制定、遗传筛查以及选择性生育等方面有深刻的指导意义。
二、全外显子组和医学全外检测如何应用于遗传病诊断?
目前,已证实,人类基因组编码2万多个基因,每个基因都包含基因的外显子(exon)和内含子(intron)两个区域,两者相互交错。其中,外显子仅占比10%,编码氨基酸翻译成功能性蛋白质,涵盖了与个体表型相关的大部分功能性变异。外显子区的致病性变异往往被认为与蛋白质的功能改变直接相关,且能够覆盖85%以上的单基因遗传病。而内含子则不编码蛋白质,更多的是参与基因表达的调控,对功能改变影响较小。因此,通过全外显子组检测编码蛋白的基因突变,能够较全面地从根本上明确患者的致病原因和遗传风险。

图1 基因如何编码蛋白质
那么,什么是全外显子组检测(Whole Exome Sequencing,WES)和医学全外显子组检测(Medical WES,mWES)?
所谓全外显子组检测,顾名思义,就是指检测人类2万多个基因的全部外显子区域,覆盖合成蛋白质所需要的重要信息,分析基因外显子,找到与表型相关的基因突变。而医学外显子组检测(mWES),也是属于全外显子检测的范畴,只是将OMIM等数据库中报道已经确认的致病基因,大约5000个,放在一起,检测这些基因的全部外显子。因此,相对而言,mWES策略更像是WES检测的缩小聚焦版,包含的是检测基因数目较少,成本也相对低廉。
自然而然,相对于mWES而言,WES能够在其基础上,扩大检测范围,能有机会发现新的候选致病基因。尤其对于那些临床表型复杂、表型不特异、诊断不明或表型展示不全的患者,WES是更为理想的检测手段。而且像这些临床表型诊断困难的患者,通过一家三口同步行WES检测,分析家系成员与基因突变的遗传连锁关系,会提高部分突变的致病性证据,对患者致病基因的查找及疾病的确诊更具优势,也有助于临床的科研探索!关于全外显子检测和医学全外显子检测的详细区别,可以关注图2。
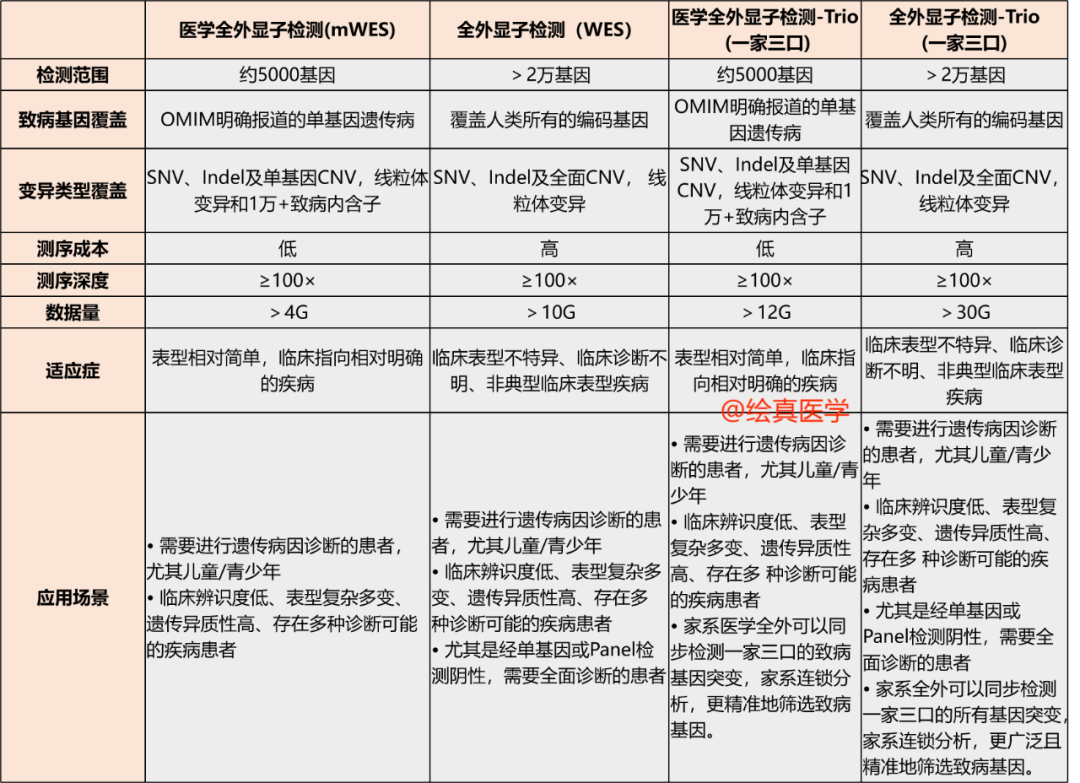
图2 我司WES和mWES的介绍(不代表业界全部)
三、全外显子/医学全外检测遗传病有什么不足?
随着检测技术的发展,全外显子组检测采用的NGS技术可同时实现大量靶基因检测及多种遗传病的分析,实现了省时和便捷的检测策略,满足检测基因的单核苷酸变异(SNV)、小片段变异(indel)及基因扩增(CNV)等。可以满足绝大部分遗传病病因查找的基本需求。但由于技术方法学的限制,确实存在一些特殊的变异类型或同源基因的检测,单纯依靠NGS检测还不够,需要全外显子联合其他方法学检测。在此,我们结合指南举出典型案例。
在2019版《罕见病诊疗指南》中提到[2],以下多种单基因遗传病除了在全外显子检测之外,仍需采用MLPA检测基因大片段变异,进一步提高变异的检出率。包括遗传性痉挛性截瘫(SPAST基因)、天使综合征(UBE3A基因)、腓骨肌萎缩症(PMP22基因)、肝豆状核变性(ATP7B基因)、波伊茨-耶格综合征(STK11基因)、进行性肌营养不良(DMD基因)、囊性纤维化(CFTR基因)、视网膜母细胞瘤(RB1基因)、脊髓性肌萎缩症(SMA基因)等。
在脊髓小脑共济失调的诊断中,致病原因为基因的动态突变,动态突变类型需借助PCR-毛细管电泳方法实现准确检测。《遗传性共济失调诊断与治疗专家策略》中明确[3],需要通过PCR-毛细管凝胶电泳等方法确定AXTN3、AXTN2、AXTN1等基因编码序列中CAG的重复数,进行疾病的确诊和亚型判别(图3)。而X-连锁共济失调是由Xq27.3的FMR1基因内CGG三核苷酸重复扩增所致,重复次数55—200次者称为前突变(premutation),具有不完全外显率,若重复次数>200次则导致遗传性智力障碍的脆性X综合征。
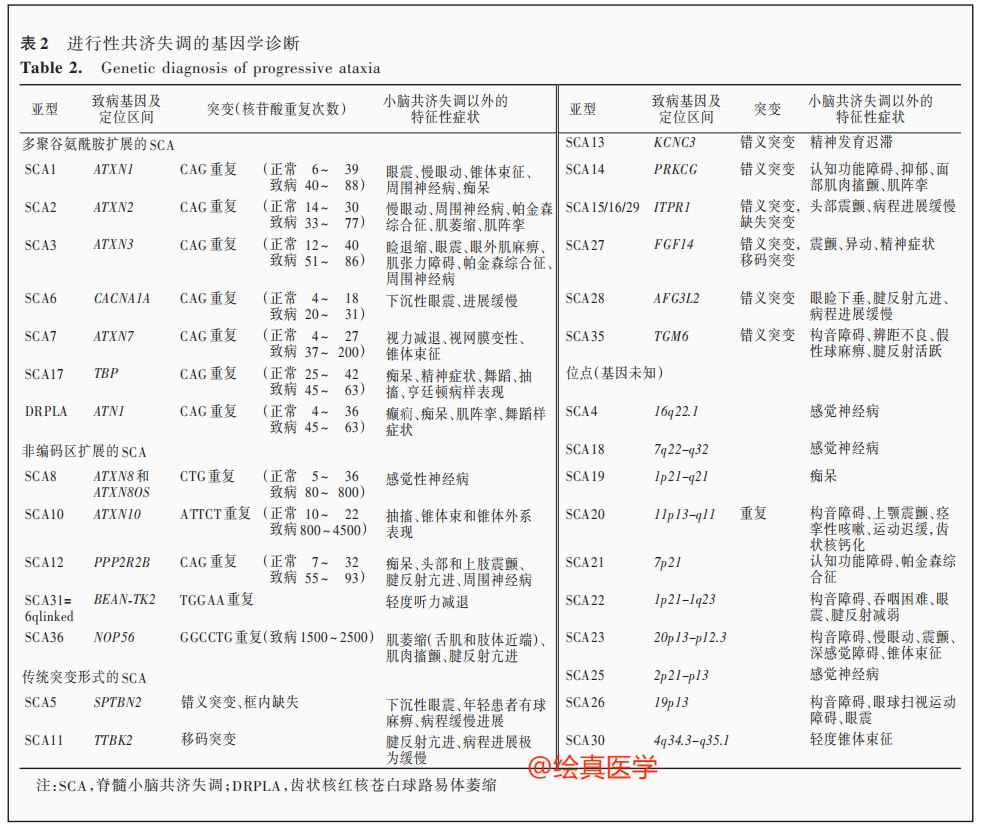
图3 共济失调的基因诊断
在常染色体显性多囊肾(ADPKD)中,主要基因PKD1存在序列同源性极高的假基因(假基因是指与已知功能基因序列相似,但不产生有功能产物的基因),这时WES检测对假基因的区分有难度,需要长片段PCR(Long range PCR)等其他方法学进行区分。在《多囊肾病的临床实践指南》基因筛诊断及筛查部分明确提到[4],目前主要采用长片段PCR+NGS技术对ADPKD患者进行突变检测,PKD基因突变的检出率约为90%,仍有10%的突变无法检出,可能还需要MLPA等方法学排查大片段变异。
因此,事实上,每种单基因遗传病在分子发病机制上都具有其自身独特特点。基于不同方法学各有所长,优势互补,采用多种方法学联合检测,能够全面分析分子异常致病机制,也是遗传病分子检测的发展方向。为此,我们结合文献[5],讲解部分检测技术的特点,见图4。另外,针对特定遗传病的检测方案见文末。
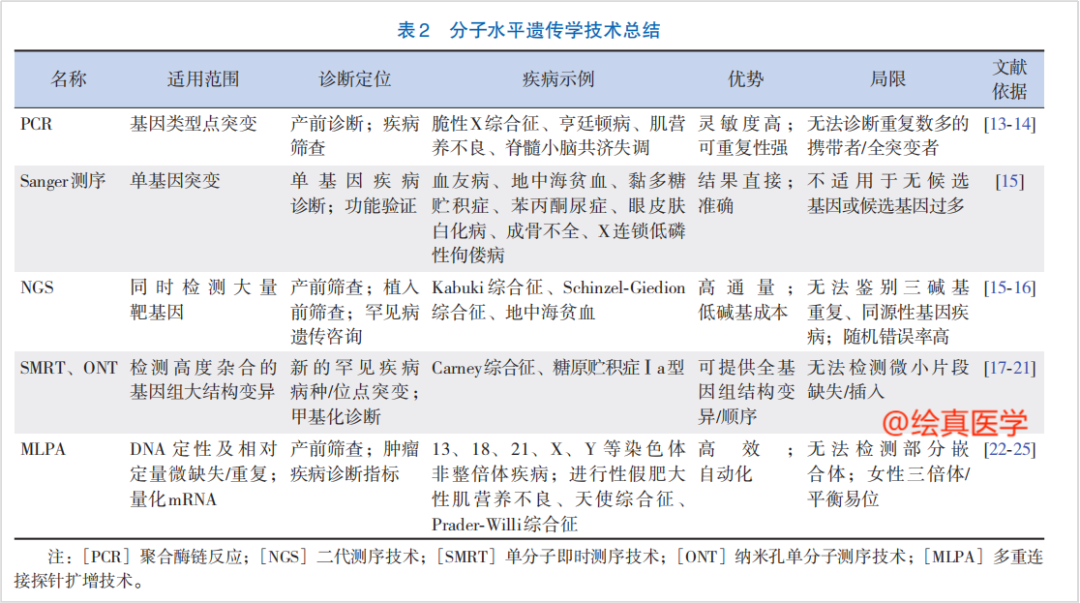
图4 遗传学分子检测技术总结
四、遗传病检测为什么需要提供全面的表型诊断?
首先,全外显子组基因检测全面覆盖了人类2万多个基因,包含了受检者所有的突变,那么检出的突变数目数以万计,需要结合患者的具体表型来进行筛选致病基因,如同大海捞针。因此,提供全面明确的临床表型,尤其是典型的临床表型,是WES检测分析的重要前提!否则,模糊或者错误的表型提供,则势必干扰分析方向和准确度[6]。
例如,发育迟缓是一个表型,但不具体,因为发育迟缓包括表现为智力障碍的精神发育迟缓,和身材矮小的肢体发育迟缓,还有说话迟钝的语言发育迟缓,抑或表现多发的多种发育迟缓,单单一个发育迟缓就涉及到运动系统、神经系统等多系统因素。那么这就是基因分析和解读的多个不同方向。而在解读分析端,实在是不怕前途坎坷,就怕方向找错!
所以,遗传病检测提供表型要尽量具体化,最好指向典型因素,提供具有决定性意义的特征表型。诸如上述患者,包括基本的身材表现、粗大动作和精细动作发育情况、生活适应能力、语言和社交行为能力的发展情况等,提供得越全越有利于检测结果的准确性。
2020年,发表在中华医学杂志的述评《中国人群遗传病基因型与表型数据库的建立对遗传病精准诊断的重要性》中就提到[7],遗传变异的精准解读需借助于基因型数据和表型数据,充分的表型信息将提高数据分析和变异解读的准确性。通过完善表型数据,促进基因型和表型数据的均衡发展,更加有利于遗传病的诊断。实验室需同临床医生良好沟通获得准确的表型信息,为提交高质量的表型数据提供保证(图5)。

图5 摘自《中国人群遗传病基因型与表型数据库的建立对遗传病精准诊断的重要性》
五、为什么器官移植的患者也要做遗传病全外显子检测?
作为现代医学的重大进步之一,器官移植工作使得很多因器官衰竭而危及生命的患者重获新生。如今,我国器官移植数量已经跃居全球第2位。目前移植术后排斥反应、原发病复发等是器官移植患者的关键问题。
研究证实,有明确遗传因素的患者和非遗传性患者移植后的复发率显著不同,移植前基因检测可以评估复发风险,也可为患者提供更个体化的治疗方法,有机会避免免疫抑制剂的使用从而防止相关不良反应。我们以临床相对常见的肾脏移植来举例。
根据临床数据[8],29.1%的激素耐药型肾病综合征(SRNS)患儿有明确的单基因突变。一项纳入1655例肾病患者(其中约80%为儿童患者)[9],最常见的病理诊断为局灶节段性肾小球硬化(56%),微小病变(21%)及系膜增生性肾小球肾炎(12%)。Alport综合征、脂蛋白肾病、多囊肾等单基因遗传病,都可能是导致这些疾病的原因(图6)。这提示移植科医师在评估病理类型为上述症状的患者时,应考虑其遗传的可能性。因此,亲属活体供肾是一种重要且谨慎的选择,遗传性肾病的家庭成员在活体移植前都应接受基因检测。如果遗传方式为AD,若没有排除家庭成员也存在基因突变的情况,不应将其视为活体亲属供体候选。若遗传方式为AR,也存在多种不稳定风险。
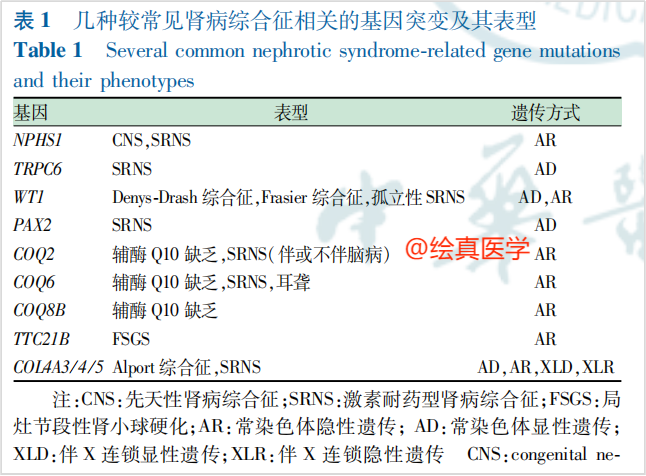
图6 常见的肾病综合征相关基因突变及表型
国际儿科肾脏病协会强调[10],如有可能,建议对候选活体肾移植供者行基因检测(图7),评估是否存在SRNS遗传背景(X,强推荐)。在排除COL4A等致病性杂合缺陷的供者后,携带其他隐性变异的亲属在进行遗传咨询并在取得完全知情同意后,才可考虑作为潜在的供者。不建议将显性基因致病变异或可能致病变异携带者(无论是否有症状)作为肾移植供者(X,强推荐)。
除了预后复发指导之外,在肾移植术后用药上,他克莫司(Tacrolimus,FK506)作为一种有效的免疫抑制药物,是肾移植术后免疫维持方案的基础用药之一。通过药物基因组学证实[11],CYP3A5蛋白是影响他克莫司代谢的关键酶,CYP3A5基因6986 A/G是CYP3A5最常见的突变位点,该位点GG基因型(CYP3A5 *3/*3)表现为他克莫司代谢性慢,降压效果最好,AG组(CYP3A5 *1/*3)次之,AA组(CYP3A5 *1/*1)较差。目前,国内外相关指南均推荐,要达到相同的药物浓度,携带有CYP3A5*1/*1或CYP3A5*1/*3基因的患者比CYP3A5*3/*3需要更大的药物剂量,甚至可达两倍以上。因此,通过精准高效的分子诊断技术,在用药前进行CYP3A5基因分型检测,可指导临床针对特定的患者选择合适的药物和给药剂量,实现个体化用药,从而提高药物治疗的有效性和安全性,防止严重药物不良反应的发生。
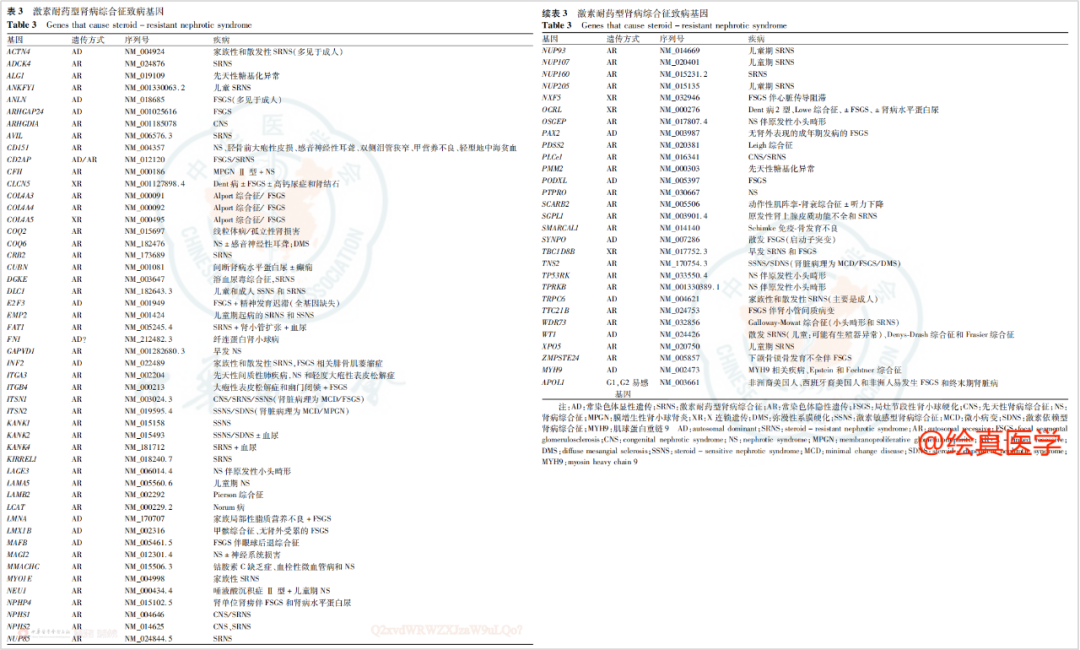
图7. 国际儿科肾脏病协会推荐激素耐药性肾病综合征致病基因检测
总结来说,通过本文在单基因遗传病,全外显子/医学全外显子检测,遗传病其他方法学检测,以及器官移植前的遗传病检测等知识点上的细致讲解,相信您对遗传病的发生机制和检测意义都有了充分的认识。针对遗传病的检测,我司既往也辅助多个遗传病家庭确诊疾病指导临床,获得了临床医生的一致好评!我司也不遗余力地为遗传病患者基因检测提供解决策略,除了全外和医学全外显子检测之外,基于其他方法学的多个遗传病单项检测也值得关注,建议结合患者病情依需选择(图8)。
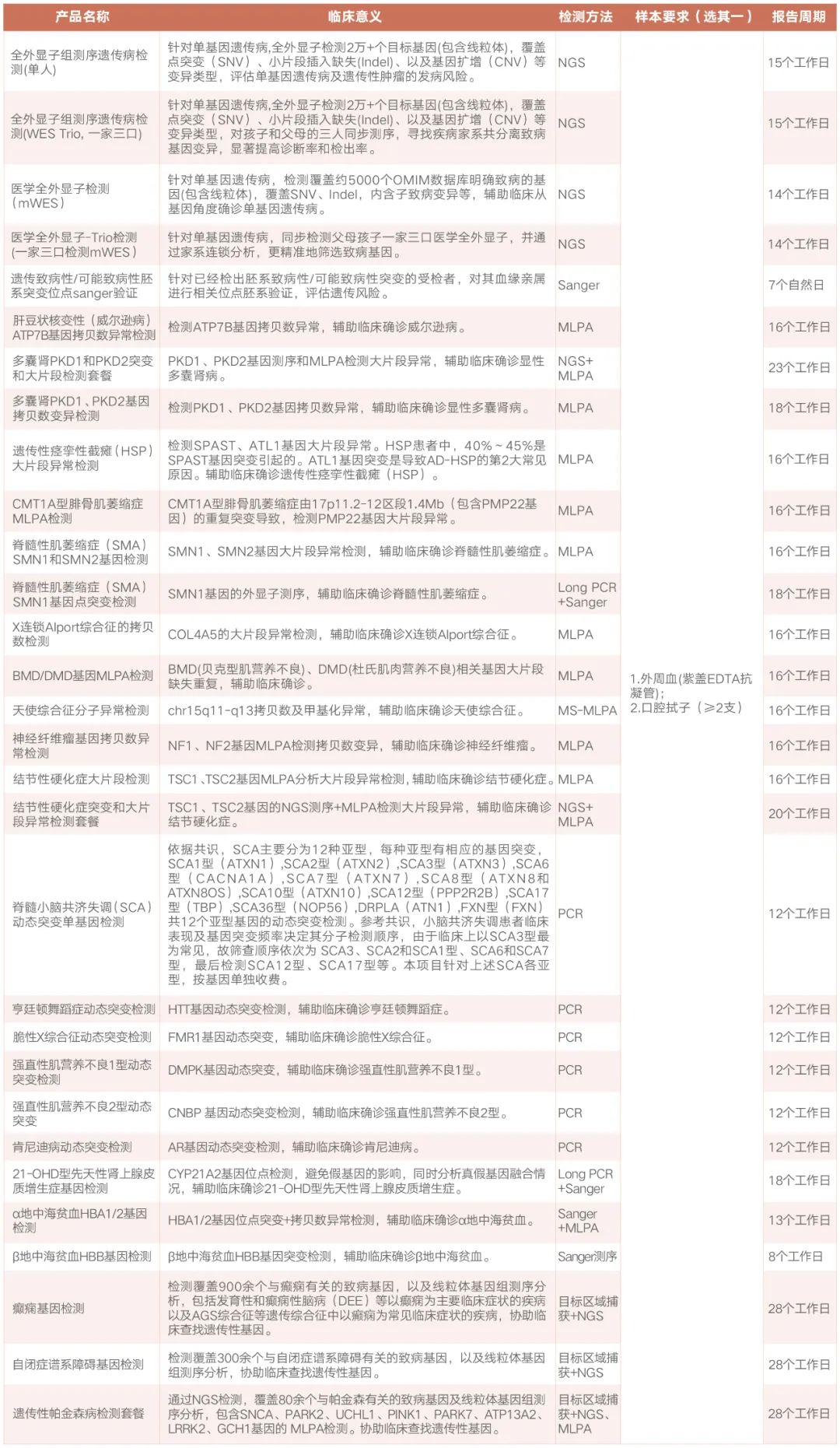
图8 绘真医学遗传病检测解决方案
参考文献:
[1] 秦怀金,朱军.中国出生缺陷防治报告[M].人民卫生出版社,2013.
[2] 张抒扬.罕见病诊疗指南:2019年版[M].人民卫生出版社,2019.
[3] 唐北沙,江泓.遗传性共济失调诊断与治疗专家策略[J].中国现代神经疾病杂志, 2012, 12(003):266-274.
[4] 李林,梅长林,无.中国常染色体显性多囊肾病临床实践指南[J].临床肾脏病杂志, 16(10):9.
[5] 黄金月,张碧丽综述,刘薇审校.遗传相关儿童罕见病临床诊断技术现状,进展与思考[J].中国当代儿科杂志, 2023, 25(3):308-314.
[6] Lin, L., Pan, H., Qi, Y., Ma, Y., & Qiu, L. (2023). Reasons and Resolutions for Inconsistent Variant Interpretation. Human Mutation, 2023, 4955235.
[7] 张括,李金明. 中国人群遗传病基因型与表型数据库的建立对遗传病精准诊断的重要性." 中华医学杂志 100.39(2020):4.
[8] 丰翼,丰永花, 尚文俊. 儿童遗传性肾病综合征肾移植治疗相关进展 [J] . 中华实用儿科临床杂志, 2023, 38(9) : 717-720. DOI: 10.3760/cma.j.cn101070-20220616-00724.
[9] Trautmann A, Bodria M, Ozaltin F, Gheisari A, Melk A, et,al. Spectrum of steroid-resistant and congenital nephrotic syndrome in children: the PodoNet registry cohort. Clin J Am Soc Nephrol. 2015 Apr 7;10(4):592-600. doi: 10.2215/CJN.06260614. Epub 2015 Jan 29. PMID: 25635037; PMCID: PMC4386250.
[10] 王斯斯, 管娜. 国际儿科肾脏病学会儿童激素耐药型肾病综合征诊治建议介绍." 中华实用儿科临床杂志 35.20(2020):10.
[11] Mendrinou E, Mashaly ME, Al Okily AM, Mohamed ME, Refaie AF, Elsawy EM, Saleh HH, Sheashaa H, Patrinos GP. CYP3A5 Gene-Guided Tacrolimus Treatment of Living-Donor Egyptian Kidney Transplanted Patients. Front Pharmacol. 2020 Aug 11;11:1218. doi: 10.3389/fphar.2020.01218. PMID: 32848803; PMCID: PMC7431691.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#遗传病基因检测# #全外检测#
14