临床研究|内蒙古自治区蒙古族聚集区丁型肝炎流行现状分析
2023-08-06 临床肝胆病杂志 临床肝胆病杂志 发表于上海
内蒙古自治区毗邻蒙古国,而蒙古国又是世界上丁型肝炎发病率极高的国家。因此,有必要对内蒙古自治区蒙古族聚集区人群的HDV感染情况进行研究。
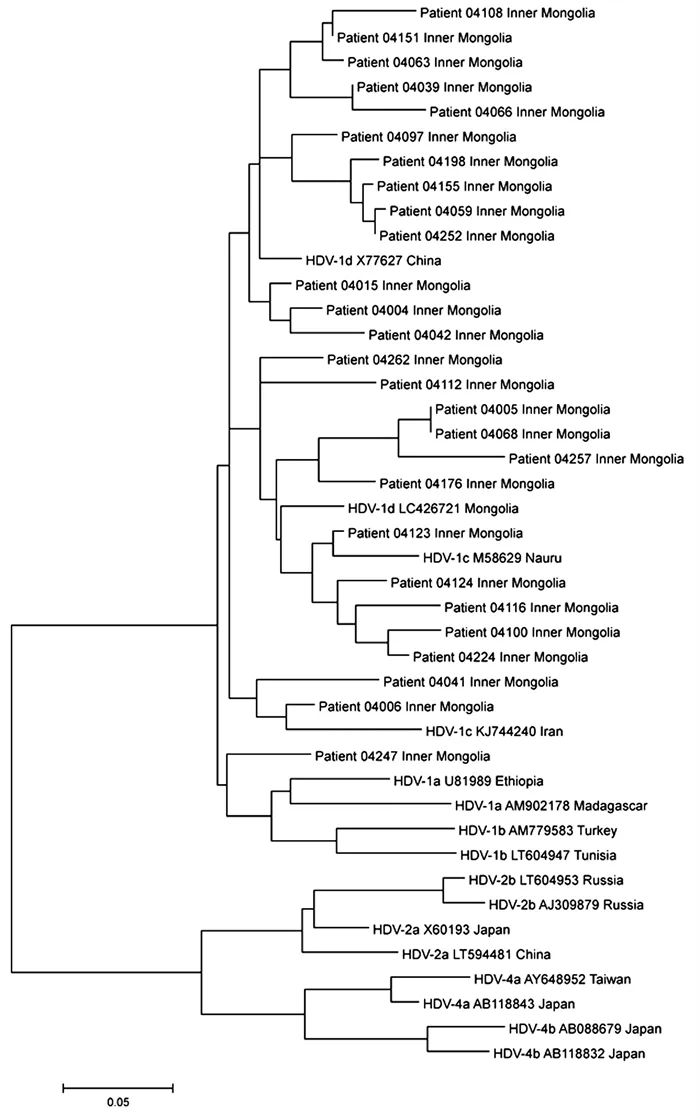
1977年意大利学者Rizzetto等[1]首次用免疫荧光法在慢性乙型肝炎患者的肝细胞核内发现一种新的病毒抗原,并称为δ因子。1984年将该种因子正式命名δ抗原(HDAg),其病毒分子被命名为丁型肝炎病毒(HDV),所致疾病则被称为丁型肝炎。同时感染会引起大范围的肝坏死,以及严重的、暴发性的肝炎,病死率较高。大部分同时感染的患者能够清除两种病毒,只有少于5%的患者会发展成慢性丁型肝炎(CHD);双重感染较HBV单感染以及HBV、HDV同时感染,引起更快的硬化过程,肝癌发生率也更高。大多数双重感染的患者通常无法清除HDV,90%的患者会发展成CHD[2-5]。随着对HDV研究的越来越深入,丁型肝炎与乙型肝炎的关系被阐明的较为清楚,近年来也出现了一些丁型肝炎的治疗药物[6-8]。各大公司竞相在中国进行丁型肝炎的药物临床试验。内蒙古自治区毗邻蒙古国,而蒙古国又是世界上丁型肝炎发病率极高的国家。因此,有必要对内蒙古自治区蒙古族聚集区人群的HDV感染情况进行研究。 1资料与方法 1.1 研究对象 收集2019年4月—2020年10月在内蒙古自治区国际蒙医医院就诊的乙型肝炎表面抗原(HBsAg)阳性患者的血清标本,记录性别、年龄、民族、HBsAg定量等信息。根据患者基本信息将患者分为乙型肝炎合并肝硬化组和乙型肝炎组;根据HBsAg水平将患者分为HBsAg<250 IU/mL组和HBsAg≥250 IU/mL组。收集检验剩余血清约1 mL冻存于-80 ℃冰箱备用。 根据研究方案(JDYY-HDV V3)的规定,从医院收集相应的标本进行检测需要满足以下条件:(1)年龄≥ 18岁,男女不限;(2)既往诊断为慢性HBV感染(即HBsAg阳性≥ 3个月);(3)肝硬化(包括代偿期和失代偿期肝硬化)。肝硬化的评估标准如下:(1)基于活检的肝硬化证据,要求Metavir评分为4,或Ishak评分为5~6。(2)若无活检结果,患者应满足以下标准之一,①腹水;②肝性脑病;③静脉曲张破裂出血。以上标准需排除因非肝硬化性门静脉高压导致的腹水、肝性脑病或上消化道出血。(3)如果上述标准均未满足,患者应满足以下4个标准中的任意两项,①显示肝硬化特征的成像图为肝脏表面不规则,肝实质颗粒或结节状,腹腔内侧支循环或静脉曲张,伴或不伴脾大(脾厚超过4.0 cm或大于5个肋单元);②PLT<100×109/L;③ALT<5倍正常值上限时,测得肝硬度>12 kPa;④内镜显示胃食管静脉曲张。 1.3 设备与材料 HBsAg检测采用i2000全自动免疫发光仪(美国雅培公司)。HDV抗体(HDV-IgM、HDV-IgG)采用ELISA法检测(北京万泰生物药业股份有限公司)。全自动核酸提取仪磁珠法进行病毒核酸提取;HDV核酸(HDV RNA)采用实时定量PCR方法,购买RoboGene 2.0 HDV RNA检测试剂盒(德国RoboScreen诊断试剂公司)。 酶标仪/洗板机(美国ThermoFisher公司),全自动免疫发光仪(美国Abbott公司),核酸提取仪(山东见微),PCR仪(美国BioRad公司),实时定量PCR仪(美国ABI7500)。 1.4 HDV抗体检测 采用北京万泰生物HDV-IgM和HDV-IgG试剂盒进行血清样本中HDV抗体检测。按照说明书加样孵育30 min后洗板,加酶标试剂30 min后洗板,显色15 min后用双波长450/600 nm检测吸光度值。 1.5 核酸提取 利用全自动核酸提取仪按照说明书进行HDV病毒核酸提取。购买山东见微预分装核酸提取试剂Ⅰ套盒,将血清标本200 μL加入试剂盒A2~H2列或者A8~H8列中,设置好固定运行程序进行核酸提取。核酸提取物体积80 μL备用。 1.6 病毒核酸定量检测 所有抗体阳性的标本进行HDV RNA检测。按照RoboGene 2.0 HDV RNA试剂盒说明书进行。根据标准品浓度计算核酸浓度,检测下限为6 IU/mL。 1.7 基因分型和系统进化树构建 将核酸检测阳性的标本进行分型检测,分型采用PCR方法,采用引物序列为F:5′-CATGCCGACCCGAAGAGGAAAG-3′;R:5′-GAAGGAAGGCCCTCGAGAACAAGA-3′,扩增后进行测序分析。利用BioEdit软件进行运算和分析,用MEGA 6.0软件neighbor-joining方法构建系统进化树进行基因分型。参照序列均从GeneBank下载。 2结果 2.1 一般资料 共纳入230例HBsAg阳性患者,其中乙型肝炎合并肝硬化患者18例,乙型肝炎患者212例;平均年龄(46.5±14.2)岁。 2.2 丁型肝炎抗体检测 将230份标本进行丁型肝炎抗体检测,HDV-IgM阳性32例,HDV-IgG阳性37例(16.09%),并且所有IgM阳性的标本都包含在IgG阳性标本中。18份肝硬化的标本中HDV-IgG阳性8份,占肝硬化标本的44.44%。同时又将HBsAg结果进行了分层分析,HBsAg<250 IU/mL组共104份标本,其中仅3份标本HDV-IgG为阳性,阳性率为2.88%(3/104),这3份标本表面抗原定量分别为246、104、23 IU/mL。HBsAg≥250 IU/mL组共126份标本,其中有34份检测出HDV-IgG阳性,阳性率为26.98%(34/126)(表1)。肝硬化组与乙型肝炎组HDV-IgG阳性率比较差异有统计学意义(χ2=16.157, P<0.05);HBsAg<250 IU/mL和HBsAg≥250 IU/mL两组HDV-IgG阳性率比较差异有统计学意义(χ2=55.082,P<0.05)。 2.3 HDV定量检测 将HDV-IgG阳性的37份标本提取核酸,并进行HDV RNA定量检测。其中34份检测出HDV RNA阳性,总标本HDV RNA阳性率为91.89%(34/37),肝硬化组HDV RNA阳性率为100%(8/8),HBsAg<250 IU/mL组HDV RNA阳性率为33.33%(1/3),而HBsAg≥250 IU/mL组HDV RNA阳性率为97.06%(33/34)(表1)。HBsAg<250 IU/mL和HBsAg≥250 IU/mL两组HDV RNA阳性率比较差异有统计学意义(χ2=37.132,P<0.05)。 2.4 HDV分型检测及系统进化树 将HDV RNA阳性的34份标本进行HDV分型测定。其中7例因病毒定量很低而无法获得分型数据,其余27例均测得分型为1型(图1)。 图1 HDV分型系统树 3讨论 目前常用于HDV检测的标志物包括:HDAg、HDV-IgM/IgG、HDV RNA。抗原检测在实际应用中意义较小[9-10],抗体检测应用比较广泛。HDV感染可以刺激具有免疫能力的患者的固有免疫和适应性免疫,从而产生抗体HDV-IgM和HDV-IgG[6]。HDV-IgM一般在出现HDV感染症状后的2~3周后出现。对于同时感染的患者来说,HDV-IgM一般会在急性感染2个月后消失;对于双重感染的患者来说,HDV-IgM可能会持续存在9个月左右[3]。HDV-IgG存在于已从HDV急性感染中康复,或发展成HDV慢性感染的患者血浆中[3],故HDV-IgG阳性常代表患者处于康复或慢性感染阶段[6]。本试验中所有HDV-IgM阳性标本均包含在HDV-IgG阳性标本中,而人群的自然感染史并不十分清楚,所以猜测在慢性持续状态下可能两种抗体是持续存在的。HDV抗体阳性还需要采用金标准——HDV RNA检测来进一步确认HDV感染。常用的检测方法为定量或半定量实时PCR法。RoboGene HDV RNA检测试剂盒是目前国际公认的检测效能最高的试剂盒。 丁型肝炎流行的地区性差异比较大,高流行率的地区包括蒙古、亚马逊流域、中非、中欧和东欧等[11]。很多国家没有完善的丁型肝炎流行病学的调查,理论上,HBsAg阳性的人群都应检测HDV抗体,但实际全世界HDV检测率总体水平不高。英国的检测率为40%~90%,希腊约为35%,美国约为5%。 Roggenbach等[12]对内蒙古就诊的HBsAg阳性患者进行HDV初步筛查,HDV IgG阳性率为13.94%(35/251)。对其中抗体阳性患者进行HDV核酸复测,检出率为97.14%(34/35),HDV RNA阳性率为13.55%(34/251)。前期在内蒙古收集的标本中有来源于其他汉族人口集中居住区的标本,筛查结果均为阴性。本文描述的都是国际蒙医医院就诊的蒙古族或蒙古国的患者,其阳性率较其他地区高,提示内蒙古自治区的HDV流行呈现区域化分布。内蒙古自治区接壤的蒙古共和国,是目前已知的HDV流行率最高的地区,HDV RNA在HBsAg阳性患者中的阳性率高达56.91%(70/123)[13-15],内蒙古自治区毗邻蒙古国,地理位置接近,生活习惯相似,这可能是造成内蒙古自治区流行率较高的原因。因此有必要对内蒙古自治区人群进一步行丁型肝炎发病情况的分析。 本研究发现,总体丁型肝炎抗体阳性率达到16.09%。进一步分层分析显示,肝硬化患者标本HDV-IgG阳性率高达44.44%,验证了重叠感染能够加速病情的发展。电话随访1年的结果显示,有十余人已因肝硬化或肝癌去世,这就更进一步验证了此结论。而对HBsAg水平进行分层分析发现,HBsAg<250 IU/mL组中仅有3例抗体检测阳性,其中2例HBsAg定量很接近250 IU/mL。这说明HBsAg定量与丁型肝炎的感染具有相关性。 在对HDV RNA的进一步检测中发现,整体HDV RNA阳性率较高(91.89%)。肝硬化组HDV RNA阳性率为100%,HBsAg≥250 IU/mL组HDV RNA阳性率为97.06%。说明内蒙古自治区HDV感染情况较为严重,HDV RNA检测率极高。此外,HDV分型检测结果显示,内蒙古自治区HDV分型主要为1型。 综上,内蒙古自治区HDV感染率较高,尤其在肝硬化人群及HBsAg≥250 IU/mL的人群中感染率更高。针对该部分人群应该加大力度进行丁型肝炎的筛查,尽早发现隐藏的丁型肝炎患者,做到早诊断早治疗,为早日清除肝病的目标贡献力量。 http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.05.012 付春山, 冯笑梅, 迟秀梅, 等. 内蒙古自治区蒙古族聚集区丁型肝炎流行现状分析[J]. 临床肝胆病杂志, 2023, 39(5): 1076-10801.2 患者入选标准

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









