子宫内膜癌原发灶MSS转移灶MSI-H咋治?一线免疫治疗获长期完全缓解
2024-01-05 苏州绘真医学 苏州绘真医学 发表于陕西省
本文报道了一名 67 岁女性,出现腹膜后肿块,复发性子宫内膜起源腺癌阳性。
微卫星不稳定性(MSI)是特定癌症的标志,可以使用基于组织和液体的方法进行检测。当这些基于组织和液体的方法给出不同的结果时,被称为不一致。大量研究表明,MSI-H 肿瘤可考虑基于程序性细胞死亡蛋白 1(PD-1)抑制剂的免疫疗法,但免疫疗法对 MSI-H 状态不一致的子宫内膜癌的疗效,尤其是作为一线治疗,尚未在文献中得到充分记录。本文报道了一名 67 岁女性,出现腹膜后肿块,复发性子宫内膜起源腺癌阳性。7 年前,I 期子宫内膜腺癌免疫组化(IHC)显示微卫星稳定(MSS),Caris NGS检测因组织不足结果不确定。腹膜后肿块 IHC 和 NGS 显示 MSI-H,Guardant360 液体活检也显示 MSI-H。患者 1 年前接受了帕博利珠单抗治疗,在撰写本文时仍维持临床完全缓解。本病例提供了进一步证据表明,需要重新检测转移灶的MSI状态,尤其是在长期无病生存之后。此外,还强调了考虑将免疫疗法作为 ECOG 体能状态不佳患者一线治疗的重要性,因为与化疗相比,免疫疗法可以显著改善患者生活质量并减少不良反应。
研究背景
微卫星(MS)是广泛分布在基因组中的短串联重复序列,由1-6个核苷酸重复排列构成。大多数MS串联重复序列位于染色体末端附近,在编码区内,但也可见于内含子和其他非编码区。文献表明,当DNA在复制过程中发生滑移或错配时,产生微卫星序列,导致一个或多个重复或缺失序列。错配修复系统是一种纠正这类DNA复制错误的固有细胞机制,在错配修复缺陷(dMMR)的肿瘤细胞中,微卫星突变可作为后续癌症发生的触发因素。
微卫星状态主要分为 2 类:微卫星高度不稳定(MSI-H)和微卫星稳定(MSS)。MSI-H相关dMMR已在多种类型的人类癌症中得到较多描述,被证明是疾病预测和预后指标。约15%的结直肠腺癌MSI-H,由MLH-1基因启动子甲基化或MLH-1或MLH-2基因胚系突变所致。在子宫内膜癌中也观察到这一现象。2017年的一项研究使用MSI-calling软件MANTIS探索了更多癌症类型的MSI图谱,在27种肿瘤类型中识别了MSI,包括未在MSI背景下得到充分研究的癌症。
识别MSI相关癌症的标准是聚合酶链反应(PCR)和免疫组化(IHC),而液体活检方法近年来已成为有效的替代或确证性筛查工具。PCR分子方法具有基于功能异常研究分子系统的优点,不限于蛋白表达来识别点突变。一些点突变可使MMR蛋白表达,不具有MSI状态。而IHC有很多好处,如更容易制备和费用更低。IHC检测蛋白表达,不一定发现 MMR 系统缺陷。这可能导致 IHC 和 PCR 分析之间的不一致或差异,许多研究观察到这一点。例如,关于结直肠癌MMR-IHC和MSI-PCR检测不一致率的研究表明,1%-10%的样本不一致。这个范围很重要,使肿瘤学家难以选择一种理想的方法来评估肿瘤微卫星状态,许多肿瘤学家选择同时进行两种检测,这给结果不一致的患者选择理想的治疗方法带来了负担。因此,存在知识空缺,需要进一步比较已完成的关于不一致性的研究,为使用 IHC 还是 PCR 评估微卫星状态提供信息。回顾研究的目的是提供综合概述,突出具有里程碑意义的研究,以指导肿瘤学家在出现不一致的诊断结果时选择治疗计划,帮助制定概念框架,协调过去、当前和未来研究。
过去,使用常规化疗治疗 dMMR/MSI-H 实体瘤;然而,最近的临床试验表明,免疫疗法在这些患者中引起更强烈和更具临床获益的反应。在KEYNOTE-177试验中,与接受化疗的MSI-H或dMMR转移性结直肠癌患者相比,接受PD-1抑制剂帕博利珠单抗作为一线治疗的患者不良反应更少,无进展生存期显著更长。已在肺癌、肾癌和黑色素瘤等实体瘤中探索了免疫检查点阻断疗法,研究表明,该通路在子宫内膜癌中上调,因此子宫内膜癌检测PD-1/PD-L1状态是合理的。在晚期子宫内膜癌患者中,即使是MSS患者,也观察到仑伐替尼联合帕博利珠单抗的临床获益,无进展生存期和总生存期长于接受化疗的患者。本文报道了一例MSI状态不一致的子宫内膜腺癌患者,一线帕博利珠单抗治疗后达到临床完全缓解。
病 例
一名 67 岁女性,7 年前被诊断为 1B 期子宫内膜腺癌,接受了经腹全子宫切除术和双侧输卵管卵巢切除术,因顽固性恶心和呕吐 2 天到急诊科就诊。患者之前能够忍受节食,大便呈正常棕色,否认手掌瘙痒、体重明显减轻、发烧或发冷、腹痛、皮肤或眼睛发黄。否认饮酒、吸烟史。患者住在家里,之前能够独立生活,自己做饭、洗衣服和爬楼梯。无胰腺癌、子宫内膜癌或卵巢癌家族史。体格检查发现上腹部深部触诊有轻微压痛,肠鸣音阳性,未见巩膜黄疸。腹部和骨盆计算机断层扫描(CT)显示十二指肠第三部分后方25×17mm腹膜后肿块,部分十二指肠梗阻,左肾静脉、下腔静脉和腹主动脉侵犯(图1A,1B)。住院期间,出现阵发性心房颤动和充血性心力衰竭,射血分数降低 20%。
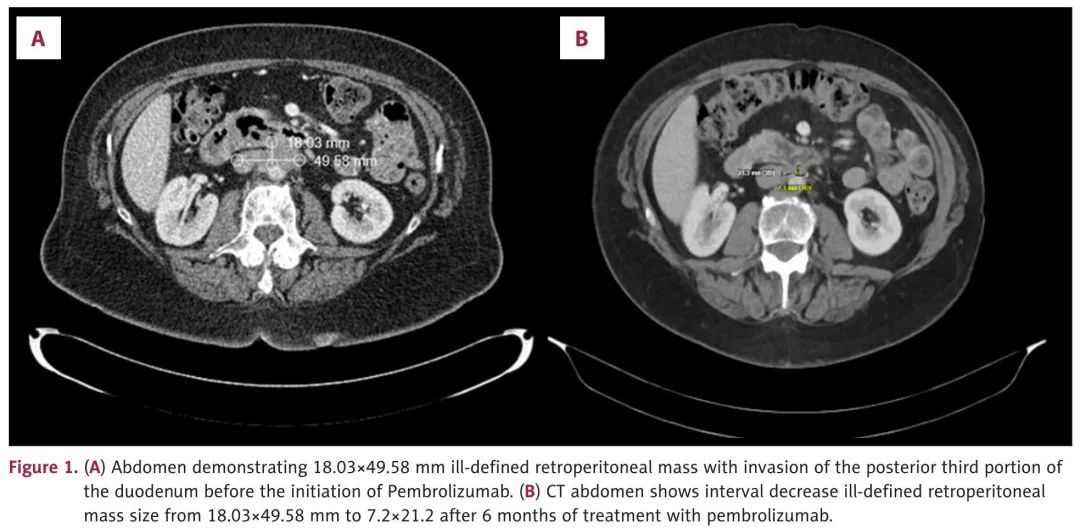
图1
7 年前诊断的子宫内膜腺癌为中分化,累及子宫肌层外半部分,未累及子宫颈。行经腹全子宫切除术,未见区域浸润,发现一个非特异性反应性 0.9 cm 髂外淋巴结。病理学评估为 FIGO 2 级,IHC 显示MSS,Caris NGS结果不确定(组织量不足)(表 1)。没有接受任何辅助治疗,积极进行影像学监测。

表1
住院期间,接受了十二指肠支架置入术。肿块细针穿刺活检显示PAX 8、ER、CK7 和 CK17 阳性腺癌,与原发性妇科癌症有关。腹膜后淋巴结 IHC 和 Caris NGS显示 MSI-H,复发时 Guardant360 液体活检发现循环肿瘤 DNA 并显示 MSI-H(表 1)。随后进行正电子发射断层扫描(PET)-CT 扫描,显示疾病局限于腹膜后,颈部、胸部和骨盆没有可疑活动,未见盆腔或腹股沟淋巴结肿大。Signatera 残留病灶检测显示8.73 MTM/mL(图2)。肿瘤标志物显著,癌胚抗原(CEA)水平为 75.9,碳水化合物抗原 125(CA-125)为 186,癌抗原 19-9(CA19-9)为 360。多学科肿瘤委员会对患者情况进行了讨论,认为由于主要血管和十二指肠浸润,肿瘤无法切除,但可考虑免疫治疗。考虑到充血性心力衰竭和多种合并症,认为无法耐受一线铂类化疗。
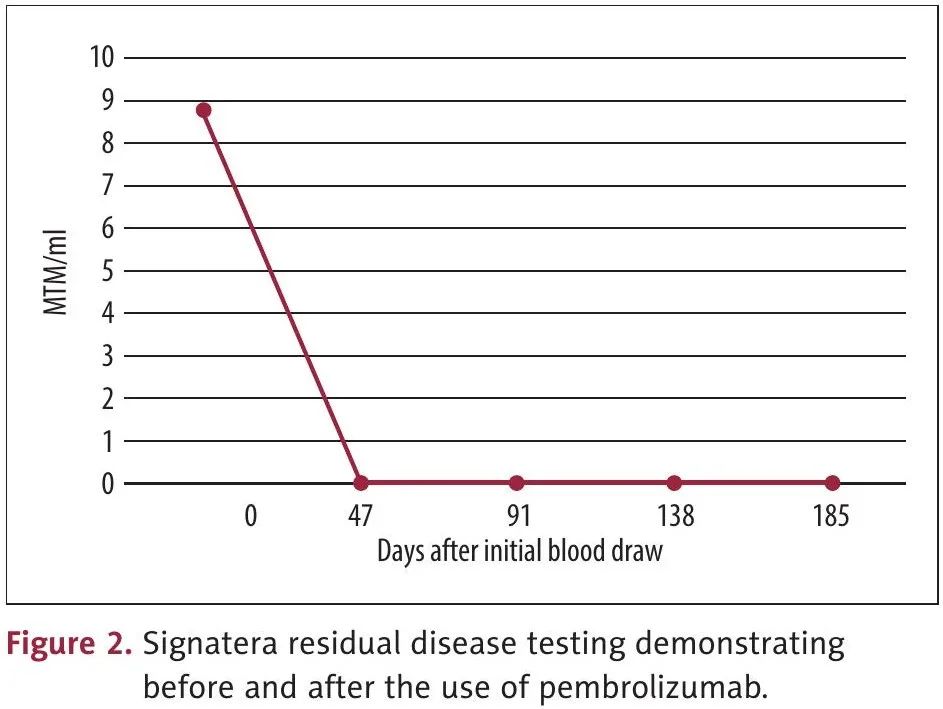
图2
由于复发性腹膜后淋巴结的 MSI-H 状态和原发灶的 MSS 状态,开始帕博利珠单抗(400 mg,每 6 周一次)和仑伐替尼(12 mg)治疗,以覆盖两个病灶的潜在异质性。仑伐替尼在1周后因恶心和呕吐以及肌肉骨骼疼痛而停药。治疗 3 个月后,影像学检查显示腹膜后肿块缩小为 23×7 mm,先前升高的肿瘤标志物水平恢复正常,CEA 为 1.6,CA-125 为 5,CA19-9 为 11(图 3)。重复 Signatera 检测显示残留病灶水平为 0 MTM/mL(图 2)。由于高剂量帕博利珠单抗引起皮疹,帕博利珠单抗剂量改为 200 mg,每 3 周一次。6 个月时的影像学检查继续显示腹膜后肿块缩小,为 21×7 mm。
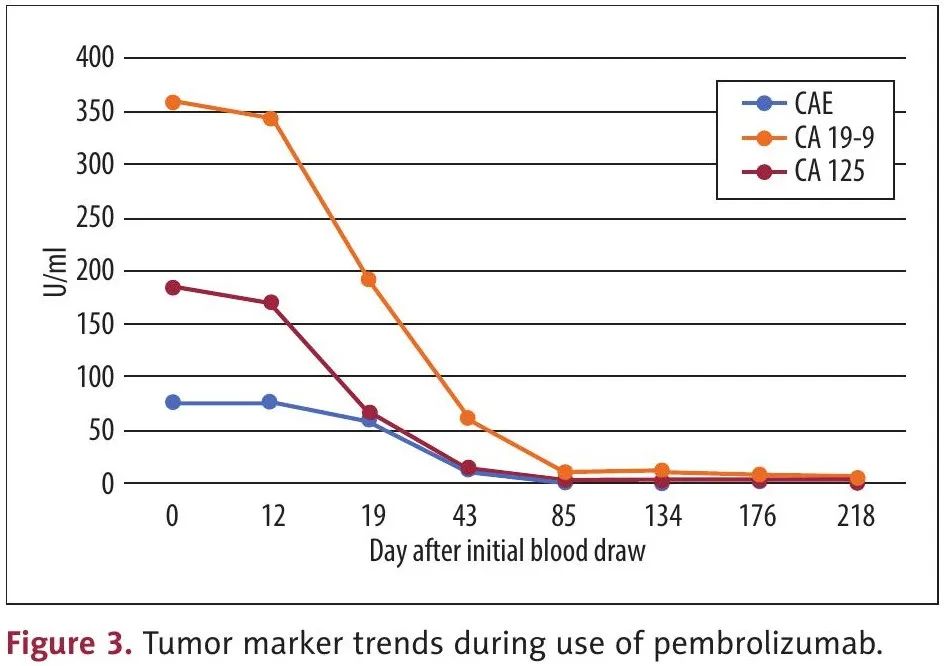
图3
治疗 8 个月后,重复十二指肠镜检查(EGD)未见肿块。停用帕博利珠单抗,每 3 个月进行一次肿瘤标志物和影像学检查。截至撰写本文时,已维持 10 个月的临床完全缓解。时间线如图 4 所示。

图4
讨 论
MSI状态不明确
检测 MSI-H 状态是实体瘤患者(包括子宫内膜腺癌)免疫检查点抑制剂治疗的关键步骤。鉴于患者 IHC、组织 NGS 和 G360 的 MSI-H 检测结果不一致,以及基线和复发时样本检测结果不一致,本病例凸显了 MSI-H 检测工具和肿瘤特征的临床模糊性(表 1)。本病例的独特之处在于,这是有史以来首次报告MSI不一致的子宫内膜癌患者获得临床完全缓解,尤其是患者在手术治疗后复发。多项研究观察到这些不一致。最近,Orellana等人的一项研究表明,12%的复发性子宫癌患者表现出MMR-D状态的克隆演变,提示复发性子宫内膜腺癌患者需要重新检测MMR状态。
文献回顾:MSI状态不一致的病例报道
为了进一步了解本病例,回顾了原发灶和转移灶MSI状态不一致,接受免疫检查点抑制剂治疗的病例报道(表2)。所有病例都接受过化疗,复发后都进行了重复活检,与本病例相似。复发后,75%的患者接受了帕博利珠单抗治疗。2例转移灶MSS的病例部分缓解。1例原发灶和转移灶MSI-H的病例无反应,可能是由于肿瘤亚克隆 IHC 染色表达,但实际上是无功能的。与本病例最相似的是Zheng等人的病例报道,食管腺癌原发灶MSS,骨转移灶MSI-H,接受帕博利珠单抗治疗,达到完全缓解。我们认为该病例与本病例具有相似的分子特征,亚克隆群体逐渐扩散,但具有功能性蛋白通路,能够用免疫检查点抑制剂靶向。
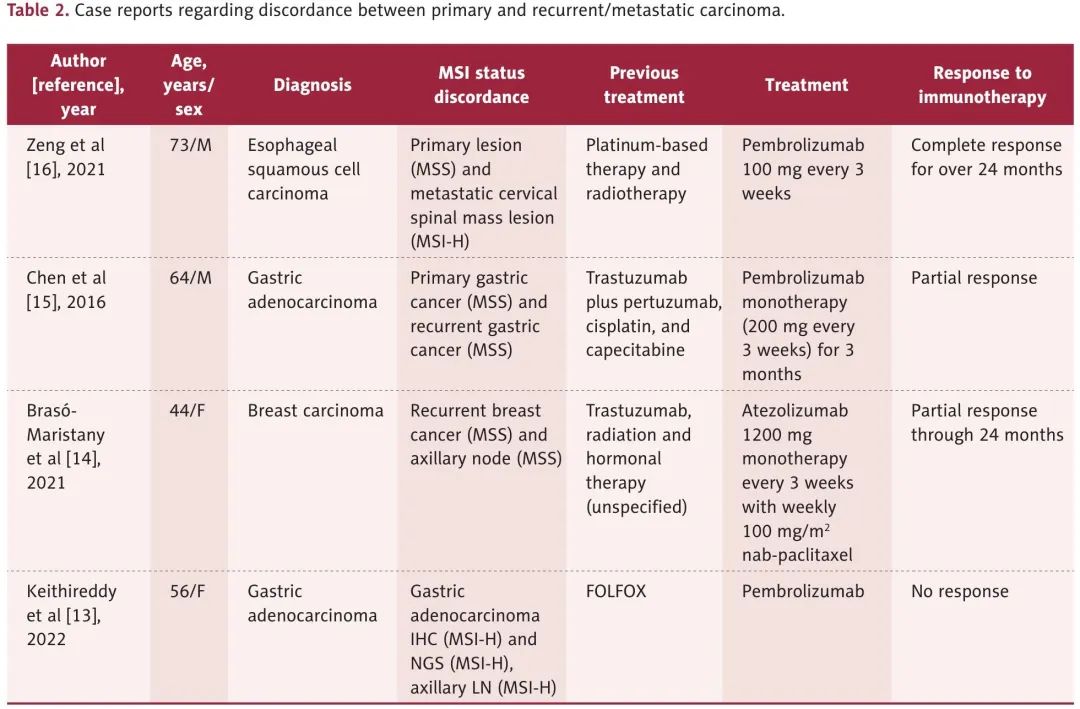
表2
不一致原因理论
关于为什么会不一致,有许多理论。首先,肿瘤内异质性起着重要作用,有研究观察到局灶性IHC染色。这可能是本病例患者检测结果不一致的原因,肿瘤内可能有一个癌细胞亚群更易生长。这可能是由于 MMR IHC 染色以二分法报告为“完整”或“缺失”。“缺失”为肿瘤上皮完全没有染色,周围基质为阳性内部对照的病例。而高达7.2%的子宫内膜癌样本存在亚克隆MMR蛋白表达缺失,不符合这种二分法报告系统。其次,IHC 染色描述为MSS时,蛋白存在,尽管这并不一定意味着蛋白具有功能。NGS可以描述蛋白是否具有功能。在本病例中,子宫内膜癌原发灶蛋白表达,但由于甲基化,蛋白失去功能。考虑到进行NGS检测的子宫内膜癌原发灶组织量不足,蛋白可能是无功能的。第三,免疫染色的分析前困难可能有潜在影响,因为特定样本的固定可能有所不同,使用方案标准化固定是防止不一致的关键。在本病例中,这不太可能,我们预期原发性子宫内膜癌组织 MSI,结果为 MSS。
文献回顾:评估不一致MSI状态的研究
评估IHC与PCR或NGS方法不一致的研究更为有限(表3)。对研究进行比较也很困难,因为检测、人群位置和癌症类型存在差异。样本不一致率从1.0%到15.7%不等,这些研究中70%为回顾性队列研究,样本量大,从92到8229不等。有几个要点。首先,Amemiya等人分析了覆盖14种不同癌症类型的284例患者的MSI-PCR和IHC染色,发现3例表现出异质性“马赛克”模式。IHC仍能够发现异质性状态,而MSI-PCR结果模棱两可,这可能是我们初始原发灶Caris NGS样本情况,样本量不足,无法检测。根据其研究结果,他们认为IHC效用更高,因为显示模糊病例的表达。此外,大多数研究比较了PCR与IHC的有效性。几项研究支持双重检测,因为不一致率较高。独特的是,Park等人的样本量最大,不一致率最低,可能是由于该研究的统计功效,可能意味着通过双重检测,大多数病例保持一致。不一致率可能较低,但对患者个体水平来说,影响可能较大。如果出现不一致的病例,一些研究建议重新检测。在Guyot D'Asinieres等人的研究中,重复检测后,只有0.4%的病例仍然不一致。他们认为这些病例是由于甲基化和 IHC 染色中缺乏蛋白表达导致错配,产生仍被检测为阳性的无活性突变蛋白。在回顾了这些研究后,我们推荐IHC和PCR双重检测来评估微卫星状态,因为在各项研究中,低不一致率与大样本量有关。我们还推荐重新检测转移灶,如果检测结果存在不一致,进行重复检测,确保为每位患者提供适当的治疗,进一步降低真正不一致结果的发生率。最后,需要进一步研究来评估重新检测后仍然存在的不一致结果。
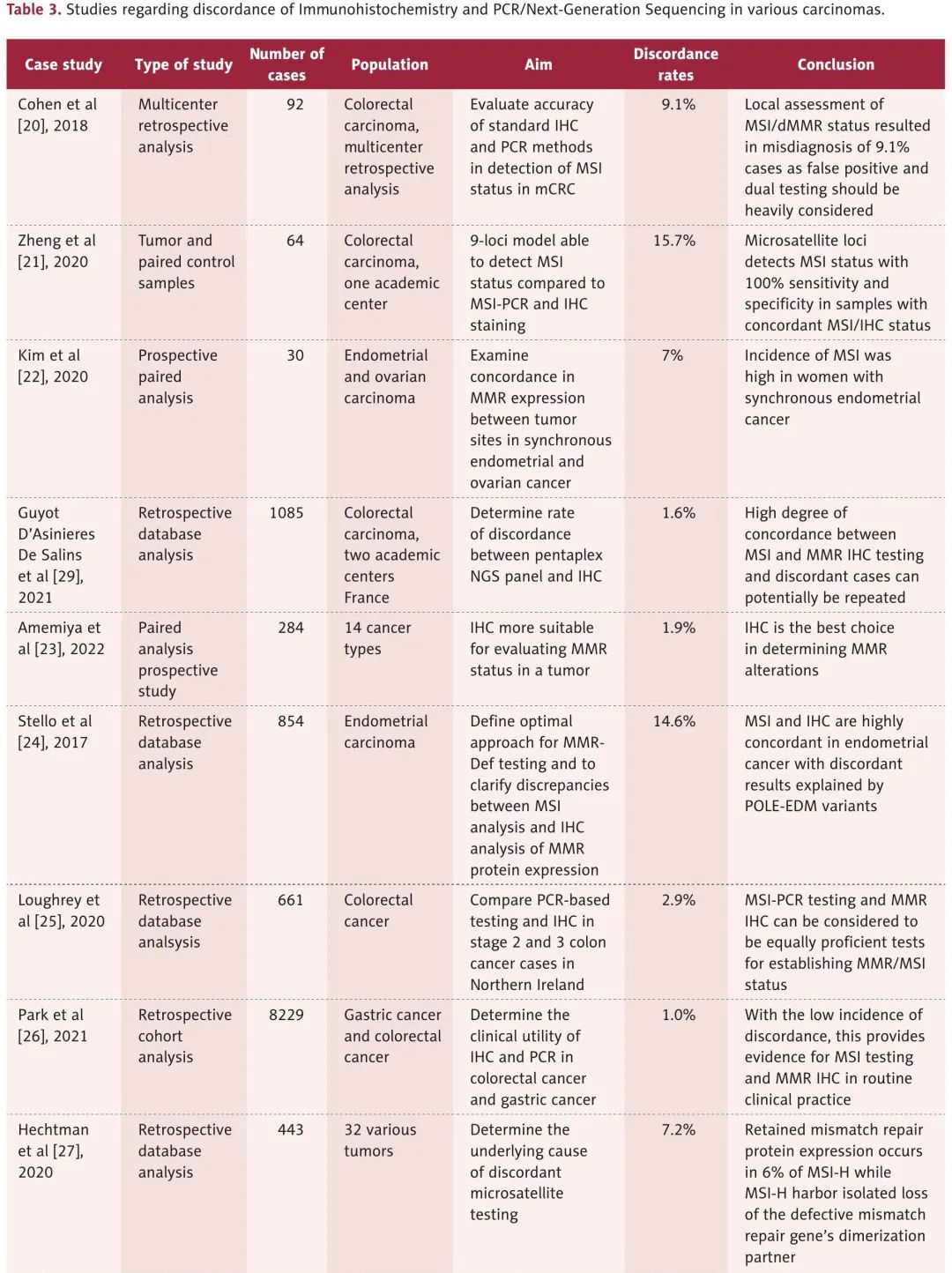

表3
ECOG不佳患者的一线治疗
传统上,转移性子宫内膜癌接受一线卡铂和紫杉醇化疗。鉴于我们患者合并症严重,包括阵发性心房颤动和充血性心力衰竭,射血分数降低 20%,以及 ECOG 体能状态不佳,决定使用帕博利珠单抗作为一线治疗。多项研究表明,与传统化疗相比,免疫疗法用于晚期实体瘤的不良反应风险更低。帕博利珠单抗已被证明可改善多种实体瘤患者的生活质量。我们的患者经帕博利珠单抗治疗后完全缓解,例行就诊时表示生活质量显著改善,能够再次进食,没有任何疼痛。因此,考虑将免疫疗法作为 ECOG 体能状态不佳患者的一线治疗很重要。
优势、局限性和未来方向
本病例表明,如果担心免疫治疗相关MSI,在治疗后重新检测转移灶和复发灶很重要。此外,强调了考虑将免疫疗法作为ECOG不佳患者一线治疗的重要性,因为在我们的患者中取得了成功。文献回顾展现了如何利用通过 IHC 和 PCR 分析获得的 MSS 状态等数据,鼓励采用循证方法确定患者能否从免疫检查点抑制剂治疗中获益。尽管本研究有这些优势,但存在局限性,这是一名患者的病例报道,而不是队列或临床研究。不一致的MSI状态结果存在进一步歧义,强调需要对MSI状态不一致的个体进行临床试验或更大规模的观察性研究。此外,许多研究提出了其他可行的诊断标志物,可能在预测子宫内膜癌的分期中发挥作用。例如,Oplawski等人对30例患者的组织和全血样本进行了研究,发现miR-144、miR-106a和miR-30d是潜在的诊断标志物。
据我们所知,本研究首次报告了MSI-H状态不一致的子宫内膜腺癌患者经一线帕博利珠单抗治疗后获得完全缓解。本病例突出了几点。首先,有许多因素可能导致MSI检测结果的不一致。除了本病例外,许多病例报道和研究都表明了这一点。本病例提供了进一步的证据表明需要重新检测转移灶的MSI状态,尤其是在长期无病生存之后。此外,还强调了考虑将免疫疗法作为 ECOG 体能状态不佳患者一线治疗的重要性,因为与化疗相比,免疫疗法可以显著改善患者生活质量并减少不良反应。
参考文献:
Grant CR, Chiao EJ, Arter ZL, Johnson C, Tran T, Dayyani F, Tewari K, Vilchez V, Carmichael J, Cho M. Endometrial Adenocarcinoma with Discordant Microsatellite Stability Status Treated with First-Line Pembrolizumab: A Case Report and Narrative Review. Am J Case Rep. 2023 Jun 29;24:e939448. doi: 10.12659/AJCR.939448. PMID: 37381599; PMCID: PMC10316721.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#子宫内膜癌# #一线免疫治疗#
27