抗血管+TKI联合治疗是否更优?一文带你全面解读
2023-06-21 找药宝典 找药宝典 发表于上海
与单纯EGFR-TKIs治疗相比,血管生成抑制剂联合EGFR-TKIs治疗可延长晚期EGFR突变NSCLC患者的PFS。
在众多临床试验中,EGFR-TKIs显示出强大的临床获益。EGFR-TKI能将患者中位PFS延长至9~18个月且耐受性良好,并因次成为具有敏感EGFR突变的晚期NSCLC患者的一线疗法。然而,具有耐药性的第一代和第二代EGFR-TKI使患者的长期生存获益陷入泥潭。据悉,作为一线治疗的第三代EGFR-TKI比起前两代可获得更好的PFS,但它也具有较高的耐药发生率和复杂性,这对后续的治疗提出了很大的挑战。
EGFR-TKIs+血管生成抑制剂
血管内皮生长因子(VEGF)是肺癌血管生成的关键调节因子,可激活EGFR通路引起VEGF产生和VEGFR活性,通过上调缺氧依赖性HIF-α表达促进血管生成,而EFGR-TKIs能够阻止EGFR通路直接抑制肿瘤生长,并阻断VEGF以抑制血管生成。阻断VEGF/VEGFR信号可以减少或消除对EGFR-TKI的原发性或获得性耐药性。越来越多的临床试验试图证实EGFR-TKIs联合血管生成抑制剂在晚期EGFR突变NSCLC中具有优于EGFR-TKIs单药治疗的抗肿瘤作用,但这些研究并未取得完全一致的结果。
联合治疗vs单药TKI
发表在BMCPulmonaryMedicine上的一篇文章,使用PubMed、EMBASE和Cochrane查找已发表的文章,此外,还纳入了ESMO和ASCO的口头报告随机对照试验。筛选出使用EGFR-TKI和血管生成抑制剂作为晚期EGFR突变NSCLC一线治疗的随机对照试验。ORR、AE、OS和PFS为研究终点
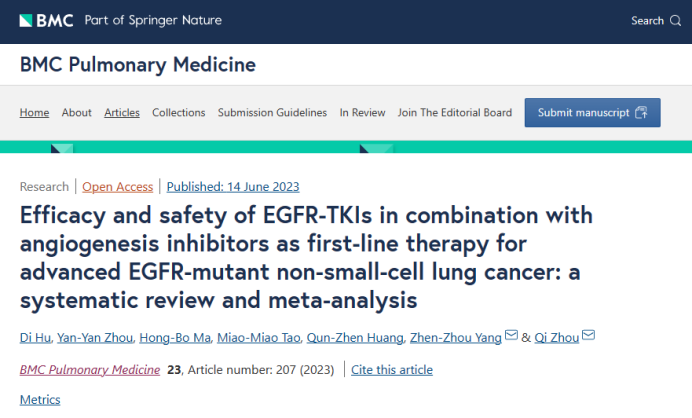
九项研究共纳入1821名患者。纳入的五项研究(JO25567、NEJ026、ARTEMIS-CTONG1509、Stinchcombe、BEVERLYtrail)将厄洛替尼联合贝伐珠单抗作为一线疗法与厄洛替尼进行了比较。RELAY研究分别在东亚人群和欧洲或美国人群中比较了雷莫西尤单抗联合厄洛替尼与厄洛替尼的疗效,CTONG1706(ACTIVE)研究比较了阿帕替尼联合吉非替尼与仅吉非替尼,WJOG9717L研究比较了奥希替尼联合贝伐珠单抗与仅奥希替尼治疗晚期非鳞状非小细胞肺癌的安全性和有效性。

无进展生存期(PFS)
9项研究报告了总人群的中位PFS,共纳入1821名个体患者,其中包括联合治疗组911名患者和TKIs单独治疗组910名患者。与EGFR-TKIs单药治疗相比,TKIs联合血管生成抑制剂治疗可延长晚期EGFR突变NSCLC的PFS,具有统计学意义[HR:0.65(95%CI:0.59~0.73,P<0.00001)]。
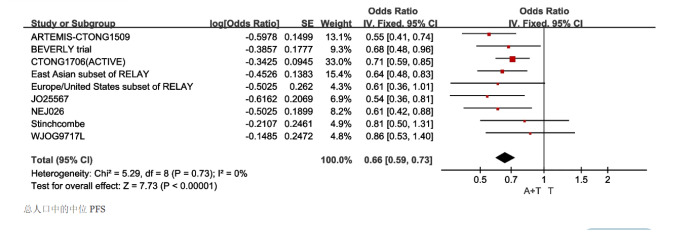
19Del突变人群918例,固定效应模型I2=0.0%,异质性P=0.91。由此可见,EGFR-TKIs联合血管生成抑制剂治疗,与EGFR-TKIs单药治疗相比,可延长携带19Del突变的晚期NSCLC患者的PFS[HR:0.62(95%CI:0.53~0.73,P<0.00001)]。而在21L858突变的人群中,包括803例,固定效应模型操作为I2=0.0%,异质性P=0.56。结果表明,EGFR-TKIs联合血管生成抑制剂治疗与单纯EGFR-TKIs治疗相比,可延长携带21L858突变的晚期NSCLC患者的PFS[HR:0.64(95%CI:0.56~0.72,P<0.00001)]。
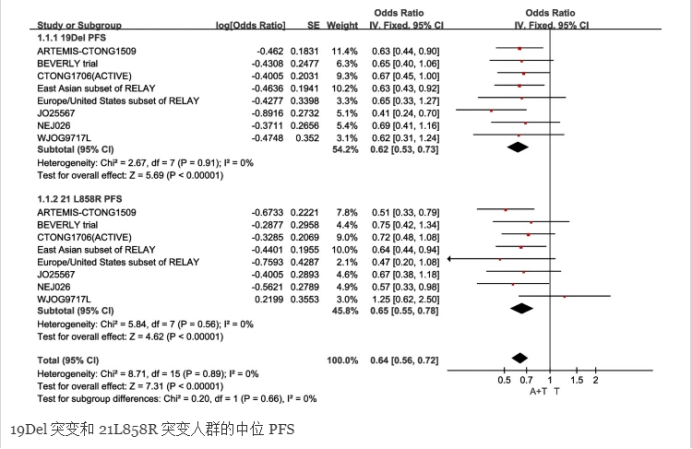
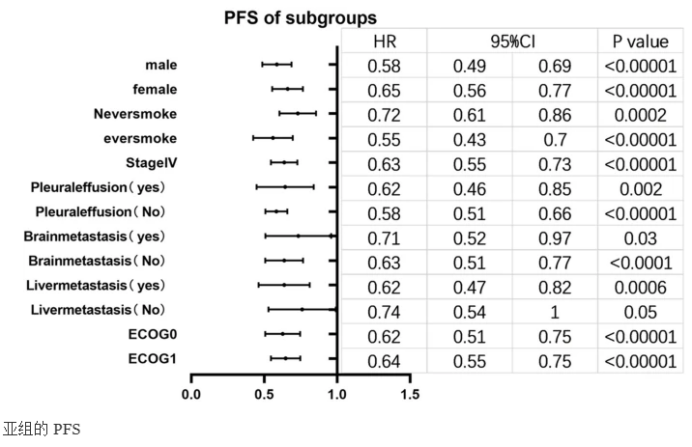
此外,根据性别、筛选阶段、基线ECOG表现状态、吸烟状况、脑转移、肝转移和胸腔积液分为不同的亚组。结果显示,非基线肝转移亚组差异无统计学意义(P>0.05),药物联合治疗在其他亚组具有更长的PFS。联合治疗在男性亚组、曾吸烟亚组、非基线胸腔积液亚组、非基线脑转移亚组、基线肝转移亚组和基线ECOG 0亚组中PFS延长更明显。吸烟组与不吸烟组、脑转移组与无脑转移组、肝转移组与无肝转移组差异更明显,意味着PFS的延长更明显(吸烟组、无脑转移组、肝转移组联合治疗)。
基于总生存期(OS)的疗效比较
7项研究报告了OS。联合用药组与单药组之间无统计学差异[HR:0.90(95%CI:0.76-1.06,P=0.20)]
在曾经吸烟和从不吸烟亚组之间的比较中,BEVERLY研究中曾经吸烟亚组的联合治疗与更好的OS相关(曾经吸烟亚组:HR:0.41,95%CI:0.21~0.80;从不吸烟亚组:HR:1.36,95%CI:0.70~2.64)差异有统计学意义(P=0.0077)。
两项研究的OS结果参考了基线脑转移与非基线脑转移亚组:ARTEMIS-CTONG1509研究中联合治疗的基线脑转移亚组与更好的OS相关,而Stinchcombe研究中基线脑转移和非基线脑转移亚组之间无统计学差异。
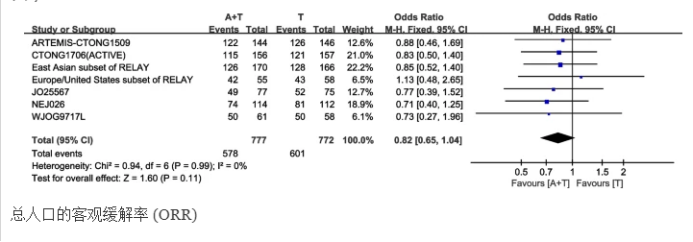
客观缓解率(ORR)
7项研究报告了ORR。固定效应模型运行为I2=0.0%,异质性P=0.99。联用组与单药组无统计学差异[HR:1.21(95%CI:0.96-1.54,P=0.11)]。
严重不良情况
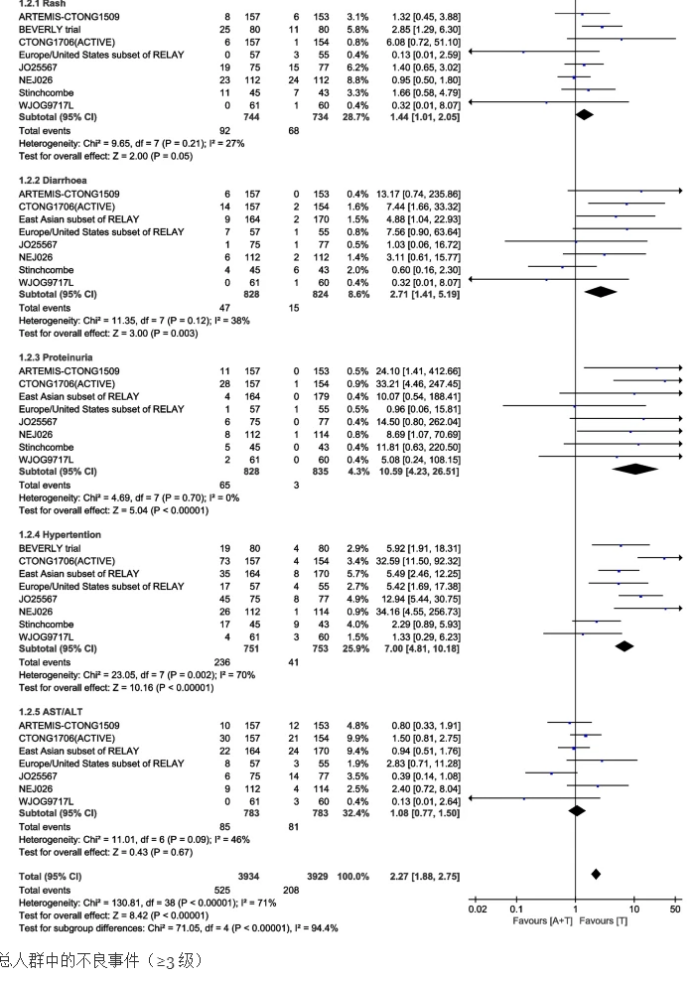
所有9项研究均报告了不良事件(AE),最常见的5种AE(≥3级)是皮疹(160名患者)、腹泻(62名患者)、蛋白尿(68名患者)、高血压(341名患者)和ALT/AST异常(166名患者)。与联合治疗的其他亚组相比,蛋白尿和高血压亚组的不良事件发生率更高。血管生成抑制剂联合EGFR-TKIs治疗的总体不良事件发生率仍高于EGFR-TKIs单独治疗[HR:2.43(95%CI:2.02-2.92,P<0.00001)]。
讨论
此项荟萃分析检验了EGFR-TKI联合抗血管生成药物一线治疗EGFR突变晚期NSCLC的有效性和安全性。结果表明,与EGFR-TKI联合安慰剂相比,EGFR-TKI联合血管生成抑制剂显着改善了PFS,但对OS和ORR没有影响。
在EGFR-TKI应用后出现T790M突变的患者中,BOOSTER研究再次挑战奥希替尼和贝伐珠单抗,本研究包括155名患者,获得了55%的ORR和90%的疾病控制率(DCR)的结果,中位PFS为15.4个月,中位OS为24个月;另一项I期研究包括25名接受Osimertinib和Ramucirumab再次挑战的患者,结果ORR为87%,非基线CNS转移的DCR为87%,基线CNS转移的DCR为100%,中位PFS为11.0个月,中位OS为25个月。这表明不同的血管生成抑制剂对联合治疗有不同的影响,但由于样本量、剂量或跨研究程序的实施过程存在差异,我们仍需要进一步的临床试验来证实这一点。此外,与单独使用EGFR-TKI相比,作为再挑战的联合疗法的效果仍然具有一些潜在的益处。这些研究表明需要探索使用抗血管生成联合EGFR-TKI疗法的时间窗。
亚组分析的结果表明,在既往吸烟的晚期EGFR突变NSCLC患者中,在晚期EGFR突变NSCLC中,在EGFRTKI治疗中加入血管生成抑制剂导致具有统计学意义的PFS和OS获益,这与单独使用EGFR-TKI治疗晚期NSCLC的结果形成对比。VEGF或VEGF受体抑制剂与TP53突变肿瘤的更好预后有关。比较厄洛替尼加雷莫西尤单抗与单独厄洛替尼的RELAY随机研究的亚组分析显示,具有TP53突变的个体具有更好的存活率。TP53突变的存在对单一EGFR-TKI疗法的疗效产生负面影响。与野生型TP53患者相比,TP53突变患者的PFS较差,但抗血管生成和TKI治疗的有效性未受影响。在TP53突变患者中,与单独使用TKI相比,抗血管生成联合TKI治疗预计可显著延长PFS(中位PFS15.0与8.0个月,p< 0.001),而在TP53野生型患者中未观察到差异。这些观察结果也与OS一致。与单一TKI治疗相比,在外显子5-8中检测到TP53突变的患者中,抗血管生成联合TKI治疗显著延长了PFS和OS。支持抗血管生成疗法对携带TP53突变更有效的理论是EGFR突变NSCLC的发现。
目前的结果显示,与EGFR-TKI单药治疗相比,EGFR-TKI联合血管生成抑制剂治疗NSCLC非基线脑转移可显著延长PFS(基线脑转移:HR:0.71,95%CI:0.52~0.97,P=0.03;非基线脑转移:HR:0.63,95%CI:0.51~0.77,P<0.0001)。两项提及脑转移亚组OS结果的纳入研究表明可能存在OS获益。此外,EGFR-TKI加贝伐珠单抗不仅具有更长的颅内PFS(14.0个月对8.2个月)和全身PFS(14.4个月对9.0个月),而且通过包含贝伐珠单抗还延长了OS(29.6个月对21.7个月;P<0.001)。此外,它改善了颅内与全身的ORR。通过多变量分析发现,加用贝伐珠单抗与延长的颅内和全身PFS和OS之间存在独立关系。
在不良事件(≥3级)发生率的统计中,高血压和蛋白尿的发生率在联合治疗中显著更高。高血压的发生率是血管生成抑制剂心血管系统最常见的不良事件,毫不奇怪,两组之间存在很大差异。血管生成抑制剂治疗期间有高血压病史的患者更容易发展为重度高血压,不能排除基线高血压患者在治疗后进一步增加了高血压的严重程度。
蛋白尿不良事件的发生率与抗血管生成药物的剂量类似。结果表明,与欧洲和美国人群相比,东亚人群中≥3级蛋白尿的发生率明显更高。鉴于EGFR突变在亚洲人群中很常见,蛋白尿的这种不良影响是否与种族相关需要进一步研究。
结论
与单纯EGFR-TKIs治疗相比,血管生成抑制剂联合EGFR-TKIs治疗可延长晚期EGFR突变NSCLC患者的PFS。即使是联合治疗也没有表现出明显的OS和ORR获益,联合治疗不良事件发生的风险较高,高血压和蛋白尿更为明显。但亚组的PFS表明,联合治疗在曾经吸烟、基线肝转移和非基线脑转移亚组中与更好的PFS相关,并且纳入的研究表明在曾经吸烟、基线肝转移和基线脑转移中的潜在OS获益脑转移亚组。
参考文献:
Hu, D., Zhou, YY., Ma, HB. et al. Efficacy and safety of EGFR-TKIs in combination with angiogenesis inhibitors as first-line therapy for advanced EGFR-mutant non-small-cell lung cancer: a systematic review and meta-analysis. BMC Pulm Med 23, 207 (2023). https://doi.org/10.1186/s12890-023-02472-x.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言