Nature:激活STING通路,防止癌症转移和复发,第一作者胡婧将回国加盟北京大学
2023-05-29 生物世界 生物世界 发表于上海
该研究表明,STING提供了一个对抗休眠癌细胞转移进展的检查点(Checkpoint),并为预防癌症复发提供了一种可行的治疗策略。
据世界卫生组织国际癌症研究署(IARC)发布的全球癌症负担数据,2020年全球癌症死亡病例高达996万例。转移是癌症死亡的主要原因,根据癌症的不同类型,癌症通常在数月至数十年的休眠期后发生转移。
例如,近一半的早期(I期或II期)肺腺癌患者在标准治疗清除原发性肿瘤的数月至数年后,仍会发生恶性转移。这意味着播散性癌细胞(Disseminated Cancer Cells)的存在,它们可以在一段时间的休眠后重新启动肿瘤生长并恶性转移。这些播散性癌细胞群存在于免疫逃逸的休眠状态和易被免疫系统清除的增殖状态之间的平衡之中。
对于免疫系统如何清除从休眠中重新苏醒的癌细胞,以及如何激活这一过程来促进对转移性癌细胞的清除,目前还知之甚少。
近日,纪念斯隆凯特琳癌症中心 Joan Massagué 实验室(胡婧博士为第一作者)在 Nature 期刊发表了题为:STING inhibits the reactivation of dormant metastasis in lung adenocarcinoma 的研究论文。
该研究通过CRISPR基因筛选,发现STING信号通路在阻止休眠癌细胞发展为侵袭性转移中发挥关键作用。在肺癌小鼠模型中,STING激动剂治疗有助于清除残留癌细胞并预防转移复发。
该研究表明,STING提供了一个对抗休眠癌细胞转移进展的检查点(Checkpoint),并为预防癌症复发提供了一种可行的治疗策略。

论文通讯作者、纪念斯隆凯特琳癌症中心基础科学和转化研究中心主任 Joan Massagué 教授表示,大多数的癌症死亡是由转移所引起的,如果能够阻止癌细胞的“苏醒”或帮助免疫系统清除这些肿瘤细胞,将对癌症患者带来巨大益处。而这项研究发现了STING在抑制侵袭性转移发展中的一个新作用。
癌细胞的转移之旅
即使原发性肿瘤被成功治疗,还可能存在着脱离肿瘤的细胞在体内停留在休眠状态,它们能够逃避免疫系统的监测长达数年之久。当这些休眠的肿瘤细胞发展出新的特性帮助它们生存后,就可以从休眠中“苏醒”并再次开始失控性生长。
论文第一作者胡婧博士表示,在癌症患者被诊断时,其中相当比例的患者的癌细胞从原发肿瘤中脱离并通过血液转移到远端器官,许多癌细胞会在这一过程中死亡,而幸存下来的癌细胞适应了免疫系统的攻击和压力,它们将在那里将保持休眠状态,直到重新“醒来”。也就是说,癌细胞一开始并没有处于一个有利环境中,它们必须适应并发展出自我支持的微环境(niche),最终从休眠中醒来,在这一过程中,癌细胞与免疫系统的相互作用至关重要。
基因筛选发现STING的新作用
STING通路是对病毒和细菌免疫反应的关键调节因子,并有助于抗肿瘤免疫。在几种癌细胞系中都观察到了STING信号的抑制,并且STING蛋白的表达随着某些癌症类型(例如黑色素瘤)的进展而降低。这些发现表明,STING激动剂,或在肿瘤环境中激活STING通路的药物,可能具有抗肿瘤作用。
在这项最新研究中,利用肺癌的早期转移小鼠模型,研究团队进行了CRISPR基因筛选,以观察癌细胞中对与宿主免疫系统相互作用很重要的基因的活性。结果显示,STING信号通路是癌症转移进展的关键抑制因子。
在不同的转移阶段,STING活性发生变化
该研究还发现,在不同的转移阶段,STING的表达会发生变化。在早期转移的休眠阶段,STING活性较低,这帮助了休眠阶段癌细胞实现免疫逃逸。而当癌细胞从休眠阶段“苏醒”进入增殖阶段,癌细胞开始增加STING活性,这使得它们更容易受到免疫系统的攻击。而在这一攻击中存活下来的癌细胞会形成更大的集群,成为巨转移(Macrometastastes),它们再次表现出STING的低水平表达,使得它们对免疫系统更具抵抗力。而休眠和转移过程中STING表达水平的变化还受到DNA甲基化的调控。
研究团队在转移性癌细胞中激活STING通路时,会招募更多NK细胞和T细胞,增加免疫细胞对这些转移性癌细胞的杀伤作用,抑制转移暴发,而在缺乏关键免疫细胞的小鼠中激活STING时,转移仍然发生,这表明STING通路在招募免疫细胞攻击癌细胞方面发挥了关键作用。
Joan Massagué 教授因在TGF-β信号通路中的开创性研究而闻名,这项新研究还发现了TGF-β在转移早期的休眠阶段抑制STING活性中的新作用,TGF-β在休眠阶段癌细胞中高表达,抑制细胞增殖,降低STING的表达和活化。
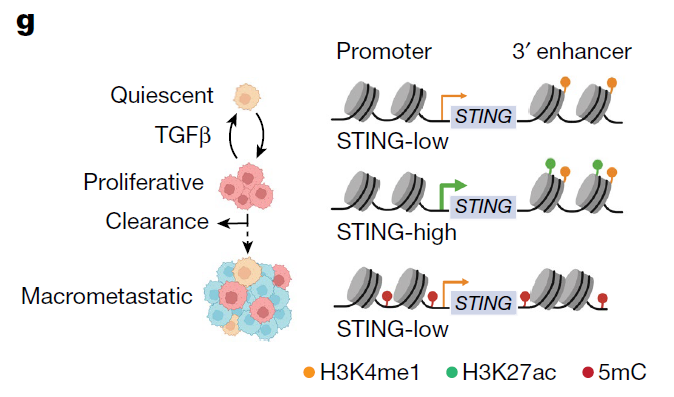
为了验证这些发现的适用性,研究团队将他们在小鼠模型中的观察结果与早期肺癌患者淋巴结中发现的少量癌细胞进行了比较,结果显示,在人类肺癌患者中观察到的结果支持了实验室中的发现。
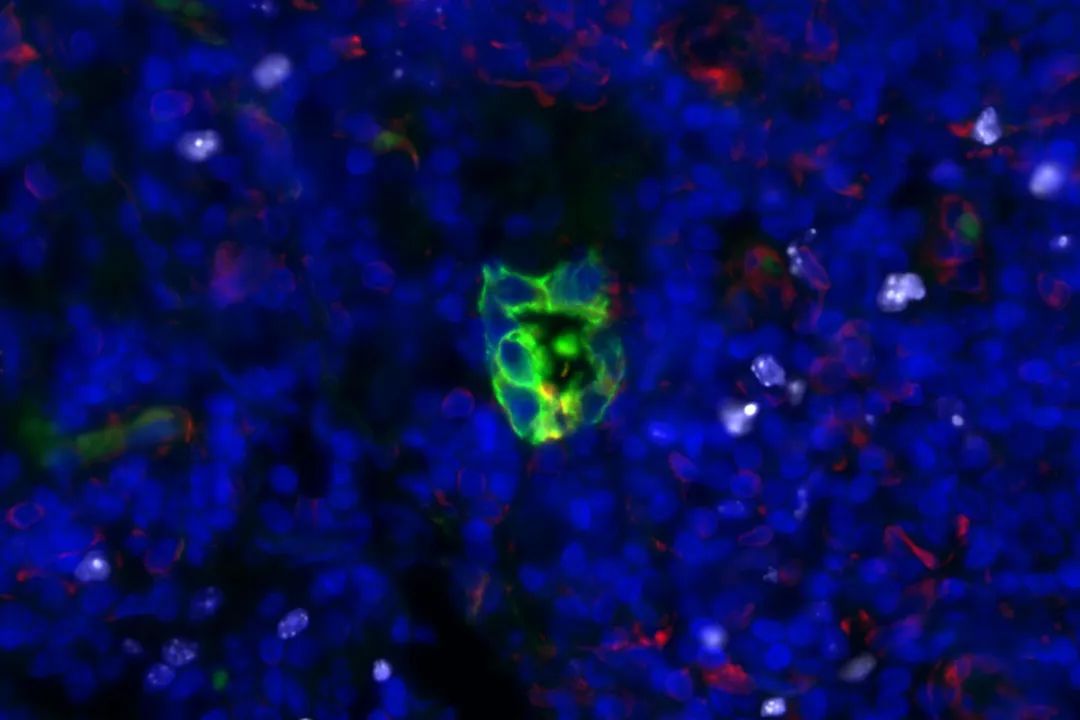
从肺腺癌患者的淋巴结中提取休眠癌细胞显示出STING低表达
Joan Massagué 教授表示,这些发现意味着在癌症转移的不同阶段,免疫系统对这些癌细胞的识别会有所不同,将STING激活剂与苏醒的癌细胞中STING活性增加的窗口结合使用,可能是一个帮助免疫系统摧毁转移性肿瘤的机会。
靶向癌症转移的新疗法
目前已有一些临床试验在评估STING激动剂(即增加STING活性的药物)的效果,但这些临床试验针对的是晚期癌症患者,他们此时往往已经出现了侵袭性转移。胡婧博士表示,此时的肿瘤已经重塑了它们的局部微环境,以更好地保护自己免受免疫系统的攻击。而在转移的早期阶段,STING激动剂可能会发挥更好的治疗效果,在此时,肿瘤尚未完全建立免疫逃逸性微环境。
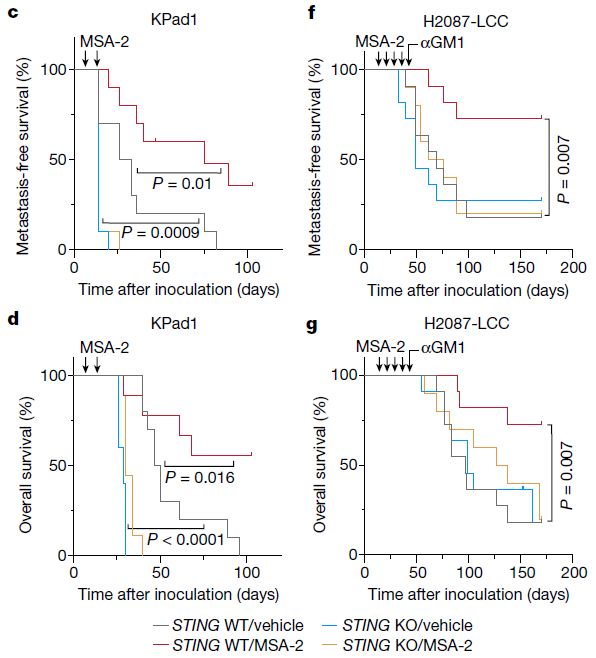
STING激动剂清除播散性癌细胞以防止转移
最终,研究团队表示,希望与临床医生合作,将这项新发现用于早期癌症患者的临床试验,利用STING通路在癌细胞开始突破性转移前杀死它们,或让它们长期停留在休眠状态。
与此同时,Joan Massagué 实验室还在继续探索STING激动剂摧毁残留转移细胞的能力,以及利用TGF-β对抗早期转移的潜在机会。
论文链接:
https://www.nature.com/articles/s41586-023-05880-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








