eBioMedicine:恶性周围神经鞘肿瘤的免疫特征、基因组概况、患者存活率和治疗靶点
2023-10-18 Jenny Ou MedSci原创 发表于上海
基于强大的预后相关性,该框架可能会为未来的转化研究以及针对这种孤儿恶性肿瘤的生物标志物引导治疗策略的潜在发展提供宝贵的资源。
恶性周围神经鞘肿瘤(MPNSTs)是罕见且具有高度侵袭性的癌症,主要发生在青少年和年轻人中。肿瘤源于神经嵴衍生细胞,无论是零星的还是与遗传综合征神经纤维瘤病1型(NF1)有关,该综合征是由肿瘤抑制基因NF1的种系突变引起的。在NF患者中,MPNST的发病率很高,大约一半的癌症发生在这种遗传环境中。

MPNST患者的预后与NF1-状态无关,不到50%在诊断后存活五年。肿瘤通常对现有的化疗和放疗不敏感,完全手术切除是唯一潜在的治疗治疗方法。然而,由于诊断时的肿瘤大小、肿瘤位置和/或转移,切除的MPNST通常无法在所有患者中复发和完全切除肿瘤。
针对DNA拓扑异构酶II的化疗经常用于佐剂和转移环境。阿霉素和依托泊苷与异环磷酰胺联合用于高等级或转移性MPNST的II期研究显示,在37名可评估的患者中,有24%有部分反应,在70%的患者中呈稳定。然而,依托泊苷对DNA拓扑酶II成分表达的疗效尚未得到评估。目前没有分子引导的治疗策略,需要改进分子知识来制定针对这种孤儿恶性肿瘤的合理治疗策略。MPNST的基因组以大量复发性DNA拷贝数畸变(CNAs)为特征。
肿瘤抑制基CDKN2A是染色体臂9p.上频繁缺失的目标。该事件发生在MPNST发育的早期,在良性和非典型神经纤维瘤中也被发现。NF1经常被染色体臂17q的近端缺失所针对,并且通常与SUZ12共同删除,SUZ12编码多梳压抑复合物2(PRC2)的核心成分。NF1和SUZ12也是核苷酸水平上为数不多的复发性突变目标之一,以及TP53和EED(编码另一个PRC2成分)。PRC2的功能丧失导致表观遗传失调,导致表观遗传失调,在组蛋白H3(H3K27me3)的恶性进展有关,并可能与肿瘤的恶性进展有关。
DNA拷贝数增加经常发生在染色体臂上7p和17q的远端部分,包括EGFR、TOP2A和BIRC5作为拟议目标。基因组畸变对MPNST转录组的影响没有得到很好的描述,但值得注意的是,在具有PRC2损失的肿瘤中,PRC2压的同源盒主调节剂的异常转录激活。NF1相关和零星的MPNST之间的基因表达几乎没有一致差异。基因表达研究很少,并受到样本量小(10-45个肿瘤)、覆盖范围狭窄或缺乏预后数据的限制。
然而,MPNST联盟基因组学最近对90个肿瘤的研究支持根据H3K27me3状态对MPNST转录组(和甲基组)的分层。之前已经提出基于基因表达的异常TP53表型与患者的不良预后有关。2023年10月11日发表在eBioMedicine的文章,研究人员旨在发现具有潜在临床相关性的分子亚型。本文假设MPNST的基因组复杂性反映在转录组中,并通过全基因组DNA拷贝数和/或基因表达分析分析了在四个欧洲肉瘤中心治疗的115名患者的MPNST和神经纤维瘤。
研究结果显示,MPNST被分为两种转录亚型,主要由免疫特征和增殖过程定义。“免疫活性”MPNST(44%)相对于神经纤维瘤具有持续的免疫信号,更常见的低等级(P = 0.01),并在具有临床病理因素(危险比0.25,P = 0.003)的疾病特异生存的多变量模型中具有有利的预后关联。
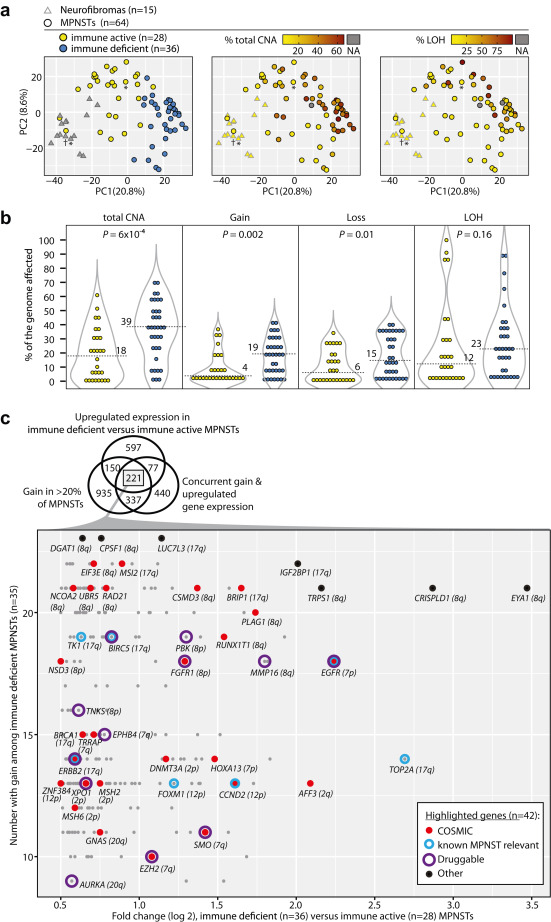
根据转录体MPNST亚型的DNA拷贝数畸变
“免疫缺陷”MPNST更具侵略性,其特征是增殖特征、高基因组复杂性、异常的TP53和PRC2损失,以及几个潜在可操作目标(EGFR、ERBB2、EZH2、KIF11、PLK1、RRM2)的高相对表达。综合基因分析表明,特别是增殖转录物特征的DNA拷贝数基础,肿瘤拷贝数负担根据患者的预后进一步分层了转录亚型(P < 0.01)。
综上所述,本文报告了基因组和转录组水平的MPNST的综合分子研究。对于罕见的癌症类型,这项研究的规模相对较大,并增加了越来越多的证据表明,PRC2的丧失是MPNST多组学特征的歧视性特征,也是患者预后不佳的预测因素。我们提出了一个子类型框架,具有几种一致的染色体畸变和表达式变化模式。基于强大的预后相关性,该框架可能会为未来的转化研究以及针对这种孤儿恶性肿瘤的生物标志物引导治疗策略的潜在发展提供宝贵的资源。
原始出处
Høland, M.; Berg, K. C. G.; Eilertsen, I. A.; Bjerkehagen, B.; Kolberg, M.; Boye, K.; Lingjærde, O. C.; Guren, T. K.; Mandahl, N.; van den Berg, E.; Palmerini, E.; Smeland, S.; Picci, P.; Mertens, F.; Sveen, A.; Lothe, R. A., Transcriptomic subtyping of malignant peripheral nerve sheath tumours highlights immune signatures, genomic profiles, patient survival and therapeutic targets. eBioMedicine 2023, 97, 104829.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言