复发/转移性鼻咽癌的分子检测,治疗现状及前景展望
2023-11-08 苏州绘真医学 苏州绘真医学 发表于上海
本综述回顾了R/M NPC患者的治疗,重点是改善患者生存的现有和在研药物。
鼻咽癌(NPC)在解剖位置和生物学上与其他上皮性头颈癌(HNC)不同。有3种WHO亚型,考虑了EB病毒(EBV)的存在和其他组织病理学特征。尽管现代治疗模式和技术为局部和局部晚期患者带来生存获益,但许多患者会复发,随后死于远处转移、局部区域复发或两者兼而有之。复发患者的理想治疗方案仍然是讨论的话题,目前的推荐是含铂化疗。帕博利珠单抗或纳武利尤单抗治疗头颈部鳞状细胞癌(HNSCC)获批依据的III期临床试验排除了NPC。目前,FDA尚未批准免疫检查点抑制剂疗法用于治疗NPC,尽管NCCN的推荐包括这些药物。因此,这仍是一个重大挑战。NPC具有挑战性,其实际上是3种不同的疾病,需要进行大量研究来确定最佳疗法及其顺序。本文将回顾现有数据,讨论正在进行的EBV+和EBV-无法手术复发/转移性NPC患者研究。
研究背景
鼻咽癌(NPC)起源于鼻咽,在组织学、流行病学、分子发病机制和治疗反应方面与其他头颈癌(HNC)不同。2020年,所有年龄段男女有133354例新发病例和80008例死亡病例。病因涉及遗传易感性、EB病毒(EBV)感染和环境危险因素(吸烟、盐腌制食品)等因素。NPC是一种罕见的恶性上皮肿瘤,流行于中国南部和东南部。组织学上,WHO将NPC分为三种类型。角化性鳞状细胞癌(1型)由产生角蛋白的分化良好的细胞组成。非角化性癌,可能分化(2型)或未分化(3型),不产生角蛋白。基底细胞样鳞状细胞癌(3型亚群)也为非角化性,其特征是分化程度较低的细胞类型,与侵袭性疾病有关。II和III型与EBV感染密切相关,EBV感染是NPC的重要危险因素,III型是亚洲最主要的组织学亚型,而在非流行地区,1型NPC是最常见的组织学亚型。
EBV驱动的NPC受到关注,高达20%的癌症可能与细菌或病毒感染有关。持续的EBV病毒感染可能不会产生症状,然而,在NPC细胞中识别了特异性EBV蛋白,如EBV核抗原1(EBNA1)、潜伏膜蛋白(LMP)和EBV基因组BamHI-A片段,介导肿瘤发生并避开免疫系统。EBV位于几乎所有晚期EBV驱动的NPC患者的癌细胞中,促进疾病的发生发展。
不幸的是,诊断通常为局部晚期或转移性,复发和远处转移是患者死亡的最常见原因。在过去几十年中,采用成功的放化疗策略的局部区域晚期疾病患者的生存率有所提高。尽管取得了这些进展,但仍有30%的患者出现复发/转移性(R/M)疾病。对于这些患者,中位总生存期(OS)在10-36个月之间,IV期患者的5年生存率即使在高收入国家也低于40%。治疗通常包括铂类化疗,部分患者靶向和免疫治疗,这些都是正在研究的领域。
本综述回顾了R/M NPC患者的治疗,重点是改善患者生存的现有和在研药物。
肿瘤生物学
分子和免疫组化
分子基因组学和免疫组化(IHC)新技术的进步使人们能够了解癌细胞相互作用,促进诊断,预后,开发新的治疗方案。在本节中,我们将了解这些技术在NPC肿瘤生物学中的作用。
NGS
突变、拷贝数变异(CNV)和融合等基因变异在肿瘤发生中起着重要作用,可通过NGS检测。NPC具有基因组不稳定性,与其他头颈癌相比,具有广泛的体细胞突变和更高频的CNV。EBV+ NPC WHO 2和3是同质性癌症,主要由负调节因子(包括LMP1、CYLD、TRAF和NFKBIA)体细胞变异引起的NF-kB信号传导或EBV癌蛋白过表达驱动。这些负调节基因突变影响NF-kB通路、细胞周期、细胞死亡、EBV感染和癌变。
根据COSMIC体细胞突变数据库,TP53、KMT2C、NOTCH2、BRCA1和2、PTCH1、IL7R、KDR、EGFR和PIK3CA等基因体细胞突变最常见。TP53体细胞突变是NPC中的高频突变。在NPC的发展中,功能基因,包括RASSF1,PIK3CA,MAD1L1,HLA-A/B/C,LTBR,CCDND1,NFKBIA,CYLD和TP53,在多个信号通路富集。这些基因改变NF-kB通路,是鼻咽细胞恶性转化的关键驱动因素。PI3K/AKT/mTOR通路突变可促进促进增殖、迁移和抑制细胞凋亡。EBV基因组、LMP1基因突变可增强增殖、迁移和NF-kB活化。KMT2C/2C、EP300、KDM5A和BamH1-A突变,功能和重要性尚未确定。
亚洲和东南欧人群研究表明,BRCA1基因突变频率较高,是预后不良因素,其次是BRCA2、TP53和KRAS,而EBV阳性是预后较好因素。发育不良的鼻咽细胞已鉴定出致癌基因(CDKN2A,RASSF1A,TGFBR2),以及染色体3p,9p,11q,12,13q,14q和16q异常。EBV+非角化性NPC研究发现了hMLH1、PMS2失活以及NK-kB通路负调节因子(如TRAF3、CYLD、NFKBIA、LMP1和NLRC5)变异。
健康细胞中有多种修复DNA双链断裂的途径,编码同源重组蛋白的基因突变与恶性肿瘤的发展有关。DNA修复缺陷因癌症类型而异,例如BRCA基因突变使患者易患乳腺癌、卵巢癌、胰腺癌、前列腺癌和非小细胞肺癌(NSCLC)。有趣的是,在NPC中发现了BRCA基因突变。一项欧洲NPC患者队列研究显示,最常见的体细胞突变为BRCA1(54%),其次是BRCA2(29%)。此外,BRCA1突变与不良预后相关。BRCA1的鉴定可作为PARP抑制剂的靶标,可能有利于克服DNA修复缺陷,增强化疗或放疗疗效。
有研究表明,PARP在EBV裂解周期中起作用。因此,抑制PARP1可能是EBV+ NPC和EBV相关恶性肿瘤的有效治疗方法。免疫疗法联合PARP抑制剂是NPC的一种有前途的治疗方法,因为NPC可能产生较多的新抗原,提高肿瘤免疫原性,改善免疫反应。POINT(NCT04825990)等试验正在评估ICIs + PARP抑制剂。
SSTR2 IHC检测
多个基因在NPC的发生中起作用,R/M NPC队列研究发现,IHC显示生长抑素受体2(SSTR2)高表达。SSTR2是一种G蛋白偶联细胞表面受体,可抑制细胞增殖,主要在神经内分泌肿瘤中表达。Lechner等人的研究纳入了311例原发性R/M NPC样本,其中252例质膜表达SSTR2,SSTR2表达在EBV +和非角化亚型中富集,复发性疾病和转移性疾病的水平没有差异。这项研究认为,SSTR2表达或可作为预后因素,较高的表达与较高的生存率相关。EBV + NPC中SSTR2上调,识别了EBV癌蛋白LMP1导致NF-kB信号通路异常激活。一项病例系列研究也通过奥曲肽PET/CT证实SSTR2过表达。几项NPC研究显示,EBV+ NPC特异性对比剂摄取增加。LMP1通过NF-kB通路诱导SSTR2表达,导致NPC发生,这一发现具有重要意义。SSTR2高表达可作为有用的诊断标志物。有趣的是,SSTR2在肺淋巴上皮瘤样癌(也是一种EBV相关癌症)中也显著表达。
靶向SSTR2的治疗策略也得到了研究,激动剂在增殖率<10%的肿瘤中显示出有效的生长控制作用。在NPC细胞中探索该假设,评估SSTR2激动剂(兰瑞肽,奥曲肽和PEN-221)作为探索性治疗策略。奥曲肽和兰瑞肽不影响NPC肿瘤增殖,与在更惰性的神经内分泌肿瘤中观察到的不同,而PEN-221显示出较好的OS和抗肿瘤功效。需要强调的是,这些治疗策略的临床疗效尚不明确,目前仅处于研究阶段。这些肽可与细胞毒性核素螯合,已被证明对神经内分泌肿瘤和一例NPC有效。关于使用SSTR2激动剂作为NPC的治疗选择,需要进一步的研究。
PD-1和肿瘤浸润淋巴细胞IHC检测
NPC的免疫环境独特,CD3+、CD8+、调节T细胞、自然杀伤细胞、中性粒细胞和树突状细胞在基质内大量浸润,在生长和肿瘤侵袭中起重要作用。低密度CD8+、中性粒细胞和肥大细胞与较长的生存期有关,高密度自然杀伤细胞改善生存期。此外,与许多癌症相似,NPC细胞具有免疫系统逃逸方法,主要通过去程序性细胞死亡蛋白1(PD-1)/ PD-L1轴。50-80%的NPC PD-L1过表达,特别是在EBV+中,因为LMP1调节PD-L1表达。这种过表达可能与免疫检查点抑制剂(ICI)疗效较好有关,与在其他实体瘤(如NSCLC)中一样。通过ICI调控PD-1/PD-L1,诱导抗肿瘤反应。ICI用于NPC的另一个原因是其高抗原性,因为NPC是EBV驱动的癌症,LMP1、LMP2和EBNA1等新抗原过表达。
ICI作为NPC的主要治疗策略之一,近年来已成为很多研究的对象。ICI有助于抗肿瘤免疫。PD-1对调节淋巴细胞功能和管理免疫系统具有重大影响,使其成为研究最全面的调节因子之一。PD-1和PD-L1之间的关系可以避免T细胞在肿瘤复发和转移之前激活和增殖。Zhang等研究了NPC患者中PD-1/PD-L1表达与治疗后结果的相关性,发现NPC患者恶性组织中PD-L1表达水平升高。评估EBV相关NPC患者的PD-L1表达,16/18(89%)的受试者恶性细胞PD-L1染色呈阳性。这提示PD-1与NPC复发、转移和进展存在联系。活检时通过免疫组化评估PD-1旨在预测对ICI反应较好的患者,可能是潜在一线联合治疗的候选者。这些发现有助于证明JUPITER-2研究中ICI(特瑞普利单抗)+吉西他滨-顺铂化疗作为一线治疗的有效性。
治 疗
化疗
转移性和复发性疾病
15-58%的患者出现无法手术/复发或转移性疾病,需要全身治疗。标准化疗包括含铂双药化疗。鼓励患者参加临床试验,获得的知识可以提高患者生存率,改变治疗标准。
NPC对铂类方案敏感,尤其是顺铂。这些方案的疗效在多项R/M和局部晚期患者试验中得到证实。在R/M疾病中,紫杉醇、顺铂和5-FU联合治疗的客观缓解率(ORR)为78.9%,疾病控制率为93.6%,OS为24.8个月,无进展生存期(PFS)为22.7个月。Zhang等人的一项重要试验将顺铂-吉西他滨确立为EBV+ NPC的优选方案,与顺铂-氟尿嘧啶相比,PFS延长了1.4个月,OS延长了3个月。该试验确定了最多6个周期为安全性可接受的一线治疗。未来的研究应探索预测患者反应的因素。NCT01365208试验识别了早期PET-CT缓解(SUVmax病灶总和下降>50%)和血浆EBV-DNA清除≤10日作为患者生存和后续化疗反应的预测指标。
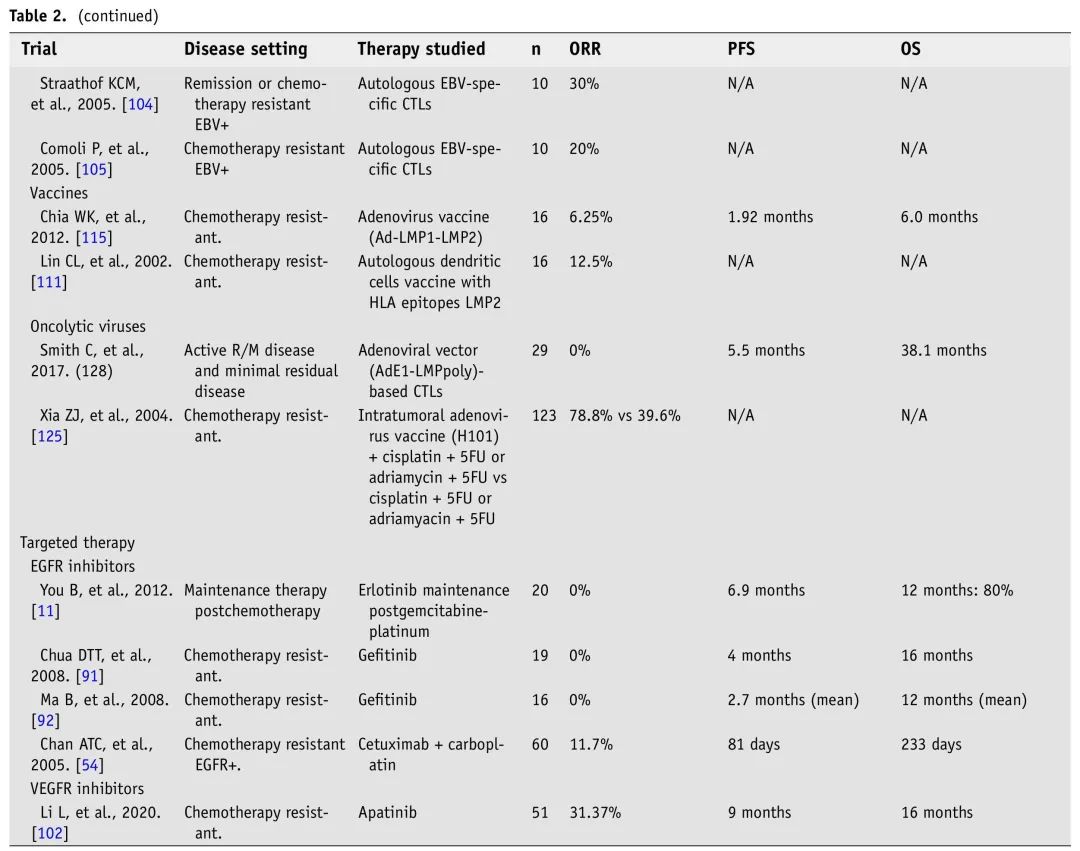
对于对顺铂-吉西他滨不耐受的患者,氟尿嘧啶、卡铂、紫杉烷类或西妥昔单抗含铂联合治疗是合理选择。无论哪种替代方案,都尽可能含有顺铂。一项试验比较了五种不同的基于顺铂的方案,结果显示,顺铂-吉西他滨和顺铂-紫杉醇-5FU方案的缓解率较高,但五种方案在PFS或OS方面无显著差异。顺铂-氟尿嘧啶和顺铂-紫杉醇是首选替代方案。一项纳入晚期HNC的III期试验显示,两种方案的OS或ORR无显著差异。卡铂-紫杉醇是有效的替代方案,PFS为7个月,OS为12个月,ORR为59%,毒性可耐受。另一种选择是卡培他滨,作为诱导化疗(紫杉醇-顺铂-卡培他滨)有效,随后单独卡培他滨维持治疗,可改善PFS、ORR和缓解持续时间,且毒性可耐受。然而,使用维持化疗的决定并不标准化,需要更多的研究。另一种选择是西妥昔单抗-卡铂,ORR为11.7%,OS为233天,毒性可控。
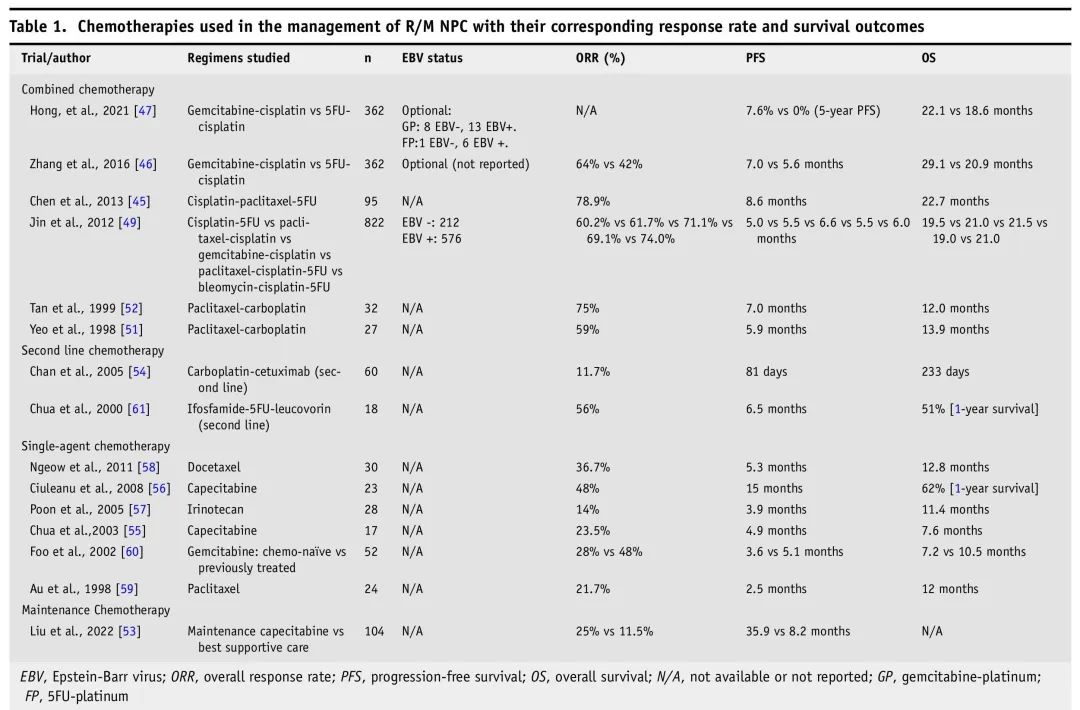
一线治疗中单药化疗仅限于不耐受联合方案、年龄较大或体能状态较差的患者。药物包括铂类、氟尿嘧啶或卡培他滨、紫杉烷类、吉西他滨、蒽环类、甲氨蝶呤、博来霉素、异环磷酰胺、长春瑞滨和伊立替康。R/M NPC化疗方案见表1。
表1. R/M NPC化疗
寡转移性疾病
ESTRO-ASTRO共识将寡转移性疾病定义为1-5个转移性病变,原发肿瘤获得或未获得控制,但所有转移部位必须可安全治疗。如果患者患有寡转移性疾病,体能状态良好,化疗部分缓解,应给予放疗巩固治疗。几项回顾性研究报告了该推荐。一项研究中,197例患者化疗后进行了姑息性放疗(RT),2年转移生存率优于单独化疗或最佳支持治疗(57.7% vs 32.7% vs 1.6%)。另一项研究纳入了448例放疗患者,与未接受放疗的患者相比,OS和癌症特异性生存率较优,死亡率风险降低50%。最近,两项回顾性研究显示,基于考虑LDH、转移性病变数量、肝转移、治疗后EBV DNA水平和转移灶对化疗的反应的预后模型,新发转移性疾病放疗3年OS率较优,OS改善,主要见于低危患者(评分≤102分)。
一项3期试验证实了巩固放疗的最终推荐,该试验中,分配至化疗+放疗组的患者24个月OS为76.4%,而仅化疗组为54.5%,化疗+放疗组的PFS也较优(分别为12.4个月和6.7个月)。值得一提的是,该试验使用了顺铂-5FU化疗。未来的临床试验应评估顺铂-吉西他滨的这种影响。这些强调了局部区域放疗在寡转移性NPC中的重要性。
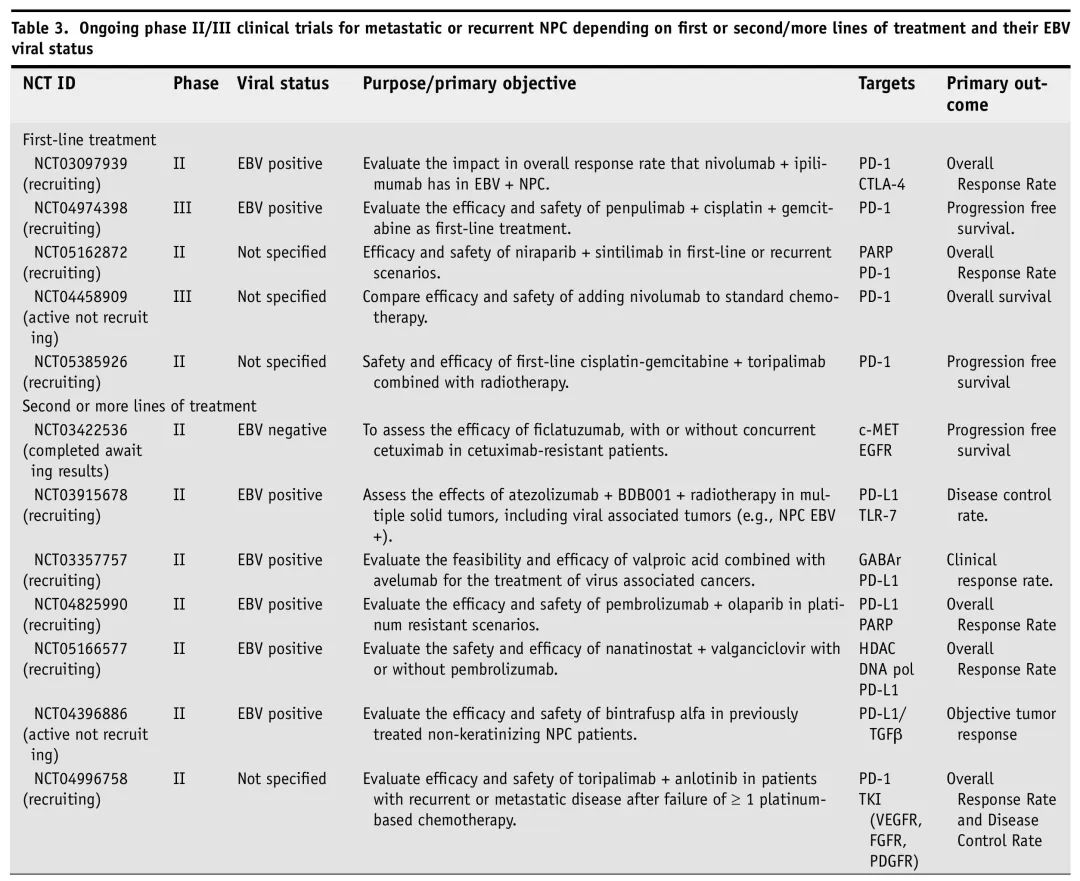
正在进行的关于寡转移性疾病放疗的2/3期试验包括研究卡瑞利珠单抗+立体定向放疗(NCT04944914)、巩固放疗+卡瑞利珠单抗(NCT05128201)+化疗、放疗+ PD-1抑制剂(NCT05290194)、全靶点巩固放疗(NCT05431764),以及放疗+特瑞普利单抗+化疗(NCT05385926)。
靶向和免疫治疗
了解癌症遗传学和肿瘤生物学,包括分子和免疫微环境,对于探索新的治疗策略至关重要。如“肿瘤生物学”部分所述,PD-L1,SSTR2,BRCA,以及EBV与NF-kB通路之间的关系在NPC肿瘤发生中起着重要作用。一个重要的通路是NF-κB转录因子,在EBV + NPC中上调。有证据表明,NF-κB和调节其作用的信号通路异常与癌症的生长、发展和对治疗的耐药性有关。这些生物标志物包括免疫微环境,癌症遗传学和分子生物学,创造了NPC的新疗法。
免疫检查点抑制剂
加用免疫检查点抑制剂(ICI)作为初始治疗是一种很有前途的方法。值得一提的是,ICI仍在开发中,主要在临床试验中可及。ICI作为一线治疗总是与化疗联合使用,优先使用顺铂-吉西他滨。在顺铂-吉西他滨的基础上加用特瑞普利单抗(抗PD-1 IgG4抗体)、卡瑞利珠单抗(PD-1抑制剂)或替雷利珠单抗(PD-1抑制剂)等ICI,可显著改善PFS。这种联合用药的影响很大,ESMO-EURACAN临床指南强调了在铂类-吉西他滨的基础上加用卡瑞利珠单抗或特瑞普利单抗作为转移性NPC一线治疗改善PFS的重要性。
这些联合疗法在中国已获得批准,在美国正在等待FDA批准。因此,应大力鼓励临床试验。特瑞普利单抗、卡瑞利珠单抗和替雷利珠单抗目前在亚洲使用。与安慰剂+标准化疗相比,特瑞普利单抗+顺铂-吉西他滨作为一线治疗可改善PFS(11.7 vs 8.0个月),并将死亡风险降低40%。与单用顺铂-吉西他滨相比,卡瑞利珠单抗+顺铂-吉西他滨也改善了PFS(9.7 vs 6.9个月)。最后,替雷利珠单抗+顺铂-吉西他滨改善了患者PFS(9.6 vs 7.4个月),且毒性相似。该研究还报告了PFS2,即从随机化到后续二线治疗疾病进展或死亡的时间,显示替雷利珠单抗较优(未达到 vs 13.9个月)。这三项临床试验包括各自的ICI单药维持治疗。这提高了对ICI维持治疗在控制疾病、减少复发和改善OS方面的重要性的认识。这些研究包括在R/M NPC管理中使用纳武利尤单抗和帕博利珠单抗联合顺铂-吉西他滨。
ICI已在初始铂类化疗进展的患者中得到研究。2017年,KEYNOTE-028试验报告了帕博利珠单抗在既往接受铂类化疗患者中的抗肿瘤活性和安全性。帕博利珠单抗的ORR为25.9%,安全性可控。最近,KEYNOTE-122试验显示,帕博利珠单抗组和化疗组的OS(17.2 vs 15.3个月)、PFS(4.1 vs 5.5个月)和ORR(21.4 vs 23.3%)没有差异。与化疗组相比,ICI组的不良事件较少。纳武利尤单抗是化疗难治性患者的另一种选择,NCI-9742试验中ORR与帕博利珠单抗相似(20.5%),疾病控制率为54.5%,OS为17.1个月,PFS为2.8个月。在CheckMate-358试验中观察到类似的生存和缓解获益,纳武利尤单抗的ORR为20.8%,疾病控制率为45.8%,PFS为2.4个月。NCI-9742试验还将PD-L1,HLA-A,HLA-B表达和血浆EBV-DNA病毒清除与ORR和存活率相关联,得出结论,一种或两种HLA-1蛋白表达缺失与较好的PFS相关。确定HLA-A和HLA-B作为预后因素。最后,POLARIS-02试验报告,特瑞普利单抗的ORR为21%,PFS为2个月,OS为17个月。此外,EBV拷贝数减少≥50%的患者ORR较优,而11q13区域(包括CCND1、FGF14、FGF3和FGF4基因)扩增或ETV6基因变异的患者对特瑞普利单抗的反应较差。
其他ICI包括卡瑞利珠单抗(PD-1抑制剂),与顺铂-吉西他滨联合作为初始治疗。一项试验报道了一线化疗后其用作单药治疗,ORR为31%,PFS为5.6个月,毒性可耐受。此外,CAPTAIN研究分析了卡瑞利珠单抗在化疗难治性R/M NPC中的应用,ORR为28.2%,PFS为3.7个月,OS为17.4个月。研究发现,表达高基质MHC-II细胞密度和PD-L1的患者反应较好。美国癌症研究协会的一项研究分析了spartalizumab(PD-1抑制剂)用于化疗难治性患者的疗效。尽管无PFS或ORR获益,但报告的3-4级不良事件较少,肿瘤缓解较长,尤其是在具有IFN-y特征、TIM3和LAG3基因表达的患者中。这些临床试验的目标不仅是发现新药,还有识别预后生物标志物,来帮助指导和筛选能从这些治疗中获益的患者。
ICI彻底改变了R/M NPC患者的管理。仍需要在随机试验中评估其他检查点抑制剂,预测疗效。
分子疗法
PARP抑制剂
抑制PARP1蛋白是治疗NPC的一种新型靶向机制,由于其与BRCA突变、不同同源重组基因变异的相关性以及NPC细胞中PARP1上调。包括NPC细胞在内的癌细胞具有逃避免疫系统的机制,如产生免疫抑制微环境和负共刺激信号(PD-L1)。因此,PARP抑制剂+PD-1/PD-L1抑制剂可以增强其抗癌活性,是一种有效的治疗方法。
大多数研究PARP抑制剂的试验正在进行中。一项研究表明,奥拉帕利在NPC细胞中具有凋亡、DNA损伤和细胞周期阻滞作用,可增强化疗和放疗的活性。在其他研究中,NFBD1(核蛋白)耗竭增强奥拉帕利的作用,使其成为PARP抑制剂耐药患者的一种策略。有三项正在进行的大型2期临床试验评估PD-1 + PARP抑制剂在一线化疗失败的R/M NPC中的疗效。这些试验包括帕博利珠单抗(PD-1抑制剂)+奥拉帕利(NCT04825990)、卡瑞利珠单抗(PD-1抑制剂)+氟唑帕利(PARP抑制剂)(NCT04978012),以及尼拉帕利(PARP抑制剂)+信迪利单抗(PD-1抑制剂)(NCT05162872),其主要结局是ORR。
EGFR抑制剂
在多种癌症(包括NSCLC,白血病和HNC)中,表皮生长因子受体(EGFR)已成为治疗靶点,EGFR表达与侵袭性肿瘤表型相关,因此,在某些情况下,靶向EGFR已成为一种治疗选择。据报道,高达85%的NPC表达EGFR,其表达与较差的结局相关。试验研究了EGFR抑制剂主要用于一线化疗无反应者的疗效。
Chan等人将西妥昔单抗与卡铂联合使用,显示出临床活性,ORR为11.7%,PFS为81天,OS为233天,仅占报告的毒性的31.7%。西妥昔单抗-卡铂被确定为铂类耐药R/M NPC的治疗选择。还评估了其他EGFR酪氨酸激酶抑制剂。吉非替尼在R/M HNSCC中表现出临床缓解(ORR 10.4%,疾病控制率53%)。后来,吉非替尼表现出良好的安全性,未报告3-4级毒性,然而,没有患者获得ORR,PFS 4个月,OS 16个月。另一项2期试验也评估了吉非替尼在转移性和局部区域复发性NPC中的表现。结果相似,吉非替尼耐受性良好,但没有患者获得ORR、PFS 2.7个月,OS 12个月。最近,厄洛替尼(EGFR酪氨酸激酶抑制剂)用作R/M NPC顺铂-吉西他滨治疗6周后的维持治疗,耐受性良好,但未观察到对患者ORR或生存率(PFS 6.9个月;12个月OS 80%)的影响。尽管报告的有效性较低,但后两项试验识别了血浆EBV-DNA作为治疗反应的潜在生物标志物。影像学疾病进展与血浆EBV-DNA水平升高有关,疾病稳定持续时间最长的患者与检测不到的水平相关。
EGFR抑制剂对R/M NPC管理的影响较小,只有在一线化疗后复发/进展或化疗耐药的患者中才应考虑使用EGFR抑制剂。
VEGFR抑制剂
靶向血管内皮生长因子受体(VEGFR)是另一种已被研究的分子疗法。在60-67%的NPC中发现了VEGFR过表达,与生存率低相关。VEGFR通路在血管生成、肿瘤生长和转移中起重要作用,因此其抑制是潜在的靶标。
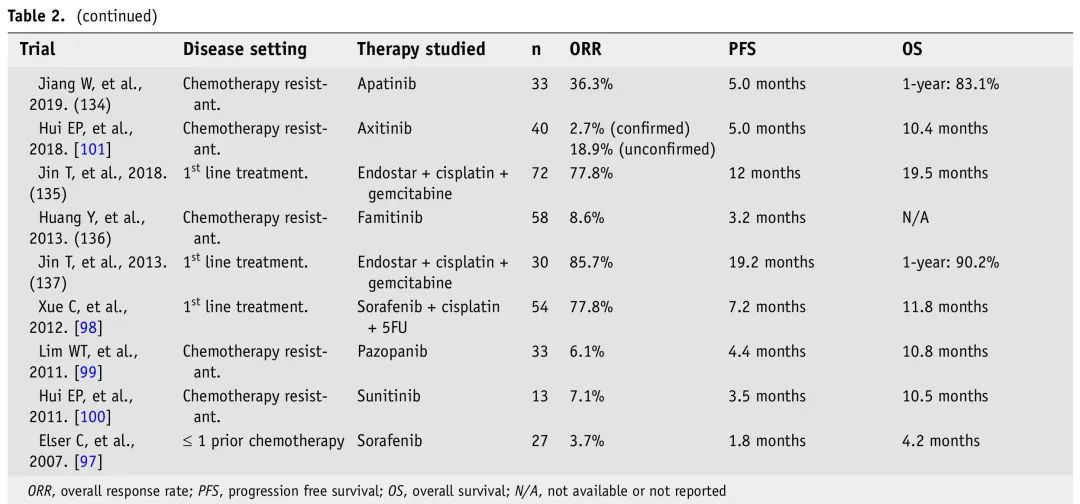
索拉非尼是一种多激酶抑制剂,可阻断丝氨酸/苏氨酸激酶C-Raf和B-Raf,VEGFR-2和3以及血小板衍生生长因子受体,在两项试验中得到研究。2007年,评估了索拉非尼单药治疗R/M HNSCC和NPC,疗效中等,ORR为3.7%,PFS为1.8个月,OS为4.2个月。不过,索拉非尼耐受性良好,无4级毒性,并显示出抗癌作用,治疗后pERK,Ki67和Mcl-1(抗凋亡蛋白)表达降低。随后,一项2期试验评估了索拉非尼+顺铂-5FU作为一线治疗,报告ORR为77.8%,PFS为7.2个月,OS为11.8个月,但出血发生率为22%。这使得索拉非尼联合化疗成为R/M NPC患者的可行疗法,标准化剂量以避免不良事件很重要。探索了培唑帕尼(多激酶抑制剂)用于≥1线化疗失败的WHO II和III R/M NPC,临床获益率(CBR)为54.5%,ORR为6.1%(仅部分缓解),PFS为4.4个月,OS为10.8个月。重要的是,报告了一例患者死于鼻衄,78.6%报告了3-4级毒性,肿瘤血流显著减少。尽管培唑帕尼被证明具有抗癌作用,但由于潜在的致命不良事件,其与其他细胞毒性药物一起使用可能会限制其给药。Hui等分析了舒尼替尼的疗效,发现在既往接受过高剂量放疗的患者中,出血发生率较高(64%),主要来自上呼吸道消化道,且舒尼替尼临床活性较低。出血事件使研究人员考虑安全预防措施,VEGFR抑制剂治疗排除先前接受过RT和/或肿瘤侵犯重要血管结构的患者。
VEGFR抑制剂仍在研究中。2018年,阿昔替尼在经治患者中得到探索,不包括局部复发或血管浸润的患者(由于出血事件的风险增加)。3个月时CBR为78.4%,6个月时为43.2%,PFS为5个月,OS为10.4个月,仅报告1-2级出血,最常见的不良事件是高血压。高血压被确定为临床疗效和毒性的生物标志物。阿昔替尼似乎在经治R/M NPC患者中安全性较高,疾病控制持久,使其成为与ICI、化疗或放疗联合使用的潜在药物。2020年,评估了新型VEGFR-2抑制剂阿帕替尼的疗效,报告ORR为31.37%,PFS为9个月,OS为16个月。治疗耐受性良好,最常见的不良事件是高血压和手足综合征。阿昔替尼和阿帕替尼似乎是可能与细胞毒性药物联合使用的最耐受药物。
尽管VEGFR抑制剂尚未显示出患者生存和缓解的改善,但VEGFR在NPC细胞中的高表达及其抗癌作用提示应继续探索这种疗法。这有助于具有更高疗效和更少不良事件的新药的开发。
靶向EBV的疗法
免疫疗法侧重于靶向病毒相关恶性肿瘤。原理是模拟免疫系统(主要是T细胞)对抗NPC细胞中表达的病毒抗原。这种免疫疗法正在低分化(WHO II型)和未分化(WHO III型)NPC中进行研究。
CTLs和TILs
过继免疫疗法是独特的促进免疫应答的方法,避免了抗原呈递和效应细胞直接活化。许多临床前研究探索了细胞毒性T细胞(CTLs)和肿瘤浸润淋巴细胞(TILs)在EBV+ R/M NPC治疗中的应用。由于NPC肿瘤细胞通常感染EBV,通过对患者血液中EBV特异性CTL前体(CTLp)的去鉴定,使用该病毒作为靶向治疗的想法是可能的。健康人群和NPC患者的CTLp不同,后者的值较低,且根据疾病分期而变化。晚期NPC患者输注自体EBV-CTLs通常显示CTLp水平升高,恢复宿主对EBV复制的监测并降低血浆EBV负荷。
I期试验表明,自体CTLs可用于治疗晚期NPC。一项研究中,4例处于缓解状态的患者维持无疾病状态,6例难治性疾病患者,2利获得完全缓解,且在治疗后11-23个月保持缓解。一项类似的研究显示,10例化疗进展的IV期NPC患者中,6例患者疾病进展得到控制,并诱导了针对EBV的特异性LMP-2应答。Gottschalk和Louis等人表明,EBV-CTLs是安全的,具有抗肿瘤活性,CTLs对特定EBV抗原的特异性影响结果。此外,他们表明,1年和2年PFS率分别为65%和52%,OS率分别为87%和70%。另一项试验纳入了21例一线化疗进展的患者接受治疗,尽管生存率和缓解与预期不符(2.2个月PFS和16.7个月),但获得了2个阳性结果。一名患者达到完全缓解并缓解了>8年,两名EBV-CTL失败的患者相比先前失败的化疗方案反应更好。证明可通过CTL对EBV进行靶向治疗。
几项研究评估了CTLs作为一线治疗。Chia等人评估了在吉西他滨-卡铂之后使用CTLs的安全性,结果显示,ORR为71.4%,2年和3年OS率分别为62.9%和37.1%,5例患者自CTL开始后34个月内不需要额外化疗。R/M NPC患者生存取得了特别积极的结果,2022年,发表了III期试验(VANCE)的结果。VANCE试验比较了吉西他滨-卡铂+EBV-CTL vs 仅吉西他滨-卡铂。试验组的OS为25个月,与标准治疗(24.9个月)相比没有益处,PFS更短(7.9 vs 8.5个月);然而,保持了安全性。关于治疗反应,试验组和标准化疗组的ORR和CBR相似,ORR分别为61.0%和63.3%,CBR分别为84.8%和81.9%。分析tabelecleucel(同种异体EBV特异性T细胞免疫疗法)+帕博利珠单抗用于EBV+ NPC的NCT03769467试验于2022年终止,尚未公布结果。最后,TILs已应用于局部区域晚期NPC同步放化疗后治疗。该疗法在23例患者中进行了研究,其中20例获得ORR,治疗6个月后,17例患者未检测到血浆EBV-DNA。TIL可能有效且安全,在晚期NPC患者的管理中具有潜在用途,应进一步研究。
这些试验表明,通过CTLs或TILs靶向EBV是一种有效的方法,安全性较高。随着改进这些疗法的新技术的发展和充分的临床试验的开展,CTLs或TILs可能成为未来的新标准治疗。
疫苗
疫苗在多种类型的癌症中是一种有前途的治疗方法,包括NPC,因为它是一种病毒驱动的肿瘤。大多数疫苗试验都是1期,但结果很有希望。2002年,将EBV肽脉冲树突状细胞直接注射到复发NPC患者的腹股沟淋巴结进行免疫。免疫诱导CD8 T细胞对EBV的功能性反应,导致肿瘤缩小。
疫苗的目标是刺激T细胞对肿瘤细胞表达的EBV抗原的反应并诱导肿瘤凋亡。最受认可的NPC疫苗试验之一(Ankara)使用了EBV毒株的改良基因序列,结合了两种主要的EBV抗原EBNA1和LMP2。EBNA1特异性CD4记忆T细胞和LMP2特异性CD8记忆T细胞有效再激活,能够增强免疫系统特异性对抗NPC肿瘤细胞。这些发现使人们评估Ankara是否可作为流行性NPC患者潜在的治疗策略。试验评估了缓解患者,报告T细胞对一种或两种EBV抗原的反应增加,该反应与疫苗剂量直接相关。后来,在非流行性NPC中也采用了相同的方法。该试验还报道了对一种或两种病毒抗原的免疫增强,EBV毒株之间表位的识别以及EBNA1和LMP2特异性T细胞的功能分化。该疫苗在流行性和非流行性病例中均显示出抗癌作用。
Chia等人采用了不同的方法,用具有截短LMP1/LMP2蛋白的腺病毒转导的自体树突状细胞使患者免疫。与Ankara试验类似,未报告严重毒性,体外针对LMP1/2的特异性T细胞活化,但外周未增加。3/16利患者有临床反应,是一种安全和免疫原性的疫苗。其他靶向LMP2的疫苗也报道了类似的结果,接种疫苗后IL-2、IF-y、自然杀伤细胞、CD4 T细胞升高,血清EBV-DNA水平降低。ASCO 2020年会上,评估CD137L-DC-EBV-VAX的NCT03282617试验结果公布。该疫苗刺激CD137L-树突状细胞对抗LMP1/2。5例患者报告了临床获益,IFN-y升高,PFS为26周,中性粒细胞/淋巴细胞比值低于3的患者PFS延长。
所有这些试验都表明了对EBV抗原强大的免疫原性活性,因此是潜在的治疗选择,特别是用于维持缓解或先前治疗失败患者。正在等待两项临床试验的结果,包括NCT01094405,评估重组EBV疫苗(EBNA/LMP2)用于常规治疗后残留EBV-DNA载量的患者,以及NCT01800071,评估疫苗MVA-EBNA1/LMP2免疫反应。
CAR-T疗法
嵌合抗原受体T细胞(CAR-T)疗法是一种新型疗法,由于对无反应白血病的管理有积极影响,在实体瘤中也得到更多研究。CAR-T疗法的原理是获得T细胞毒性淋巴细胞,以高选择性识别和消除肿瘤相关抗原,破坏肿瘤细胞。已证明其对EBV抗原表达缺失的癌症有效。可选择CAR-T疗法对抗EBV抗原缺失的癌细胞,靶向其他肿瘤抗原(如CD30肿瘤细胞),破坏EBV-/CD30+肿瘤细胞。正在进行的I期临床试验(NCT01818323)评估了自体CAR对抗ErbB(在HNC中高表达)。关于对EBV+ NPC的特定作用,Tang等人证明CAR-T疗法可减少肿瘤生长。这项研究使用CAR-T疗法靶向LMP1 NPC细胞,产生IL2和IFN-c反应,减少肿瘤生长。CAR-T疗法可以作为EBV+ NPC治疗的替代方法。
设计了多项试验,包括靶向在肿瘤转移和侵袭中起重要作用的上皮细胞粘附分子的NCT02915445(目前正在招募),通过CAR-T靶向LMP1的NCT02980315(状态未知),靶向γ-δT细胞的NCT04107142(状态未知),通过T细胞受体(TCR)靶向LMP2的NCT03925896(状态未知),以及通过TCR靶向LMP1 / LMP2 / EBNA1的NCT03648697(状态未知)。
溶瘤病毒
这种疗法直接杀死癌细胞,选择性地在肿瘤内扩散,不会损伤健康组织。溶瘤病毒分泌细胞因子和趋化因子,促进肿瘤抗原表达,导致免疫细胞募集到肿瘤中。还可能插入有助于癌细胞选择性的外源DNA序列,较为安全。NPC溶瘤病毒治疗领域的重要进展之一是中国食品药品监督管理局批准H101(Oncorine),这是一种转基因溶瘤腺病毒,与化疗联合使用。这项III期试验显示,H101+化疗的ORR为78.8%,安全性较高。
还研究了其他病毒,如单纯疱疹病毒(HSV)。与其他HSV模型相比,第三代HSV1 G47Δ在EBV+ NPC中表现出抗肿瘤作用,完全消退,体内存活期更长。另一种HSV溶瘤病毒是T-VEC(基因工程HSV-Talimogene Laherparepvec)疗法,单独或与免疫疗法联合使用可能对NPC具有潜在的抗肿瘤作用,FDA批准其用于黑色素瘤,且在HNC中显示出有希望的结果。最后,Smith等人使用腺病毒载体运输CTLs,将T细胞疗法与癌病毒相结合。该治疗的OS为38.1个月,PFS为5.5个月,可作为化疗后巩固治疗的替代疗法。
溶瘤病毒疗法是一种新型方法,具有肿瘤特异性活性,副作用较小。尽管需要更多的试验,Oncorine的获批和G47Δ有希望的结果使溶瘤病毒成为一种可以单独使用或与其他疗法联合使用的疗法。
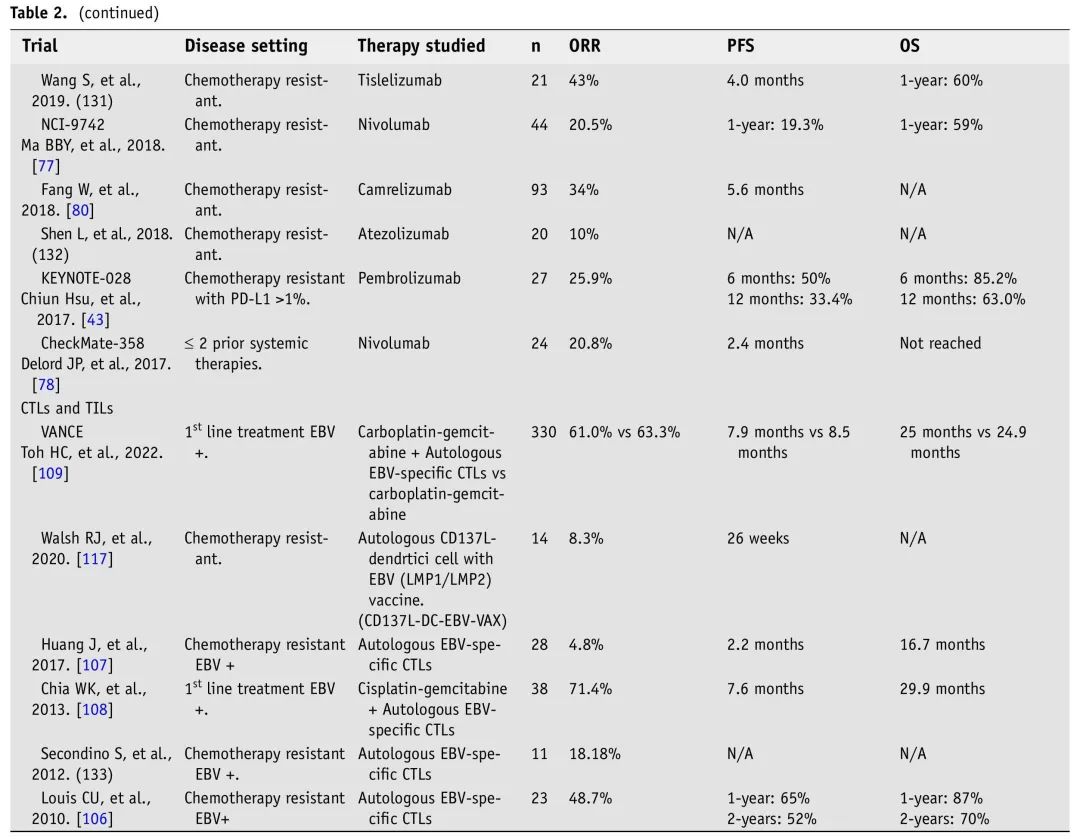
已经开发了针对R/M NPC的新疗法,具有抗癌作用,有希望的疗效和较低的毒性。NPC的总体免疫模型使患者适合免疫治疗,尤其是ICI。EBV疫苗和其他过继免疫疗法是NPC的治疗选择,结果有希望。需要研究影响免疫治疗耐药性的免疫逃逸的分子和细胞成分,从而可能导致新的治疗方法,改善反应和患者预后。表2总结了我们认为最重要的R/M NPC免疫疗法和靶向分子疗法试验结果。
表2. R/M NPC免疫和靶向治疗临床试验

正在进行的2/3期临床试验
多项正在进行的2/3期临床试验纳入了复发/转移性NPC,评估不同新疗法作为一线和二线或后续治疗。表3总结了这些正在进行的试验。
表3. 正在进行的R/M NPC 2/3期临床试验

总 结
R/M NPC的预后通常较差。目前,含铂双药化疗是较好的选择。正在进行的研究取得了有希望的结果,改善了患者生存。免疫治疗单药或联合化疗领域的进展改善了结局和生存。目前正在探索其他免疫疗法和分子靶向疗法,可能使这种疾病有额外的治疗选择。全外显子组测序尚未表明该疾病有可操作的特征。需要对病毒和表观遗传通路进行更多研究。
参考文献:
Juarez-Vignon Whaley JJ, Afkhami M, Onyshchenko M, Massarelli E, Sampath S, Amini A, Bell D, Villaflor VM. Recurrent/Metastatic Nasopharyngeal Carcinoma Treatment from Present to Future: Where Are We and Where Are We Heading? Curr Treat Options Oncol. 2023 Sep;24(9):1138-1166. doi: 10.1007/s11864-023-01101-3. Epub 2023 Jun 15. PMID: 37318724; PMCID: PMC10477128.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言