肺鳞癌vs非鳞癌,哪些PD-L1表达的患者用免疫治疗效果更好?
2023-12-29 苏州绘真医学 苏州绘真医学 发表于上海
本研究分析了17项III期临床研究和一项回顾性研究,以确定PD-L1表达的预测能力在鳞状和非鳞状NSCLC之间是否不同。

肺癌每年造成180万人死亡。非小细胞肺癌(NSCLC)占肺癌的85%。虽然手术对于早期患者有效,但大多数新发现的美国肺癌病例都是III/IV期。PD-1/PD-L1抗体免疫治疗改善了NSCLC患者的生存。PD-L1蛋白表达被广泛用作预测性生物标志物,为治疗决策提供信息。然而,只有部分患者(27%-39%)对PD-L1/PD-1治疗有反应。免疫组化测定的PD-L1蛋白表达在识别对治疗敏感和不敏感患者方面存在缺陷。鉴于鳞状和非鳞状NSCLC的不同特征,PD-L1水平预测哪些患者可从免疫治疗中获益的能力在两种组织学亚型之间可能有所不同。本研究分析了17项III期临床研究和一项回顾性研究,以确定PD-L1表达的预测能力在鳞状和非鳞状NSCLC之间是否不同。对于接受单药或双重免疫检查点抑制剂(ICI)治疗的NSCLC患者,与鳞癌相比,在非鳞癌中PD-L1表达更能预测获益。对于接受单药ICI治疗的患者,在非鳞癌患者中,PD-L1 TPS较高患者的生存期是TPS较低患者的2.0倍;在鳞癌患者中,该差异为1.2至1.3倍。对于接受ICI联合化疗的患者,PD-L1水平的预测价值在不同组织类型之间没有明显差异。我们鼓励未来的研究分别分析鳞状和非鳞状NSCLC中PD-L1表达的预测价值。
研究背景
肺癌是最常见的癌症死亡原因,导致全球每年180万人死亡,占2020年癌症死亡人数的18%,总死亡人数的3%。2020年肺癌在全球有220万例新诊断病例,是仅次于乳腺癌的第二大常见癌症类型。非小细胞肺癌(NSCLC)占肺癌的85%。
免疫疗法改善了NSCLC的结局,特别是对于驱动基因突变阴性的晚期疾病患者。最近,辅助免疫疗法也改善了早期疾病患者的预后。 在临床试验中,PD-L1表达作为伴随诊断,显示出预测价值。尽管在没有明确驱动基因突变的NSCLC患者中,PD-L1免疫组化(IHC)是目前经过大量验证的预测生物标志物,用于指导治疗决策,但它并不完美。许多PD-L1 IHC评分为阴性的患者对免疫治疗仍有反应,而一些PD-L1 IHC评分较高的患者却没有反应。组织学亚型对PD-L1 IHC检测预测能力的影响尚不明确。
研究结果
鳞状和非鳞状NSCLC是不同的
鳞状和非鳞状NSCLC在病因、位置、形态学和免疫学特征方面存在差异。鉴于这两种组织学亚型之间的差异,PD-L1作为预测生物标志物的作用在鳞状和非鳞状NSCLC之间也可能显著不同。
腺癌,特别是从不吸烟的腺癌患者,通常存在单个致癌驱动突变,可以进行靶向治疗。最常见的突变是KRAS突变(32%),EGFR突变(12%)和ALK重排(5%)。肺癌中常见的某些KRAS突变亚型与吸烟有关,而EGFR突变和ALK重排多常见于从不吸烟者。
鳞癌的分子特征较腺癌通常更复杂,突变频率更高。针对EGFR和ALK突变的靶向治疗对鳞癌的疗效较差,接受EGFR靶向治疗的鳞癌的无进展生存期(PFS)为4.9个月,而腺癌为10至19个月,接受ALK靶向治疗的鳞癌的PFS为2.9个月,而腺癌为24至36个月。此外,与单独化疗相比,免疫联合化疗似乎没有改善鳞状NSCLC女性患者的结局。与腺癌相比,鳞癌基因组不稳定性更高,TP53突变发生率往往更高(81% vs 46%)。与腺癌相比,鳞状NSCLC与吸烟更密切相关,很少有患者从不吸烟。鳞癌的肿瘤突变负荷(TMB)也高于腺癌,很可能是由于与吸烟有关。一项研究纳入了372例接受手术切除的NSCLC,发现鳞癌的TMB是腺癌的3.5倍。
接受免疫治疗和/或化疗的鳞状NSCLC患者结局比非鳞状NSCLC患者差。一项Flatiron数据库研究分析了4271例2016年至2020年间接受免疫治疗(联合或不联合化疗)的III-IV期肺癌患者,鳞状NSCLC患者的中位OS为10.6个月(95%置信区间[CI] 9.3-11.8),而非鳞状NSCLC患者为12.0个月(95% CI,11.3-12.8)。在PD-L1疗法获得批准之前,2010年的一项分析发现,腺癌NSCLC患者的1年OS率为34.2%,而鳞状NSCLC患者为28.7%。
需要更好的NSCLC免疫治疗标志物
NSCLC患者接受PD-L1/PD-1免疫检查点抑制剂(ICI)治疗经常与PD-L1水平无关。一项关于45631例美国晚期NSCLC患者的研究显示,32.3% PD-L1表达为0%的患者接受了ICI作为一线治疗,通常与化疗联合使用。
此外,虽然在总体队列中,ICI治疗改善了患者预后,但从单个患者来看,大多数患者对ICI治疗没有反应。例如,Keynote-042研究显示,在PD-L1 TPS≥50%的初治患者中,帕博利珠单抗组(N = 299)的客观缓解率仅为39%,而化疗组为32%。在PD-L1≥20%和≥1%的患者中,帕博利珠单抗组的客观缓解率分别为33%和27%。在CheckMate 227研究中,纳武利尤单抗加伊匹木单抗组(N = 583)的客观缓解率为35.9%,而化疗组(N = 583)为30.0%。在PD-L1 TPS为≥50%的患者中,塞米普利单抗组的客观缓解率为39%(N = 283),而化疗组为20%。
确定更有效的生物标志物来识别哪些患者最有可能从ICI中获益,可以优化晚期NSCLC的治疗策略。鉴于鳞状和非鳞状NSCLC之间的生物学差异,探索了PD-L1的预测能力是否因组织学亚型而异。
PD-L1作为生物标志物的有效性是否因组织学亚型而异?
如表1所示,在接受单药ICI治疗的NSCLC患者中,主要是非鳞状NSCLC患者表现出PD-L1水平较高患者获益较多。非一线纳武利尤单抗Checkmate 057和017研究分析显示,在非鳞状NSCLC患者中,PD-L1 TPS ≥ 10%的患者相比< 10%的患者,缓解率为3.4倍,无进展生存期(PFS)为2.4 倍,总生存期(OS)为2.0倍。相比之下,在鳞状NSCLC患者中,PD-L1 TPS ≥ 10%和< 10%患者之间的差异较小,PD-L1 TPS ≥ 10%的患者相比< 10%的患者,缓解率仅为1.2倍,PFS为1.6倍,OS为1.3倍(表2)。
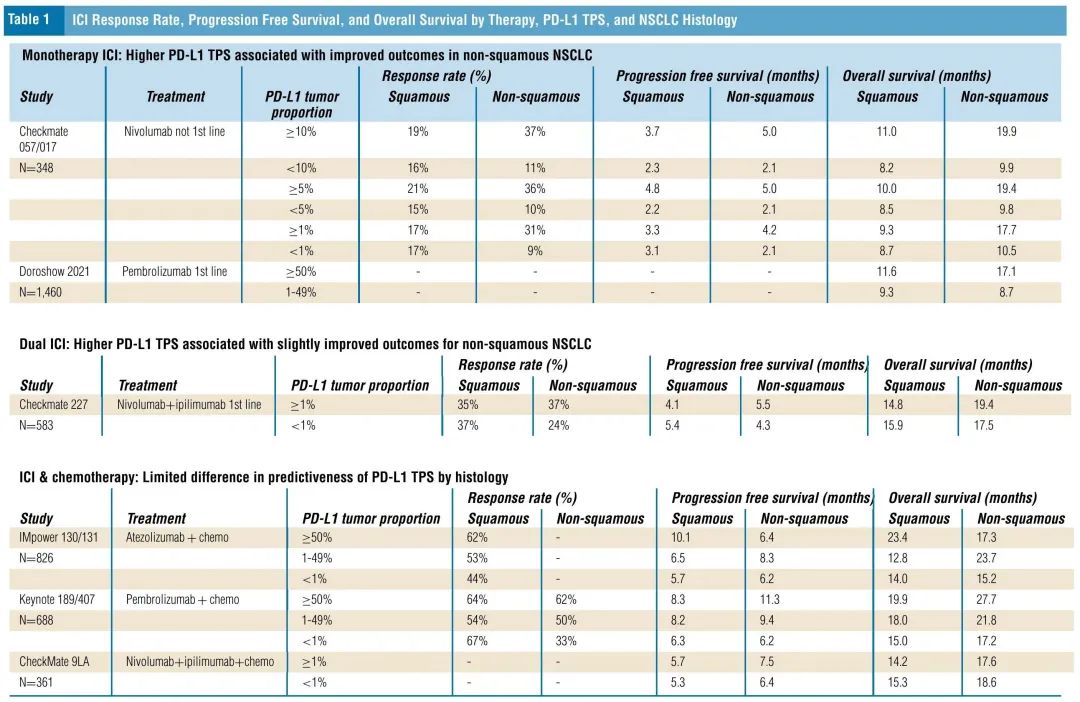
表1. 缓解率、PFS和OS,按疗法、PD-L1 TPS和NSCLC组织学亚型分类

表2. 单药ICI治疗的缓解率、PFS和OS,按PD-L1 TPS和NSCLC组织学亚型分类
一项关于一线帕博利珠单抗有效性的回顾性研究按组织学亚型分析疗效,发现了类似的结果。在非鳞状NSCLC患者中,PD-L1 TPS较高(≥50%)患者的OS是PD-L1 TPS较低(1-49%)患者的2.0倍。相比之下,在鳞状NSCLC患者中,PD-L1≥50%患者的OS是1-49%患者的1.2倍(表2)。
如表1所示,按组织学亚型分析了Checkmate 227研究中接受纳武利尤单抗联合伊匹木单抗治疗的患者。PD-L1水平的预测能力似乎在非鳞状NSCLC患者中较好,PD-L1水平较高与结局较好相关:PD-L1≥1%的患者相比PD-L1< 1%的患者,缓解率为1.5倍,PFS为1.3倍,OS为1.1倍。相比之下,PD-L1水平的预测能力在鳞状NSCLC队列中较差,PD-L1 ≥1%的患者结局略差于PD-L1<1%的患者:PD-L1≥1%队列相比<1%队列,缓解率为0.9倍,PFS为0.8倍,OS为0.9倍(表3)。
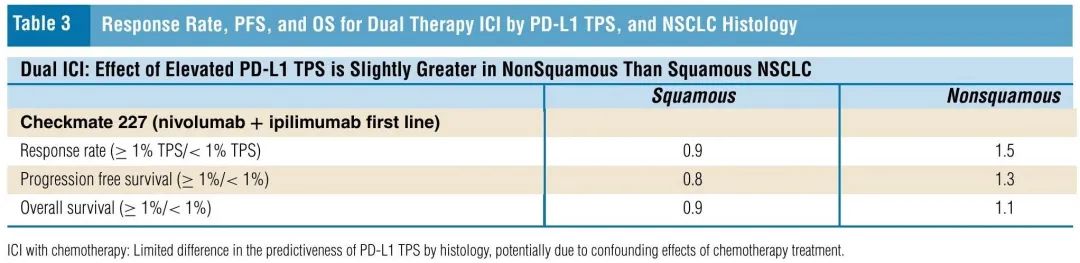
表3. 双重ICI治疗的缓解率、PFS和OS,按PD-L1 TPS和NSCLC组织学亚型分类
表1底部展示了接受免疫联合化疗的患者根据组织学亚型和PD-L1水平分层的结局。对于接受双重ICI联合化疗的患者,在非鳞癌和鳞癌患者中,较高的PD-L1水平均与较好的结局相关。
在接受阿替利珠单抗联合化疗的非鳞状NSCLC患者中,PD-L1 TPS≥50%的患者与<1%的患者结局相似,PD-L1 TPS 1%-49%的患者相比<1%的患者,PFS为1.3倍,OS为1.6倍。此外,在接受帕博利珠单抗联合化疗的非鳞状NSCLC中,PD-L1≥50%的患者相比PD-L1<1%的患者,缓解率为1.9倍,PFS为1.8倍(表4)。≥50%队列的中位OS为<1%队列的1.6倍,≥50%队列的5年生存率为30%,而<1%队列为10%。
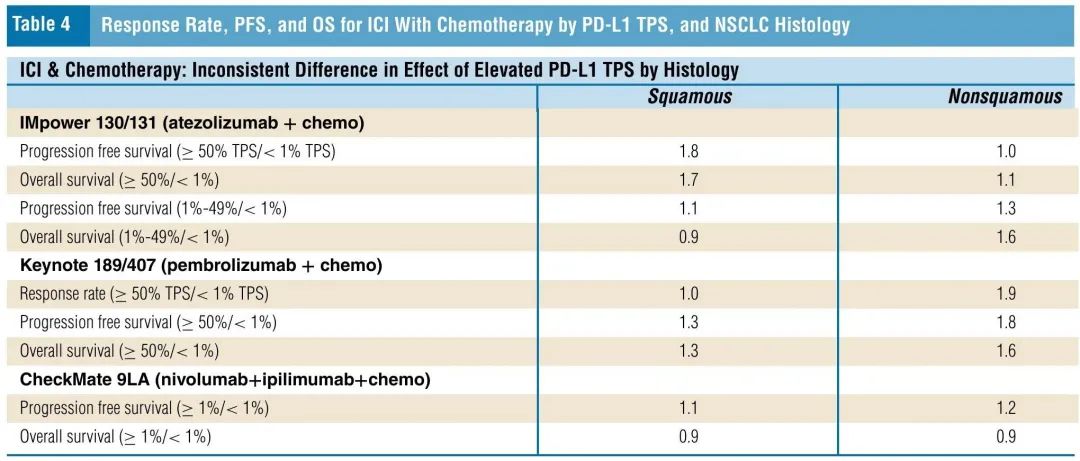
表4. ICI联合化疗的缓解率、PFS和OS,按PD-L1 TPS和NSCLC组织学亚型分类
在接受阿替利珠单抗联合化疗的鳞状NSCLC患者中,PD-L1 TPS ≥50%的患者相比PD-L1 < 1%的患者,缓解率为1.4倍,PFS为1.8倍,OS为1.7倍。在接受帕博利珠单抗联合化疗的鳞状NSCLC患者中,PD-L1≥50%的患者相比<1%的患者,PFS和OS为1.3倍,缓解率相似。≥50%队列的5年OS率为23%,而<1%队列为10%(2.3倍;非鳞状NSCLC患者为3.0倍)。
讨 论
鉴于鳞状和非鳞状NSCLC之间的明显差异, 本研究发现PD-L1水平的预测能力在两种组织学亚型之间有所不同(特别是对于单药免疫治疗)不足为奇。一个区别是鳞状NSCLC与更高的肿瘤突变负荷(TMB)有关,因此更有可能引发免疫反应。当适应性免疫系统T细胞识别抗原呈递细胞(APC)上的外来抗原时,其被激活。TMB越高,细胞就越有可能在膜上呈现外来抗原,从而激活免疫系统。因此,TMB较高的患者更有可能对ICI有反应。此外,TP53突变在鳞状NSCLC中更常见,与免疫治疗缓解率增加有关。令人惊讶的是,在Checkmate 017/057单药治疗研究中,鳞状NSCLC患者的客观缓解率较低。虽然较高的TMB和TP53突变率与更好的免疫治疗反应有关, 但其也与更高的基因组不稳定性有关,可能导致鳞状NSCLC患者的生存结局较差。一项前瞻性研究发现,血液检测评估的TMB,未能预测鳞状NSCLC的ICI结局较好,但可以预测腺癌的ICI结局较好。
鳞状和非鳞状NSCLC之间的另一个关键区别是,携带已知驱动突变的腺癌的肿瘤微环境(TME)中CD8肿瘤浸润淋巴细胞有限,降低了ICI的有效性。对10名腺癌患者和9名鳞癌患者的组织RNA测序分析发现,腺癌中的主要功能性巨噬细胞是脂肪酸结合蛋白4(FABP-4),鳞癌中是分泌型磷酸蛋白1(SPP1)。此外,鳞癌通常具有非常高的基因组不稳定性。适应性免疫系统逃逸使肿瘤生长。ICI阻断抑制免疫系统的检查点蛋白。抗PD-1抗体通过限制T细胞耗竭来增强CD8 T细胞的细胞毒性作用。此外,抗PD-1抗体下调淋巴器官和TME中调节性T细胞的免疫抑制信号(如FoxP3)。
值得注意的是,非鳞状和鳞状NSCLC具有相似的PD-L1表达水平。一项研究探索了2368例NSCLC患者(1846例非鳞癌,500例鳞癌),发现腺癌中49%的患者PD-L1 TPS < 1%,而鳞癌中为43%。腺癌中22%的患者PD-L1 TPS≥50%,而鳞癌中为23%(表5)。
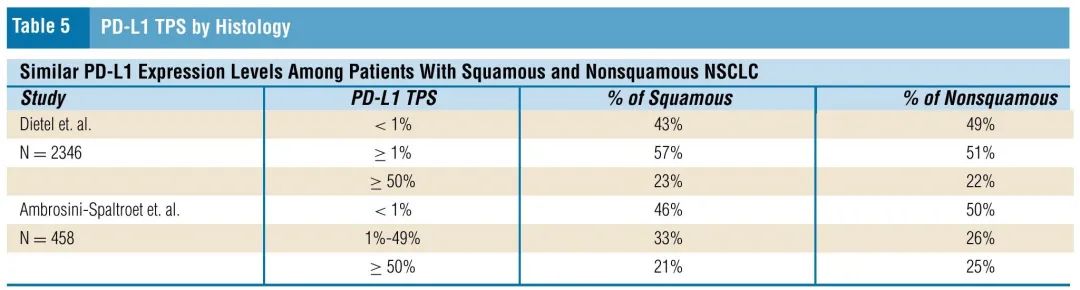
表5. PD-L1 TPS,按组织学亚型分类
本研究表明,相比鳞状NSCLC,在腺癌中PD-L1水平更能预测患者预后较好。然而,无论PD-L1水平和组织学亚型如何,免疫疗法都可能是一种有效的疗法。分析Checkmate 017,在PD-L1表达水平<1%的鳞状NSCLC患者中,与多西他赛相比,纳武利尤单抗治疗延长了总生存期(风险比0.58,95% CI 0.37-0.92)。OAK研究显示,在经治NSCLC患者中,与化疗相比,阿替利珠单抗改善了总生存期,无论PD-L1表达或组织学亚型如何。鳞状NSCLC是一种难以治疗的侵袭性疾病。尽管在ICI治疗后高PD-L1评分的腺癌患者可能结局最佳(如生存期最长),但ICI也是鳞状NSCLC患者的可行治疗选择,无论PD-L1评分如何。
结 论
对于接受免疫检查点抑制剂治疗的NSCLC患者,与鳞癌相比,在非鳞癌中,PD-L1 TPS似乎是更好的获益预测指标。这种较好的预测能力似乎在接受单药免疫检查点抑制剂治疗的患者中尤为显著。需要更多研究来进一步探索在接受双重免疫治疗和免疫联合化疗的患者中PD-L1 TPS作为生物标志物的可行性。
鉴于鳞状和非鳞状NSCLC在生物学和患者结局方面的差异,我们建议未来研究可根据组织学亚型评估生物标志物。不幸的是,许多III期试验(EMPOWER-Lung 1,EMPOWER-Lung 3,IMpower010,IMpower110,KEYNOTE-024,KEYNOTE-042,MYSTIC,OAK,PEARLS和POSEIDON)没有提供详细的按组织学亚型和PD-L1评分细分的患者结果。此外,应进一步研究其他生物标志物(如突变负荷,T细胞库和浸润)联合PD-L1水平的作用。识别预计免疫检查点抑制剂治疗结果欠佳的患者,可作为免疫联合疗法或其他疗法的候选者。由于NSCLC发病率较高,每年约有200万新发病例,且晚期NSCLC患者生存状况差,OS<1年,迫切需要识别新的和更好的生物标志物,来确定哪些患者对哪种治疗反应最好。
参考文献:
Meshulami N, Tavolacci S, de Miguel-Perez D, Rolfo C, Mack PC, Hirsch FR. Predictive Capability of PD-L1 Protein Expression for Patients With Advanced NSCLC: Any Differences Based on Histology? Clin Lung Cancer. 2023 Jul;24(5):401-406. doi: 10.1016/j.cllc.2023.03.014. Epub 2023 Apr 25. PMID: 37208221.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肺癌# #免疫治疗# #肺鳞癌# #PD-L1# #非鳞状NSCLC#
32