Nature:会传染的癌细胞?
2016-08-03 佚名 生物谷
近期,《自然》杂志报道了一项由美国哥伦比亚大学医学中心的Michael Metzger及其合作者完成的研究,他们发现,在一种双壳贝类的海洋贝类中存在可传播的癌症,而且这种癌症可在不同物种间转移。这意味着,在海洋环境当中,癌细胞可以被视作一种普遍的传染源。这不但挑战了我们对癌症本质的理解,还刷新了我们对癌细胞和它们的宿主之间相互关系的认识。 当我们身体的某个细胞发生基因突变,使得细胞增殖失控,
近期,《自然》杂志报道了一项由美国哥伦比亚大学医学中心的Michael Metzger及其合作者完成的研究,他们发现,在一种双壳贝类的海洋贝类中存在可传播的癌症,而且这种癌症可在不同物种间转移。这意味着,在海洋环境当中,癌细胞可以被视作一种普遍的传染源。这不但挑战了我们对癌症本质的理解,还刷新了我们对癌细胞和它们的宿主之间相互关系的认识。
当我们身体的某个细胞发生基因突变,使得细胞增殖失控,癌症就发生了。这个过程一旦启动,癌细胞就会经过一系列进化过程,获得新的性状,在体内扩散、转移。然而,正常情况下,癌细胞不会从一个患病动物个体“传染”给另外一个动物个体。迄今为止,科学家发现能够在动物不同个体之间传播的癌细胞是极其罕见的,已知的仅有四例,其中两例是靠袋獾的相互撕咬传播的,一例是因狗的交配行为而传播的,还有一例是在软壳蛤之间传播的。但在Michael Metzger和同事的研究中,他们又发现了另外四种具有“传染性”的癌症:其中一种存在于不列颠哥伦比亚省发现的贻贝(Mytilus trossulus)中,一种影响伊比利亚沿海的金蛤仔(Polititapes aureus),另外两种可能各自起源于鸟尾蛤(Cerastoderma edule)。
受这些癌症影响的动物个体会出现白血病样的症状,称为弥散性瘤样病变。患病动物个体的循环系统中会积累大量巨大的异常细胞,形成粘稠、不透明的体液,它们的组织内循环会被这些侵润性的癌细胞堵塞。自上个世纪60年代开始,人们就观察到存在于多种双壳贝类动物个体中的弥散性瘤样病变,但对其潜在的病因却一直未能解释清楚。
Michael Metzger和他的同事对贻贝、牡蛎和金蛤仔的自身正常细胞和同一个体的癌细胞进行了基因分析比对,发现在很多情况下二者并没有遗传基因相似性。而在同物种不同个体的癌细胞之间,其遗传基因特征反而高度相似。这就证实,双壳贝类的弥散性瘤样病变,是由于癌细胞在不同个体之间的横向传播所致。
另外,他们还发现了一个特别意外的现象:遗传基因分析表明,有些金蛤仔癌细胞的DNA与金蛤仔整个物种的正常细胞DNA都没有遗传基因相似性,其癌细胞源头真正是“非我族类”,而来自另一个不同的物种——小鸡蛤蜊(Venerupis corrugata)。令人惊讶的是,在这种与金蛤仔有着相同栖息地的小鸡蛤蜊当中,弥散性瘤样病变并不常见。由此推测,这种癌症可能最早在小鸡蛤蜊的个体中出现,但该物种最终适应并获得了抵抗这种癌细胞“感染”的能力,而在金蛤仔个体当中,这种癌细胞却找到了另一块供它们繁衍生息的地方(图1)。
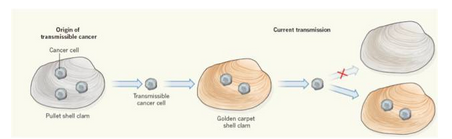
图1 癌细胞可在不同贝类物种之间传播。在金蛤仔中发生的可传播癌症起源于另一个物种—小鸡蛤蜊。虽然两种蛤类共用一个栖息地,但目前仅在金蛤仔中检测到癌细胞,表明小鸡蛤蜊获得了抵抗这种癌症“感染”的能力。
总之,以上的研究发现表明,在世界各地的贝类当中,可能存在很多能够在物种内和物种之间“传染”的癌细胞。虽然癌细胞这种在不同动物个体间传播的机制尚不清楚,但滤食性无脊椎动物静止的、互不接触的活动特性,暗示着这种癌细胞有可能借助海水的流动,到达并入侵另一个动物个体—宿主—的消化道或呼吸道而得以传播。倘若果真如此,那癌细胞一开始又是如何脱离最初的患病宿主的呢?这又是一个难解之谜。它们或许是通过患病个体的外伤或捕食行为而被动脱离,或者通过与宿主体内信号通路的相互作用而主动逃出。在它们自由生活的海洋环境中,对双壳贝类瘤样病变细胞和正常细胞密度大小和存活力强弱的研究,将会是一项十分有趣的科学探索。
虽然人们发现弥散性瘤样病变在很多双壳贝类动物中存在,但其发病率在种内和种间都存在很大差别。这种差异,尤其是局部区域种群内的发病率差异,向我们暗示着,生活在海底世界的这些“病原体”和“宿主”之间正进行着一场激烈的进化竞赛。目前,我们还不清楚宿主针对可传播癌症的免疫机制,而对这种机制的阐释将有助于我们了解物种间的癌症免疫和免疫逃逸机制的多样性。另外,我们也不知道在双壳贝类中出现新型瘤样病变会有多频繁。总之,明确可传播与不可传播癌细胞之间的遗传基因差异,将为我们理解这种癌细胞的传播机制提供宝贵信息。
研究双壳贝类动物当中存在的可传播癌症的进化史,明确其出现的时间跨度和地理区域,能帮我们更好地认识这类疾病。或许就像犬类当中的“传染性”癌症那样,它们是与宿主共同进化了几千年的古老细胞;不过,它们也可能是由于传染性病原体、环境变化、水产养殖或其他人类活动的刺激而产生,在进化过程中出现较晚。
在海洋生物中,癌细胞具有成为传染性病原体的潜质,那么,癌症能否在人类的不同个体之间传播呢?虽然有研究发现,在器官移植、妊娠期、实验性治疗和手术事故等情况下,癌细胞能够在人和人之间传播并存活,但这种情况非常罕见,而且这种传播也从来没有波及到第三个人。不过,最近的一项研究发现,寄生绦虫的瘤样细胞可在免疫系统严重缺陷的人类宿主之间扩散,支持了Michael Metzger及其合作者的发现:癌细胞能够侵入新的宿主物种。
事实上,多细胞生物的患癌风险是不可避免的。现在看来,癌症潜在的进化动力让癌细胞的传播不仅局限于个体,甚至能够跨越物种之间的界限。在双壳贝类当中发现的可传播癌症,为科学家提供了一套新的研究系统,能够用来探索癌细胞的传播和相应宿主的免疫应答机制。另外,对弥散性瘤样病变病因的研究也会使养殖业受益良多,有助于开发出有效的生物监测与疾病控制系统。海底世界中“传染性”癌症的发现,不但使我们对癌症的认识有了概念性的突破,同时也为我们的癌症研究指出了前进的方向。
原始出处
Murchison EP.Cancer: Transmissible tumours under the sea.Nature. 2016 Jun 30;
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
31
恐怖啊!!
43
#癌细胞#
28