指南更新:非小细胞肺癌MET临床检测中国专家共识
2022-12-08 肺癌青委会 肺癌青委会 发表于上海
非小细胞肺癌中MET异常,针对MET异常的3种主要类型(MET 14跳突、MET基因扩增和MET蛋白过表达)制定了本共识,以期指导临床MET检测的实践。
摘要
非小细胞肺癌(non-small cell lung cancer,NSCLC)中MET异常(MET alteration)包括MET基因第14号外显子跳跃突变(MET 14跳突)、MET基因扩增、MET基因点突变(主要是激酶区突变)、MET基因融合及MET蛋白过表达等。NSCLC患者中MET 14跳突的发生率为0.9%~4.0%,目前国内外已有针对MET 14跳突的靶向药物获批上市,晚期NSCLC患者应进行包含MET 14跳突的检测以筛选MET抑制剂靶向治疗获益人群;原发MET基因扩增在NSCLC患者中的发生率为1%~5%,继发MET基因扩增在表皮生长因子受体酪氨酸激酶抑制剂(TKI)耐药患者中发生率为5%~50%,在间变性淋巴瘤激酶TKI耐药患者中发生率约为13%;MET蛋白过表达在NSCLC患者的发生率为13.7%~63.7%。关于MET基因扩增和MET蛋白过表达的多项临床试验正在进行中,显示出其在MET抑制剂临床治疗中作为生物标志物具有重要指导价值。准确检测MET异常是实施MET抑制剂治疗的前提,因MET异常形式和检测方法多,临床检测中面临的问题和挑战多,故需进一步梳理和规范。本编写组结合临床实践经验、文献阅读并组织专家讨论,针对MET异常的3种主要类型(MET 14跳突、MET基因扩增和MET蛋白过表达)制定了本共识,以期指导临床MET检测的实践。
正文
肺癌是我国最常见的恶性肿瘤之一。根据WHO癌症研究机构发布的2020年全球最新癌症数据(https://gco.iarc.fr/),我国癌症新发病例中肺癌占比约为17.9%,肺癌的死亡占比约为23.8%,均高居首位。自2003年表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)吉非替尼获批以来,非小细胞肺癌(non-small cell lung cancer,NSCLC)靶向治疗在近20年有了长足的发展,极大地延长了患者的生存期。除了常见的驱动基因EGFR、KRAS和间变性淋巴瘤激酶(ALK)之外,其他的少见驱动基因如ROS1、RET、MET、HER2、BRAF也受到越来越多的关注。
2021年,MET抑制剂赛沃替尼(Savolitinib)在中国正式获批,用于携带MET基因第14号外显子跳跃突变(下文统称为MET 14跳突)的局部晚期或转移性NSCLC。多个MET抑制剂针对MET 14跳突晚期NSCLC患者的临床研究数据显示出良好的疗效。目前国内外肺癌主要诊疗指南,包括中国临床肿瘤学会、非小细胞肺癌分子病理检测临床实践指南(2021版)以及美国国家综合癌症网络(NCCN),均已将MET 14跳突列入了晚期NSCLC一级或二级推荐检测项目。MET基因扩增是EGFR-TKI靶向治疗重要的耐药机制之一,多个临床试验数据表明,MET基因扩增的晚期NSCLC患者可从MET抑制剂治疗中获益,因此在上述指南中也被推荐检测。MET蛋白过表达近来在多个临床试验中展现出重要的潜在应用价值,逐渐受到临床重视,并在中华医学会肺癌临床诊疗指南(2022版)中被推荐检测。因此,本共识主要对上述3种MET异常形式的临床意义、适用人群、检测方法及路径、尚存问题等进行了详尽阐述,并提出了相关建议和推荐方案;同时对检测报告的形式也进行了规范,以期指导临床进行规范的MET检测,获得准确的检测结果,使相关患者最大化获益。
一、MET基因及临床意义
MET基因也称为c-MET,为原癌基因,位于人类第7号染色体长臂7q21-31,DNA长度约为125 kb,包含21个外显子和20个内含子。MET基因编码的MET蛋白属于酪氨酸激酶受体,其天然配体肝细胞生长因子(hepatocyte growth factor,HGF)能够与MET的细胞外结构域结合,促使MET发生二聚化、酪氨酸磷酸化,激活众多下游信号通路,如PI3K-AKT、RAS-MAPK、STAT和Wnt/β-catenin等,从而发挥促进细胞增殖、细胞生长、细胞迁移、侵袭及血管生成等效应,这在正常组织发育和肿瘤进展中都发挥着重要作用。
MET异常包括MET 14跳突、MET基因扩增、MET基因点突变(主要是激酶区突变)、MET基因融合及MET蛋白过表达等(图1),均可能导致MET信号通路的异常激活,从而引起肿瘤的发生发展。其中,MET 14跳突通过阻碍蛋白降解持续激活下游信号;MET基因点突变、MET基因融合以及MET基因扩增则直接激活MET激酶或导致蛋白表达增加,进而持续激活下游信号;MET蛋白水平的过表达可使细胞膜表面MET受体增加,HGF敏感性增加,也可导致MET通路的异常活化。在NSCLC中,MET不同类型异常形式的发生率及其临床意义存在差异(图1),其中目前临床主要关注的是MET 14跳突、MET基因扩增和MET蛋白过表达,本共识主要围绕这3种异常类型进一步阐述。
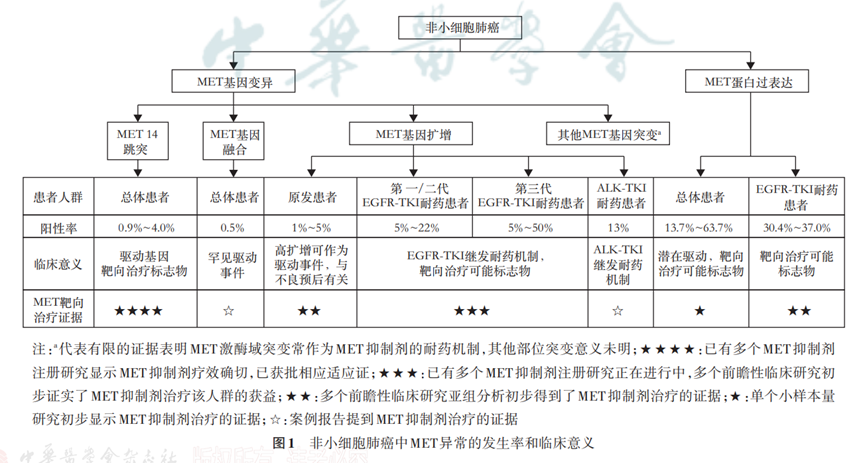
1.MET 14跳突:MET蛋白可通过Casitas B系淋巴瘤(CBL)E3泛素连接酶介导的泛素化降解进行负向调控。MET基因第14号外显子编码的近膜结构域中包含CBL结合位点(Y1003),是MET蛋白负向调控的重要区域。CBL与Y1003结合并介导MET蛋白泛素化,从而导致MET蛋白降解。MET 14跳突造成的MET蛋白近膜结构域缺失、Y1003位置氨基酸改变或缺失等变异形式均可导致MET蛋白泛素化障碍、MET稳定性增加和降解减少,从而引起下游信号的持续激活。目前已报道的MET 14跳突主要发生区域包括分支位点(branch site,单核苷酸)区域、多嘧啶区域(poly-pyrimidine tract,16个核苷酸)、剪接受体位点(splice acceptor site,上游2个核苷酸)以及剪接供体位点(splice donor site,下游2个核苷酸;图2)。当以上区域发生突变时,将导致mRNA异常剪接,表现为MET第14号外显子区域丢失,第13与15号外显子发生融合。MET 14跳突常见的突变位点分布区域较广,且突变形式多样,是临床检测和判读中面临的挑战(常见报道位点见官网电子版附录1)。文献报道,中国大陆NSCLC人群中MET 14跳突的比例为0.9%~2.0%,中国香港和中国台湾分别为2.6%和3.3%,略低于国外人群数据(2%~4%)。MET 14跳突通常发生在老年患者,在肺腺癌患者中的发生率(约3%)高于肺鳞癌患者(1%~2%),在肺肉瘤样癌患者中有更高的发生率(5%~32%)。研究数据显示,携带MET 14跳突的NSCLC患者有0.3%~10.0%同时携带EGFR突变,6.4%~28.5%同时携带EGFR基因扩增。未使用MET抑制剂时,MET 14跳突通常与高侵袭性、抗肿瘤治疗的耐药性和不良预后相关。多个注册临床研究数据显示,MET抑制剂在MET 14跳突晚期NSCLC患者中(入组患者包括腺癌、鳞癌及其他类型肿瘤)展示了良好的抗肿瘤活性以及安全性。特泊替尼(Tepotinib)和卡马替尼(Capmatinib)因在携带MET 14跳突的晚期NSCLC患者中具有良好的抗肿瘤活性和安全性,相继在日本和美国获批上市。国家药品监督管理局(NMPA)在2021年6月批准赛沃替尼上市,为国内首个用于治疗接受含铂化疗后疾病进展或无法耐受标准含铂化疗的MET 14跳突的局部晚期或转移性NSCLC成人患者的高选择性MET抑制剂。其他MET小分子抑制剂,如谷美替尼(Glumetinib)、伯瑞替尼(Bozitinib),治疗MET 14跳突NSCLC患者的相关临床试验仍在进行中。
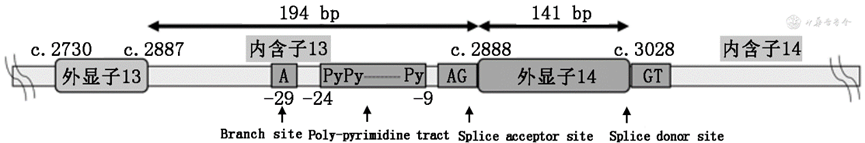
图2 MET第14号外显子跳跃突变主要分布区域
共识-1
MET 14跳突是晚期NSCLC的驱动基因突变之一,是筛选MET抑制剂靶向治疗获益人群的重要分子标志物。
2.MET基因扩增:MET基因扩增是指该基因拷贝数(gene copy number,GCN)增加,包括局部扩增(focal amplification)和多体(polysomy)2种形式。局部扩增是指MET基因(或合并周围区域)的拷贝数增加,而位于染色体其他区域的基因的拷贝数没有明显变化;多体是指整条染色体(或染色体较大区段)的拷贝数增加。2种形式都可能导致MET mRNA水平上调,进一步增加MET蛋白表达,从而增加激活状态的MET通路信号。MET基因扩增可作为原发性肿瘤驱动基因变异之一,多种实体肿瘤中都有发现,NSCLC中原发MET基因扩增发生比例为1%~5%。MET基因扩增与较高的组织学分级、较晚的临床分期以及不良预后相关。有限的临床研究数据(PROFILE 1001研究,GEOMETRY mono1研究,VISION研究)均提示MET抑制剂可能为原发MET基因扩增的晚期NSCLC患者带来获益(不同研究的原发MET基因扩增阈值有一定差异)。MET基因扩增更常继发于其他驱动基因阳性NSCLC患者靶向治疗后,是EGFR-TKI耐药的重要机制之一。继发MET基因扩增在EGFR信号通路被EGFR-TKI抑制时,作为旁路信号途径绕过EGFR激活下游通路导致耐药。不同代EGFR-TKI耐药后出现MET基因扩增比例不尽相同,根据文献数据,第一、二代EGFR-TKI耐药后MET基因扩增的比例为5%~22%,第三代EGFR-TKI奥希替尼一线耐药后MET基因扩增比例为7%~15%,二线耐药后为5%~50%。除EGFR-TKI外,MET基因扩增也是ALK-TKI耐药机制之一,第二、三代ALK-TKI耐药后MET基因扩增的比例约为13%。临床研究数据表明,EGFR-TKI联合MET抑制剂可能是继发MET基因扩增导致的EGFR-TKI耐药患者的潜在治疗策略。TATTON研究数据表明,EGFR-TKI耐药后MET局部扩增和多体的患者,奥希替尼联合赛沃替尼治疗均显示出一定的临床疗效,其中MET基因扩增总体人群(n=53)的客观缓解率达到30%,局部扩增人群(n=35)和多体人群(n=18)的客观缓解率分别为31%和28%。SAVANNAH研究结果表明奥希替尼耐药后MET高扩增(FISH GCN≥10)的患者奥希替尼联合赛沃替尼治疗显示出良好的临床疗效。另有报道显示,ALK-TKI耐药后发生MET基因扩增的患者应用MET抑制剂治疗也取得了一定的疗效,值得进一步探索和研究。
共识-2
MET基因扩增是NSCLC的原发驱动基因变异,也是EGFR-TKI和ALK-TKI耐药的重要机制之一,可作为晚期患者耐药后联合靶向治疗的潜在分子标志物,临床应重视MET基因扩增检测。
3.MET蛋白过表达:研究数据显示NSCLC中MET蛋白过表达的比例为13.7%~63.7%,EGFR-TKI经治的EGFR突变的晚期NSCLC患者中MET蛋白过表达的发生率为30.4%~37.0%。新近研究数据显示,MET抗体耦联药物(antibody drug conjugate)Teliso-v在EGFR野生型、MET蛋白过表达[≥50%的肿瘤细胞免疫组织化学(IHC)强阳性(3+)]的晚期经治NSCLC患者中展示出了有临床意义的肿瘤应答。基于该Ⅱ期研究,Teliso-v获得了FDA突破性疗法认证,相应的Ⅲ期临床研究(NCT04928846)正在进行中,提示MET蛋白过表达可作为晚期NSCLC靶向治疗的生物标志物。同时对于EGFR突变合并MET蛋白过表达的初治晚期NSCLC患者的Ⅲ期临床研究(SANOVO,CTR20211427)正在进行中。INSIGHT与TATTON等研究显示,EGFR-TKI耐药后MET IHC≥50%的肿瘤细胞3+的患者可能从EGFR-TKI联合MET抑制剂治疗中获益,而IHC≥50%的肿瘤细胞中等阳性(2+)亚组对联合靶向治疗反应不佳。SAVANNAH研究显示奥希替尼耐药后MET IHC≥90%的肿瘤细胞3+的患者可以从奥希替尼联合赛沃替尼治疗中获益,进一步确定了MET蛋白过表达作为生物标志物的重要价值。
另有研究对MET蛋白过表达与MET 14跳突或MET基因扩增的相关性做了探索,结果显示,MET蛋白表达水平与MET 14跳突相关性较低。NSCLC NCCN指南(2022年第3版)也明确指出,不推荐IHC作为MET 14跳突的筛选方法。在TATTON研究中,EGFR-TKI耐药后发生MET蛋白过表达(≥50%肿瘤细胞3+)的患者中有80%同时检测到MET基因扩增(MET GCN≥5或MET/CEP7≥2)。另一项纳入181例未经靶向治疗的肺腺癌患者的研究,显示MET蛋白过表达(IHC H评分≥200)患者中仅1%存在MET基因扩增。因此,MET蛋白过表达可能由多种原因造成,与MET基因扩增的相关性需要更多研究来进一步探索。现阶段检测抗体和阳性阈值数据较少,尚需进一步临床研究积累经验。
共识-3
MET蛋白过表达在NSCLC MET抑制剂的临床治疗中具有潜在指导价值,不同患者人群的获益阈值尚需进一步研究。
二、MET检测的适用人群
共识-4
晚期NSCLC患者强烈推荐进行MET 14跳突检测;晚期初治和EGFR-TKI耐药后NSCLC患者推荐进行MET基因扩增检测。
三、常见送检样本类型与处理
用于MET检测的样本类型主要包括肿瘤组织样本、细胞学样本以及液体样本等。MET 14跳突可用RNA进行检测,相关样本应注意及时固定以及样本保存条件,以防RNA降解。
1.肿瘤组织样本:优先使用肿瘤组织石蜡样本,包括手术和活检样本,检测前需对肿瘤细胞比例评估,确保满足检测要求,对于手术样本,优先选取肿瘤细胞比例较高的样本进行检测。
2.细胞学样本:包括胸腹腔积液、支气管刷检、支气管内超声引导细针穿刺活检样本、痰、肺泡灌洗液等。需作细胞评估后进行检测,或制作成石蜡包埋样本,评估满足检测要求后进行检测。
3.液体活检样本:对于不能获得组织或细胞学样本的晚期NSCLC患者,MET 14跳突可考虑血液检测。患者血浆中存在循环肿瘤DNA(circulating tumor DNA,ctDNA),可进行基因检测。部分发生脑膜转移的晚期NSCLC患者脑脊液对颅内肿瘤的ctDNA具有富集作用,也可考虑获取脑脊液进行相关检测。与组织样本相比,血液和脑脊液中ctDNA含量很低,与组织样本检测相比灵敏度较差。
四、常用MET检测方法
针对NSCLC中MET异常,常见的分子病理检测方法主要包括IHC、FISH、逆转录即时荧光定量PCR(RT-qPCR)、Sanger测序、二代测序技术等。不同的分子病理检测方法有各自的优缺点,也受MET变异类型、样本类型、样本质量、肿瘤含量、实验室条件等影响。
(一)MET 14跳突检测方法
MET 14跳突的检测方法包括Sanger测序、RT-qPCR、基于DNA或RNA水平的二代测序等,其中Sanger测序因其检测通量和灵敏度较低目前在临床中应用较少,本共识不做进一步介绍,目前临床常用方法见表1。

表1 非小细胞肺癌MET第14号外显子跳跃突变常见检测方法
1.RT-qPCR:以RNA为检测对象,在MET第13和第15号外显子区域设计引物,检测是否有特异性的扩增产物,该方法检测MET 14跳突准确率高,但对于一些与MET 14跳突功能相似的、特殊且罕见的MET变异形式,如Y1003位点氨基酸改变(约占总体阳性的2%)或缺失,会导致漏检。对于检测结果在阳性阈值附近的患者,其结果解释需谨慎,应结合样本质量、肿瘤细胞含量以及检测质控情况综合分析。必要时可使用其他平台进行复测。
2.DNA二代测序:优选肿瘤组织样本或细胞学样本进行检测,目前试剂盒主要基于2种建库方法,扩增子法和杂交捕获法,富集MET 14跳突相关区域片段以进行基因序列检测。考虑到导致MET 14跳突的变异位点和形式多样性,不同建库方法的检测能力也有一定差别,推荐建库的靶向序列至少应覆盖全部MET 13内含子、MET 14外显子以及MET 14外显子下游50 bp的范围(MET 14内含子内)。二代测序生物信息分析的数据库应尽可能包含全面的MET 14跳突位点信息,并定期更新。对于检测到的疑似MET 14跳突,在生物信息分析预测的基础上,建议辅以RT-qPCR或RNA测序验证。DNA二代测序平台在基于上述因素的充分优化后,也能达到较高的灵敏度与特异度。当肿瘤组织样本和细胞学样本不可及时,可考虑液体活检样本进行DNA二代测序检测。ctDNA在肿瘤患者体内含量较低,对检测方法灵敏度的要求较高,可能存在假阴性;ctDNA检测也同样会受到检测探针覆盖的影响。因此,在使用液体样本检测时,需充分考虑这些局限性,当出现阴性结果时,应注明假阴性的可能性。
3.RNA二代测序:是在RNA水平上检测MET第13/15号外显子融合来判断是否发生MET 14跳突。该方法直接检测MET 14跳突,检测覆盖范围明确,生物信息分析简单。尤其当患者发生影响剪接的非典型内含子突变时,该方法有助于识别MET 14 跳突。但与RT-qPCR一样,对于一些罕见的MET变异形式(如Y1003位点氨基酸改变或缺失)可能会出现漏检。RNA二代测序同样对样本质量要求高,检测全程需做好质控。
共识-5
MET 14跳突可使用RT-qPCR、DNA二代测序或RNA二代测序进行检测,不同检测方法各有其优缺点,必要时可相互验证或补充检测。MET 14跳突位点形式多样,临床检测和判读中需特别注意。
(二)MET基因扩增检测方法
MET基因扩增的检测方法目前主要包括FISH、二代测序等。目前MET基因扩增的判断标准和临床获益阈值均尚未明确,因此,本共识仅基于已发表文献数据以及临床研究中常用的检测方法和参考标准(表2)进行推荐,未来基于临床研究数据尚需进一步明确。
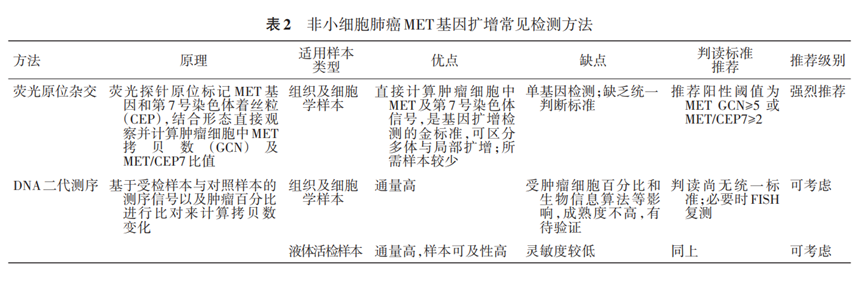
表2 非小细胞肺癌MET基因扩增常见检测方法
1.FISH:FISH技术通过荧光探针原位标记MET基因,可以结合形态直接观察肿瘤细胞中MET荧光信号的数量,来计算肿瘤细胞中MET基因GCN;或者通过标记MET基因和第7号染色体着丝粒(CEP7),计算肿瘤细胞中MET/CEP7比值。临床可以通过MET GCN以及MET/CEP7比值来判断扩增情况,该法可区分局部扩增和多体,目前是检测MET基因扩增的金标准。FISH检测MET基因扩增尚无统一的判读标准,目前主要参考UCCC(University of Colorado Cancer Center)标准和Cappuzzo标准。针对EGFR-TKI耐药后MET基因扩增相关的临床试验中,主要采用MET GCN≥5或MET/CEP7≥2作为入组标准,本共识推荐该入组标准作为判读参考阈值。当MET/CEP7≥2时,判断为局部扩增;当MET GCN≥5且MET/CEP7<2时,判断为多体。后续根据临床研究的结果,具有疗效预测价值的MET基因扩增阈值可能会有调整。
2.DNA二代测序:DNA二代测序方法可以基于测序深度和特定位点变异频率等信息对检测MET基因拷贝数变异进行计算,首选肿瘤组织样本或细胞学样本。不同公司或实验室使用的二代测序检测panel和生物信息分析策略可能有所不同,检测结果的呈现形式也可能不同。临床研究中目前多采用FISH方法入组MET基因扩增患者,已有报道组织二代测序(肿瘤细胞比例≥10%,测序深度≥500×)与FISH检测MET基因扩增的阳性一致性约为62.5%,TATTON研究中组织二代测序(肿瘤细胞比例≥20%,测序深度≥200×)与FISH检测MET基因扩增的阳性一致性为48%,进一步分析发现二代测序与FISH检测的MET局部扩增阳性一致性为88%,与FISH检测的MET多体阳性一致性仅为4%。二代测序检测MET基因扩增有待进一步优化和验证,因此建议临床选用经NMPA批准或经充分验证的二代测序产品对MET基因扩增进行检测。在EGFR-TKI耐药后进行检测时,由于穿刺活检获取组织样本存在挑战,血液样本也是重要的检测样本来源。TATTON研究中,与组织FISH检测相比,ctDNA二代测序检测MET基因扩增的阳性一致性为25%(局部扩增43%,多体10%)。因此,现阶段血液二代测序检测MET基因扩增仍存在挑战,需要进一步的优化验证,应优先采用组织样本进行检测。若受限于样本进行血液检测时,检测阴性不能排除MET基因扩增,必要时考虑二次活检FISH复测。
3.MET基因扩增新方案探索:微滴式数字PCR(droplet digital PCR,ddPCR)是对微滴体系进行扩增反应以后,分析每个微滴的荧光信号,将判断结果按照泊松分布的原理,通过读取靶标和内参核酸的阳性微滴个数以及比例从而得到靶分子的拷贝数及浓度,在MET基因扩增检测尤其血液检测领域已有相关探索。但该方法在临床应用前尚需进一步优化和验证。
共识-6
MET基因扩增可采用FISH和二代测序进行检测,FISH是检测MET基因扩增的金标准,二代测序检测MET基因扩增尚需进一步优化和验证。
(三)MET蛋白过表达检测方法
MET蛋白过表达检测方法为IHC,利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素等)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的方法。目前国内外检测MET的抗体已有多个获得国产医疗器械产品(备案),涉及多个克隆号,不同抗体的染色性能存在差异,尚没有统一的判读标准。
目前临床研究的判读标准结合了相关抗体在肿瘤细胞中的表达强度和百分比。TATTON和SAVANNAH研究中入组了MET IHC ≥50%肿瘤细胞强染色(3+)的患者,所用抗体克隆号为SP44;INSIGHT研究入组了≥50%肿瘤细胞强染色(3+)或中等染色(2+)的患者,所用抗体克隆号为D1C1;NCT01610336研究也入组了≥50%肿瘤细胞强染色(3+)或中等染色(2+)的患者,所用抗体克隆号为3077。鉴于当前抗体的多样性以及判读标准尚未统一,进行不同抗体的一致性对比研究十分必要,并需要更多的临床研究来证实MET蛋白过表达的临床价值,进一步明确判读标准和获益阈值。现阶段临床研究中,建议IHC检测结果应至少包括所使用的抗体信息、肿瘤细胞中阳性百分比和染色强度。
五、MET检测路径
检测医师应根据需要检测的MET异常形式,结合送检样本类型、所检基因数量及类型、检测成本、检测实验室能力条件以及试剂获证情况等综合评估,合理选择检测方法,必要时考虑进行多平台相互验证。本共识基于现阶段证据及临床实践,专家组推荐NSCLC MET检测路径如图3所示。未来根据相关证据公布,检测路径可能做进一步更新。
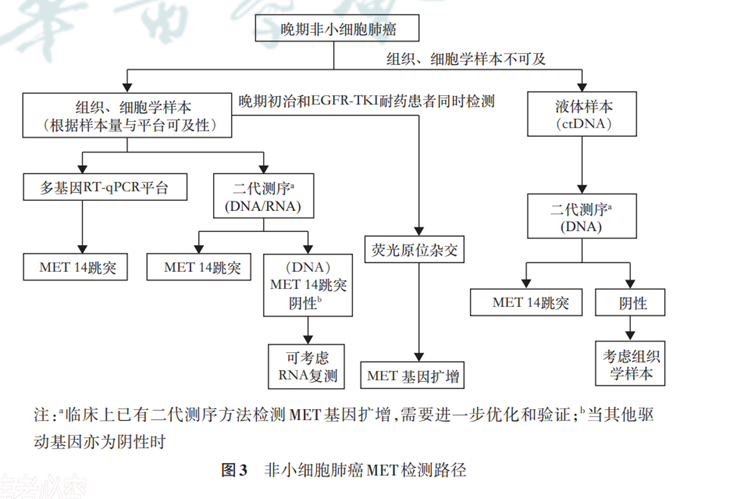
对于肿瘤组织/细胞学样本可取的患者,根据实验室平台可及性,优先推荐进行包含EGFR、KRAS、ALK、ROS1、RET及MET等基因在内的多基因联检,以便最大化利用样本获得较全面的基因信息。当组织/细胞学样本充足时,推荐二代测序平台或多基因RT-qPCR平台;当组织/细胞学样本不足时,可根据临床需求与临床病理特征首选相关单基因检测。DNA二代测序平台检测结果为驱动基因全阴或疑似MET 14跳突阳性时,可考虑进行基于RNA水平的RT-qPCR或二代测序复测MET 14跳突及其他融合基因。当组织样本/细胞学样本不可获得时,考虑使用液体样本进行二代测序检测MET 14跳突,当出现阴性结果时,应注明假阴性的可能性,必要时建议重取肿瘤组织样本进行复测。
晚期NSCLC患者,尤其是EGFR-TKI耐药患者,推荐FISH检测MET基因扩增。临床已有二代测序检测MET基因扩增,但仍需进一步的优化和验证。此外,鉴于MET蛋白过表达在NSCLC MET抑制剂的临床治疗中具有潜在指导价值,当肿瘤组织较充足时,可考虑IHC检测MET蛋白过表达。
共识-7
晚期NSCLC MET检测首选肿瘤组织/细胞学样本,采用包括MET的多基因联检平台(RT-qPCR或二代测序)检测MET 14跳突,DNA二代测序检测结果阴性时,可考虑采用RNA样本补充检测;晚期NSCLC患者尤其是EGFR-TKI耐药后患者推荐FISH检测MET基因扩增。当组织/细胞学样本不可及时,可选择液体活检样本进行MET 14跳突的检测(表3)。

表3 中国非小细胞肺癌(NSCLC)MET检测专家共识要点
六、MET检测报告规范和其他注意事项
(一)报告规范
检测报告应包括患者基本信息、样本病理信息、检测方法、检测试剂及检测系统、质量控制信息、检测结果、变异解读、临床注释及必要的备注等核心信息。在报告的备注部分,建议包括检测方法局限性、检测中的特殊情况及进一步工作等信息。本共识仅针对MET检测相关内容作规范建议。
1.MET 14跳突报告规范:DNA二代测序报告中应包括明确的变异名称描述(MET 14跳突)、突变位点信息、突变位点占比(variant allele frequency)以及参考转录本信息(MET基因常用转录本有NM_000245和NM_001127500,两者序列编号有区别需特别注意)等。报告中应明确指出变异是否造成MET 14跳突,对于检测结果无法明确为MET 14跳突的,应在变异解读中予以说明。检测方法部分建议体现MET外显子和内含子覆盖范围,以便医师充分评估检测能力。RNA检测(RT-qPCR和RNA二代测序)报告中应明确突变名称为MET 14跳突。
2.MET基因扩增报告规范:在FISH检测报告中建议至少包括评估的肿瘤细胞数量、平均MET拷贝数/细胞、平均CEP7拷贝数/细胞、平均MET拷贝数与平均CEP7拷贝数的比值以及发生扩增的肿瘤细胞比例等。根据判断标准确定MET基因扩增状态,阳性时应区分局部扩增和多体。在二代测序检测报告中应包括明确的变异信息描述、基因拷贝数信息,以及检测平台本身对MET基因拷贝数变异的阳性判定阈值。对于使用液体样本进行MET基因扩增检测的二代测序报告,除上述信息外,考虑到液体检测目前灵敏度较低,报告应注明假阴性率较高等相关信息。
(二)其他注意事项
1.做好室内质控和室间质评。进行MET检测的实验室,应在临床检测前建立并优化规范的检测流程,进行性能验证。检测时应当设置阳性与阴性对照。所有操作应由经专业培训的人员操作,并有指定人员负责质量监控,定期组织培训及数据对比分析。同时,检测实验室应定期参加室间质控,以确保实验操作的准确性以及检测结果的有效性。
2.加强临床病理有效沟通。MET异常较其他基因变异更加复杂:MET 14跳突复杂多样的变异位点和形式;MET基因扩增、过表达标准尚未统一,阈值尚不明确。这些都对临床解读MET检测结果提出了挑战。建议建立临床病理沟通机制,确保临床病理及时进行沟通。
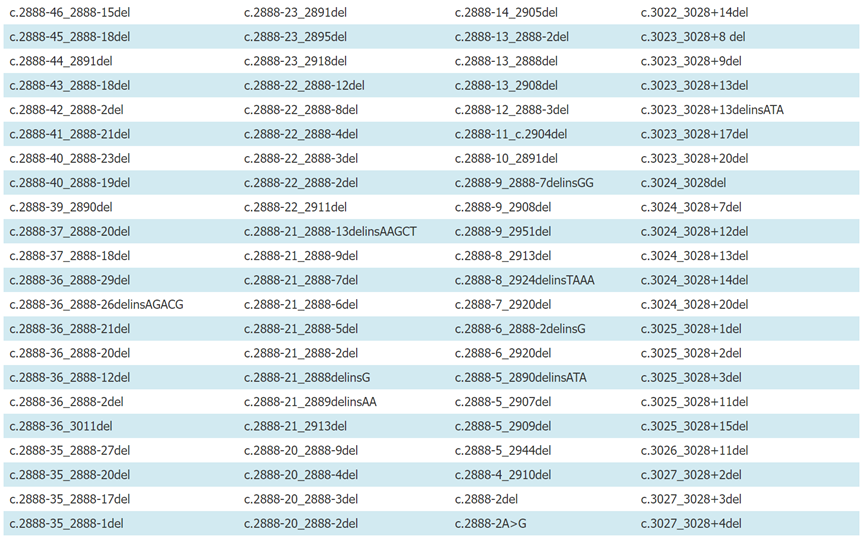
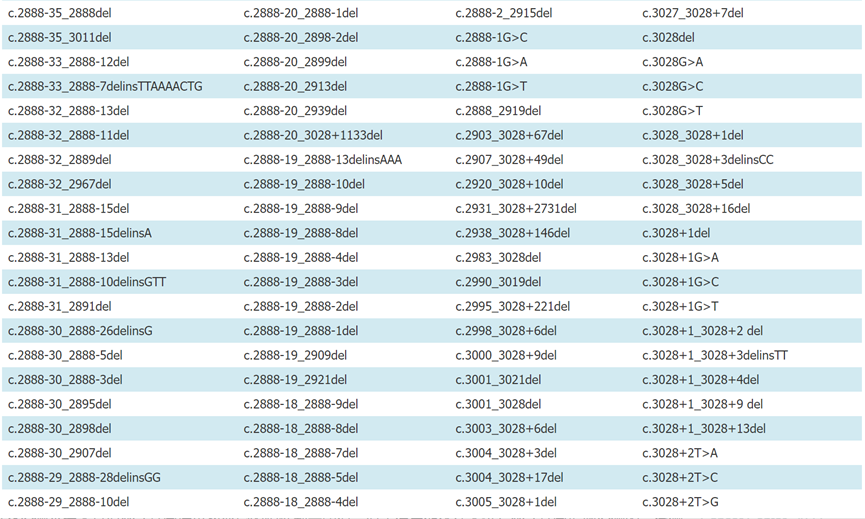
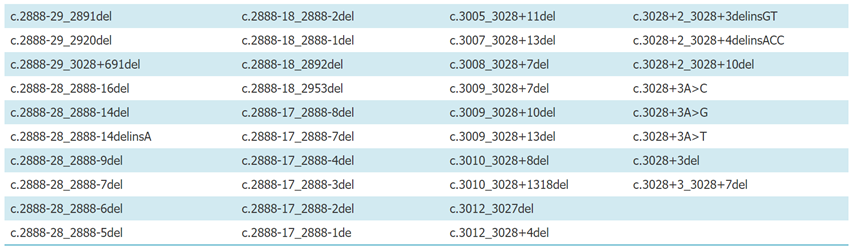
附录1:已报道的常见MET 14跳突位点(参考转录本NM_000245)
免责声明 本文中公布的临床实践专家共识内容由专家组成员依据现有医学证据及实践经验共同讨论形成,以帮助相关人员进行非小细胞肺癌MET检测或临床决策。其中的内容可能不够全面或不够充分。医学知识发展迅速,在本共识产生到发表期间可能出现新的证据,而这些可能并没有体现在本共识中。另外,因检测方法较多、检测流程复杂、实验室条件差异以及患者之间存在个体差异等影响检测决策或结果,因此,本共识中内容的采用应结合检测条件、政策许可以及专业人员的独立专业判断。对本共识内容的使用是自愿的。专家组成员明确否认对文中所提及的任何产品具有商业性目的。专家组对因使用本共识内容而造成的或与之相关的任何人身伤害或财产损失,或任何错误或遗漏不承担任何责任。
非小细胞肺癌MET临床检测中国专家共识专家组成员
(按单位名称汉语拼音字母顺序排列)
北京大学肿瘤医院病理科(林冬梅),胸部肿瘤内科(赵军);重庆大学附属肿瘤医院肿瘤内科(李咏生);复旦大学附属肿瘤医院病理科(柏乾明、周晓燕),胸部肿瘤内科(王佳蕾);福建省肿瘤医院病理科(陈刚),肿瘤内科(黄诚);广东省人民医院病理科(张庆玲),广东省人民医院 广东省肺癌研究所肿瘤内科(吴一龙);哈尔滨医科大学附属肿瘤医院病理科(孟宏学);海南省肿瘤医院病理科(邵建永);华南肿瘤学国家重点实验室 肿瘤医学协同创新中心 中山大学肿瘤防治中心(张力);华中科技大学同济医学院附属协和医院肿瘤中心(董晓荣);吉林省肿瘤医院肿瘤内科(程颖);解放军东部战区总医院呼吸内科(宋勇);空军军医大学西京医院病理科(胡沛臻);南方医科大学南方医院病理科(梁莉);南京医科大学第一附属医院病理科(张智弘);山东省肿瘤防治研究院肿瘤内科(王哲海);山西省肿瘤医院呼吸内科(宋霞);上海交通大学附属上海市胸科医院病理科(韩昱晨),肿瘤科(陆舜);上海市肺科医院病理科(武春燕);四川大学华西医院病理科(唐源);苏州大学附属第一医院病理科(郭凌川);西安交通大学第一附属医院肿瘤内科(姚煜);浙江大学医学院附属第一医院呼吸内科(周建英);郑州大学附属肿瘤医院 河南省肿瘤医院病理科(马杰),内科(马智勇);中国科学技术大学附属第一医院临床病理中心(叶庆);中国科学院大学附属肿瘤医院(浙江省肿瘤医院)病理科(苏丹),胸部肿瘤内科(范云);中国医学科学院 北京协和医学院 北京协和医院病理科(梁智勇、师晓华);中国医学科学院 北京协和医学院 肿瘤医院病理科(应建明),肿瘤内科(王洁);中南大学湘雅医院呼吸与危重症医学科(胡成平)
作者:中华医学会病理学分会,国家病理质控中心,中华医学会肿瘤学分会肺癌学组,中国抗癌协会肺癌专业委员会,中国胸部肿瘤研究协作组
执笔人:
柏乾明(复旦大学附属肿瘤医院病理科,上海 200032);
师晓华(中国医学科学院 北京协和医学院 北京协和医院病理科,北京 100730)
通信作者:
周晓燕(复旦大学附属肿瘤医院病理科,上海 200032),Email:xyzhou100@ 163. com;
梁智勇(中国医学科学院 北京协和医学院 北京协和医院病理科,北京 100730),Email:liangzhiyong1220@yahoo.com;
陆舜(上海交通大学附属胸科医院肿瘤科,上海 200030),Email:shunlu@sjtu.edu.cn;
吴一龙(广东省人民医院 广东省肺癌研究所,广州 510080),Email:syylwu@live.cn
来源:中华病理学杂志, 2022,51(11): 1094-1103.
DOI: 10.3760/cma.j.cn112151-20220606-00491
(本共识获授权转载自微信公众号“中华病理学杂志” 2022-12-05)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言