肝衰竭是由多种原因引起的严重肝脏损伤,其病死率极高。肝移植术是目前唯一有效的治疗方法。但供肝短缺、等待时间长、移植费用昂贵,故能够进行肝移植治疗的患者数量非常有限。人工肝支持系统简称人工肝,包括生物型和非生物型。非生物型人工肝可以短期改善肝衰竭患者的肝脏代谢功能,但不能实现肝功能恢复,对患者的整体生存率无显著性提高。自1987年肝细胞型人工肝治疗暴发性肝衰竭成功以来,生物型人工肝被认为是具有较好治疗效果和应用前景的新型治疗手段。其不仅能够帮助肝衰竭患者清除体内毒素,还具有合成及转化功能,从而达到缓解肝衰竭、恢复肝功能的作用。目前研究较多的生物型人工肝主要包括美国的ELAD、德国的MELS以及荷兰的AMC-BAL。国内大部分处于临床前研究阶段,截至目前,上海微知卓、苏州瑞徕、广东乾晖先后获得国家药品监督管理局药品审评中心临床批件,临床试验启动在即。
生物型人工肝通常由种子细胞、生物反应器和辅助装置组成。生物反应器是储存细胞、实现物质交换的重要场所,多以中空纤维反应器、微载体或纤维支架反应器为主。辅助装置主要为人工肝提供动力、保温等作用。种子细胞是生物型人工肝发挥作用的核心要素,其应具备在体外代偿肝脏的合成与解毒、生物转化、分泌等功能,并且可持续、规模化制备,达到一定的细胞数量。因此,开发合适的种子细胞,解决细胞数量、提高肝功能成为推动生物型人工肝发展的关键。本文就种子细胞的研究进展综述如下。
1 种子细胞来源
目前,生物型人工肝种子细胞主要来源于猪肝细胞、人原代肝细胞、肝前体细胞、永生化肝细胞、肿瘤来源细胞、干细胞或胎肝细胞以及重编程的肝样细胞等(图1)。
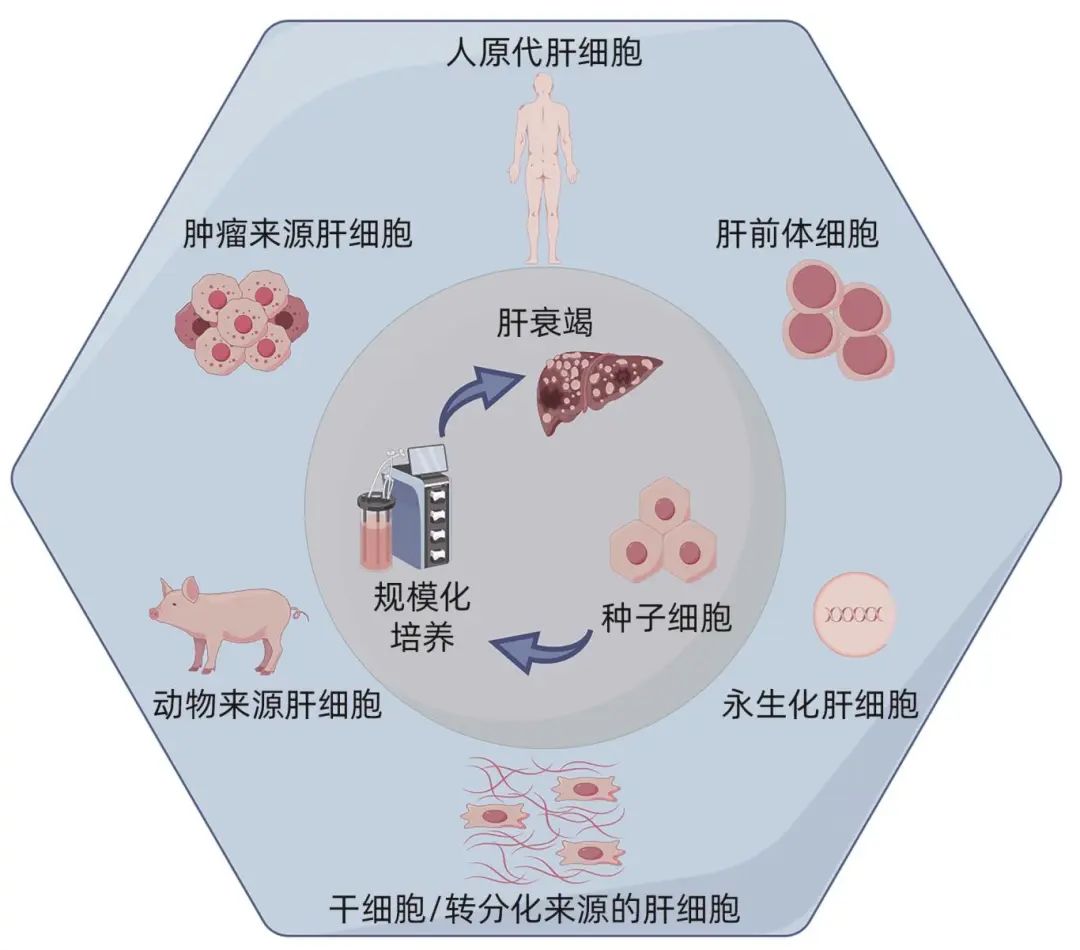
图1 生物型人工肝种子细胞来源
1.1 人原代肝细胞
人原代肝细胞理论上是最好的种子细胞,不存在跨种属问题,也无致瘤和感染风险。邓宏魁团队利用5C化学小分子调控信号通路,解决了原代肝细胞体外功能稳定的难题。日本研究团队利用“YAPC”小分子组合发现原代肝细胞CYP450酶活性可在体外维持达40天。此外,肝细胞与非实质肝细胞的共培养对于保持原代人肝细胞的功能非常重要。其中共培养中常用的非实质肝细胞包括人脐静脉内皮细胞、血窦内皮细胞以及骨髓来源的间充质干细胞(MSC)等。然而,人原代肝细胞的体外增殖能力较差,导致其不能满足生物型人工肝对种子细胞数量和功能的要求。
1.2 人肝前体细胞
当肝脏持续暴露于慢性损伤时,肝细胞自我更新功能严重受损,可去分化为肝前体细胞以逃避损伤,并在损伤病因去除后成为再生修复的重要细胞来源。笔者团队利用小分子重编程技术模拟体内肝再生微环境,将人原代肝细胞在特殊培养体系下,去分化为可体外增殖的肝前体样细胞(HepLPC),并可在特定条件下重新分化为成熟肝细胞,成功在体外模拟了肝细胞再生过程。惠利健团队通过筛选条件培养液将人原代肝细胞在低氧环境下去分化为一种介于肝细胞和肝前体细胞的状态,实现了其体外扩增10 000倍的能力。胡惠丽团队通过类器官技术实现人胚胎肝细胞体外培养及功能维持。虽然研究人员在人原代肝细胞体外扩增与功能维持方面取得了一定的进展,但依然受供肝的质量及数量限制,是否可作为生物型人工肝的种子细胞仍需要更深入的技术研究。
1.3 永生化肝细胞
外源永生化基因插入原代肝细胞可以使肝细胞获得长期增殖能力。早期有研究者将SV40LT联合端粒逆转录酶转染肝细胞,建立了IHH永生化肝细胞。高毅团队利用慢病毒载体对原代肝细胞稳定转染了人端粒酶逆转录酶基因(H-TERT)和抑制Caspase-3表达的siRNA,建立了与原代肝细胞类似形态和生物学功能的HepGL。笔者团队在肝细胞来源的HepLPC中过表达E6E7基因,建立了具有良好合成、分泌、代谢功能的永生化肝前体样细胞(iHepLPC),结合“液-气”交互式反应器构建Aliver生物型人工肝支持系统,将肝衰竭模型猪的生存率提高至83.3%,未来应用前景较好。但如何维持永生化细胞基因组的稳定性,保证临床应用的安全性,是永生化细胞面临的主要问题。
1.4 干细胞/转分化来源的肝细胞
不同类型分化细胞之间的转化不会在自然条件下自发发生,随着细胞生物学和再生医学的发展,目前可以利用技术手段在体外改变细胞分化的进程,从而实现细胞类型的转化,这种方法称为“重编程”。“重编程”技术的发展为肝细胞来源提供了新的研究思路。以干细胞为基础的人胚胎干细胞、诱导性多能干细胞、多潜能间充质干细胞均能够诱导分化为肝样细胞。这些细胞具有多向分化潜能、来源稳定、无伦理问题、功能接近于原代肝细胞,在细胞治疗领域具有巨大的研究价值和应用前景。但目前诱导为肝样细胞技术尚不成熟,其分化效率差、诱导周期长、工艺复杂、成本高,且存在致瘤的风险,安全性在研究过程中备受关注。
惠利健团队通过插入转录因子,在特殊培养体系下,将新生儿皮肤成纤维细胞直接转分化为人源性肝样细胞hiHep,应用于生物型人工肝系统,成功救治了肝衰竭模型猪。谢欣团队在小鼠成纤维细胞体外插入1个转录因子,联合特定培养体系即实现了定向肝样细胞转分化。该转分化条件更为简便,移植后的肝样细胞可以挽救肝衰竭小鼠的生命。但转分化来源的肝样细胞同样存在残留宿主细胞安全性风险、转分化效率不确定、缺少统一标准等问题,仍需进一步研究。
1.5 肿瘤来源肝细胞
肿瘤细胞来源广泛、易获得,体外扩增能力强,从数量上可以满足人工肝的需求。HepG2、C3A是最常用于生物型人工肝研究的肿瘤细胞。美国ELAD系统自20世纪90年代开始研制生物型人工肝,将C3A培养于中空纤维反应器内,早期临床中取得了较好的效果。但2015年8月由于Ⅲ期临床试验未达到评价终点而宣布失败。C3A虽然具有一定的分泌、合成功能,并接近正常肝细胞,但代谢解毒功能差是其最大缺点,也可能是ELAD临床试验失败的原因之一。HepaRG细胞来源于人肝祖细胞系,因为其保留了肝细胞代谢酶、药物转运蛋白、核受体相关基因,在有或无DMSO的条件下均可分化为成熟肝细胞。但是,HepaRG体外扩增能力差,分化条件复杂,尚无法获得大批量细胞用于临床前研究。另外,肿瘤来源的肝细胞具有较大的安全风险,在临床应用中若发生细胞泄露,将有致癌的风险。
1.6 动物源猪肝脏细胞
猪肝细胞由于易获得、高功能活性,是最常用于人工肝研究的种子细胞。美国Mayo Clinic 医学中心将新鲜的猪肝细胞分离后,制备成悬浮肝细胞球,用于救治猪肝衰竭模型。四川大学华西医院实验室利用猪肝细胞与内皮细胞混合成球培养,用于猴肝衰竭模型治疗。BLSS系统是将猪原代细胞与胶原蛋白混合接种于中空纤维反应器内构建的人工肝系统。将患者血浆先经过氧合器和加热器,再与猪肝细胞进行物质交换后回输到患者体内,实现治疗的目的。HepatAssist 2000系统是目前临床研究最多的人工肝系统。通过体外循环装置将患者的血液经过置换,再将有毒的血浆通过含有猪肝细胞的中空纤维管,进一步清除有毒物质,同时猪肝细胞分泌合成的细胞因子、蛋白等回到患者体内,实现代偿肝功能的作用。早在1999年已开展了基于HepatAssist 2000系统的Ⅰ期多中心临床研究,研究者对39例急性肝衰竭患者进行了治疗,其中35例患者生存期超过30天,6例患者在不需要移植物的情况下恢复正常。然而随后的4年随机对照试验显示,该系统可显著降低血清总胆红素的含量,但生存率与对照组无显著性差异(71% vs 62%)。目前该系统仍处于Ⅲ期临床试验阶段,暂时没有数据表明患者感染异种病毒。然而,猪源肝细胞存在跨物种的免疫反应、潜在的猪内源性逆转录病毒(PERV)感染的风险,欧洲部分国家已禁止使用原代猪肝细胞用于生物型人工肝,美国食品药品监督管理局也未予以批准,其应用前景受到限制。
2 种子细胞培养方式
通常认为生物型人工肝需要装载至少等同于1/10成年人肝脏大小的细胞数量才能发挥其体外代偿肝功能的作用。肝细胞贴壁生长依赖于培养面积,传统的2D培养模式很难实现肝细胞规模化制备。目前,生物型人工肝种子细胞扩增多采用生物反应器,通过构筑3D培养环境,模拟肝细胞在体内生长的微环境,实现肝细胞高密度培养的同时,增强肝细胞合成及代谢功能。3D肝细胞培养方式主要分为2种,即支架结构培养和悬浮培养。
2.1 支架结构培养
3D 支架结构生物反应器能够为肝细胞提供接近三维静态生长环境,可有效降低细胞所受剪切力,减少细胞机械损伤,代表性反应器为中空纤维结构。中空纤维生物反应器通过将成束的中空纤维进行封装,细胞可贴附在纤维管内、纤维管外等不同空间生长。高毅团队利用中空纤维生物反应器将MSC扩增至临床应用数量级,并成功应用于肝衰竭大动物模型的救治实验,实现有效抑制全身炎症反应,将7天生存率从17%提升到87.5%。作为首个干细胞型生物人工肝药械组合产品,“血液净化用MSC”正式获得国家药品监督管理局临床试验批件,未来有望为肝衰竭患者提供新的治疗手段。中空纤维生物反应器用于细胞体外培养的概念最早于1972年被提出,但同时存在氧合能力较差的缺陷,即使配合目前较完备的氧合装置与持续培养基灌注系统,也仅适合特定的细胞类型,如适应低氧环境、对液体剪切力不敏感的MSC。
2.2 载体悬浮培养
肝细胞载体悬浮培养,是将肝细胞自聚集或者贴附载体形成肝细胞团,通过不同方式悬浮分布于生物器内。悬浮培养能充分利用生物反应器内空间,增加肝细胞生长表面积、提高物质交换效率,从而达到规模化培养的目的。肝细胞球技术是利用非黏附板培养细胞,促进肝细胞聚集成多细胞小球。南京大学鼓楼医院将一定数量的肝细胞球置于自主开发的多层板生物反应器,克服了细胞球沉降聚集,在肝衰竭猪模型实验中取得了显著疗效。Lu等利用人成纤维细胞直接重编程得到肝细胞样细胞和人肝非实质细胞,并制作肝细胞球类器官结构,由于肝细胞球本身具有模拟肝脏生理微环境、促进肝功能表达等优点,在生物型人工肝等方面受到越来越多的关注与研究。
采用水凝胶包被的方式将肝细胞制成微囊包裹,是悬浮高密度培养肝细胞的重要方法。笔者团队利用可生物降解的海藻酸盐包裹iHepLPC与内皮细胞形成共培养3D结构,实现异种肝样细胞动物体内存活和肝功能维持的作用,有效治疗化学诱导剂引起的小鼠急性肝损伤模型。但肝细胞球体积不易控制、中央区域营养物质传输受限、中心细胞容易坏死,影响肝细胞球发挥作用的效率。为了解决上述缺点,笔者团队以网织纤维载体结合“液-气交互式”动力装置构建新型生物反应器,为iHepLPC提供3D结构培养的固定场所,实现了血浆与细胞之间的高效物质交换,使得生物型人工肝性能大幅提升,并成功在大动物模型中验证了有效性。由此可见,下一步应当通过优化生物反应器的结构设计,以适配不同细胞的生物学特性,从而达到增强肝细胞活性,提高生物型人工肝疗效的目的。
3 生物反应器培养系统
生物反应器培养系统是指以生物反应器为核心,通过载体悬浮或者支架贴壁的方式在生物反应器内构建3D培养环境,采用工程技术手段对生物反应器内的环境参数实时在线测控,并辅以循环或连续灌注的手段,加强营养传输和物质交换,从而构建适合肝细胞生长、增殖的培养条件。肝细胞作为生物型人工肝的活性成分,按药品的质量要求进行生产,而培养过程的动态监测与控制是细胞治疗行业发展的监管趋势。只有构建多参数(pH值、溶解氧浓度、温度以及关键生化指标如葡萄糖、乳酸和铵离子等)实时在线检测、协同控制的生物反应器系统,才能保证培养过程可控,获得可靠的预期结果。以最早实现实时在线监测和反馈控制的pH值和溶解氧浓度为例,电化学传感器仍然是理想的选择。得益于早期电化学传感器的发展及其在生物发酵工业中的应用,电化学传感器可直接安装在生物反应器内实现原位监测,具有数据即时、检测可靠稳定、精度高、响应时间短等优点。在连续监测葡萄糖的乳酸浓度方面,Renneberg等首次通过接入测量葡萄糖和乳酸浓度的酶传感器,建立动物细胞培养过程中葡萄糖和乳酸实时在线测量装置。搭载不同的电化学和酶传感器可实现细胞外环境参数实时在线监测和反馈控制,笔者开发的贴壁细胞工业化大规模、自动化生产设备,实现了研发至下游应用的全流程、封闭式、自动化、模块化、可扩展的智能制造系统。细胞生产的智能制造和智慧工厂,为生物型人工肝的产业转化和行业发展提供了硬件基础。
4 小结
综上所述,生物型人工肝作为新技术具有广泛而确切的应用前景。在日益完善的集成化、智慧型制造系统支持下,生物型人工肝种子细胞体外大规模扩增技术也日渐成熟。然而,如何获取理想的种子细胞并维持其肝功能的稳定、可靠、持续,满足在临床长时间使用过程中的活性与效力不丢失,仍是研究者们亟需解决的难题。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240205

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#生物型人工肝# #种子细胞#
20