【衡道丨笔记】甲状腺穿刺细胞病理学检查及分子检测实践分享
2023-09-01 衡道病理 衡道病理 发表于上海
李晓静老师为大家带来了甲状腺穿刺细胞病理学检查及分子检测实践分享的相关内容。摘要如下:
内容摘要
甲状腺癌流行病学
-
2000-2016年甲状腺癌发病率增长迅速(女性APC 17.7%,在所有癌症类型中增幅最大)。
-
甲状腺癌发病率的高速增长,很大程度上与高分辨率超声的大量应用有关。
-
死亡率相对稳定,并处于较低水平。但在女性中呈现上升趋势(APC 1.6%)。
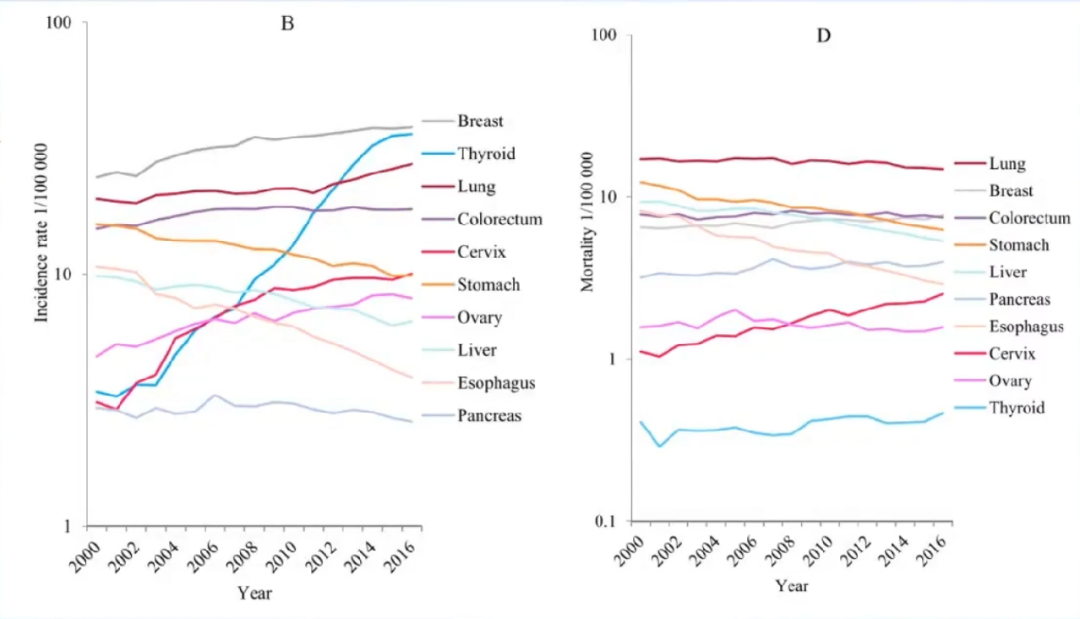
2016年发病率:女性15.81(男5.11,总10.37)死亡率:女性0.45(男0.29,总0.37)
-
我国甲状腺癌患者5年生存率与美国仍有差距(84.3%:98%)。
-
临床工作重点:正确甄别甲状腺癌,为甲状腺疾病的个体化精准治疗提供依据;规范化治疗;平衡好治疗的风险和获益;术后全程管理。
超声引导下甲状腺FNA细胞学(UG-FNA)
术前评估甲状腺结节良恶性时,超声引导下FNA是敏感性和特异性最高的方法,列入《2021版CSCO分化型甲状腺癌诊疗指南》Ⅰ级推荐。
应用范围:首诊可疑恶性的甲状腺结节;考虑复发、转移性甲状腺癌的术前明确诊断。
诊断价值:评估甲状腺结节的性质,提高甲状腺手术恶性肿瘤比例,避免不必要的手术。
-
约有10-30%的FNA显示不确定诊断(Ⅲ、Ⅳ),其中70-80%术后证实为良性病变。
-
由于近年国际国内相关实践指南推荐有恶性征象者行FNA,良性者可不行FNA,细胞学良性诊断比例下降,不确定诊断比例上升。
-
分子检测可降低甲状腺结节诊断不确定性。
-
检测结果阴性的甲状腺结节仍需积极监测(检测方法的局限及假阴性)
BRAF V600E突变与PTC
甲状腺癌中乳头状癌(PTC)最多见(超过90%),BRAF V600E在PTC中突变率欧美30-60%,亚洲70-90%。2022年北京协和医院发表一项多中心研究,395名PTC患者,310例存在BRAF突变(78.5%),均为BRAF V600E。与TCGA数据库的突变率存在显著差异。
-
BRAF V600E不存在于甲状腺良性及低分险肿瘤。因此FNA细胞样本伴BRAF V600E突变可以高度怀疑恶性结节(阳性预测值达99.8%);
-
BRAF V600E提高FNA诊断效能;
-
BRAF基因检测联合细胞学检查,能显著提高术前诊断的敏感性、NPV和准确性。
-
BRAF V600E检测方法及样本获取:

我院开展甲状腺UG-FNA+BRAF情况
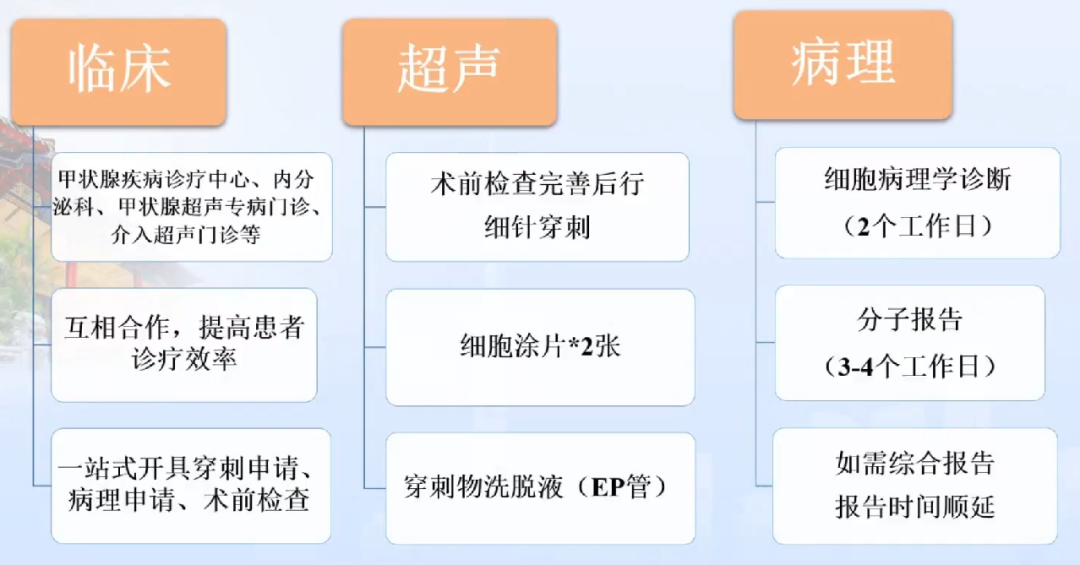
制片:拨散法,注射针针体将载玻片上的穿刺物轻柔拨散开,尽可能保持涂片厚度均匀,立刻放入95%酒精固定;
染色:HE染色;
穿刺物洗脱液:打出针腔内标本后,针腔壁上仍有穿刺物残留的细胞液成分。涂片后针均在盛有约300μL PK Solution的EP管中涮洗;
DNA提取:细胞室每天3次将洗脱液送至分子室,保存在4℃,不超过48h;
报告模式:细胞学报告与分子报告保持相对独立
1.可明确分类病变,先出具细胞病理学报告(2个工作日)。报告内容包括:病变描述、TBS诊断分类,必要的注释,备注各级TBSRTC恶性风险度;
2.部分Ⅰ、Ⅳ级病变(有一定的细胞异型基础),综合BRAF结果出诊断结论。
病例分享
病例一
-
男,60岁;
-
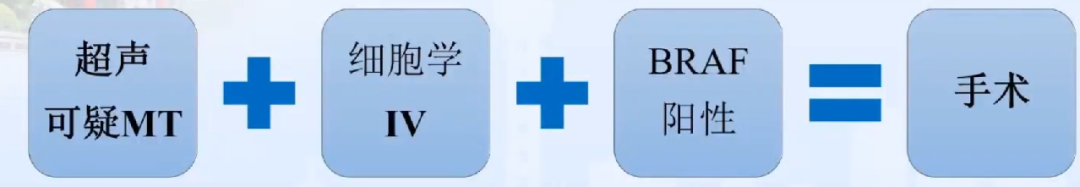
超声:甲状腺左叶下极见7*6mm低回声不均质团块,形态欠规则,边界欠清,其内见点状强回声,MT可能。
-
细胞学诊断:(甲状腺左叶结节)涂片见少量非典型腺上皮细胞,倾向意义不明确的非典型病变(AUS)。(TBSRTCⅢ)
-
BRAF V600E:存在点突变
-
临床:

-
组织病理学:(甲状腺左叶+峡部)乳头状癌
病例二:
-
男,67岁;
-
超声检查:甲状腺右叶中部背侧见5*4mm低回声团块,纵横比>1,向包膜外突出,其内见点状强回声,MT不除外(TI-RADS 4a)
-
细胞学诊断:(甲状腺右叶结节)涂片见数堆腺上皮细胞,部分细胞胞核稍有异型,倾向肿瘤性病变,请做进一步检测除外恶性。(TBSRTC Ⅳ)
-
BRAFV 600E:存在点突变
-
临床:
-
组织病理学:(甲状腺右叶+峡部)乳头状癌。
启示:
1、当样本中细胞量很少,但具有异型性时,很可能细胞学诊断为TBSRTC Ⅲ(AUS)。
2、当样本中细胞以微滤泡形式为主,部分细胞核出现异型性(核增大、形态不规则、局灶性染色质透明等),可能细胞学诊断为TBSRTC Ⅳ。
3、病理解读要独立于分子检测,部分细胞有异型+BRAF点突变,支持提级处理(升级为TBSRTCⅤ,可疑恶性)。
4、ARMS法敏感性高,对于细胞量稀少导致的TBSRTC Ⅲ,辅助诊断价值很高。
病例三:
-
女,52岁;
-
超声检查:甲状腺右叶中下部背侧见4.1*7.1mm低回声团块,边界欠清,纵向生长,内见点状强回声,MT可能。
-
细胞学诊断:(甲状腺右叶结节)涂片见数堆腺上皮细胞,部分细胞拥挤,细胞核大、可见核沟,倾向肿瘤性病变,请做进一步检测除外恶性。(TBSRTCⅣ)
-
BRAF V600E:未检测到突变
-
临床:

-
组织病理学:(甲状腺右叶+峡部)乳头状癌。
启示:
当样本中细胞以微滤泡形式为主,部分细胞核出现异型性(核增大、形态不规则、局灶性染色质透明等),细胞学可能诊断为TBSRTCⅣ,即使BRAF阴性,也应该注明细胞核的形态学改变,描述性语言有可能会影响临床处理。
思考:
单一BRAF基因检测,无法提供足够高的阴性预测值,希望开展多基因检测以提高分子检测灵敏度。但成功率、可及性、时效性方面如何平衡?
病例四:
-
男,48岁;
-
超声检查:甲状腺右叶中上部见25*19mm低回声团块,边界不清,非水平位,周边分布数枚斑点状强回声,TI-RADS 4c。右颈根部颈动脉后淋巴结回声异常——考虑受侵不除外。
-
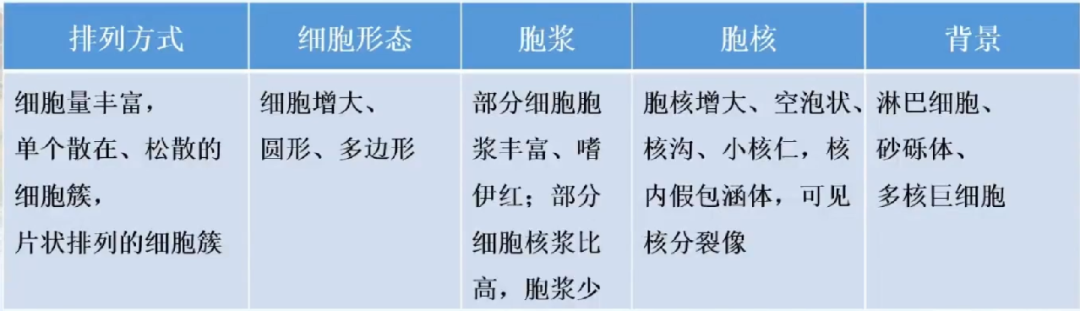
细胞学特征:
-
诊断?
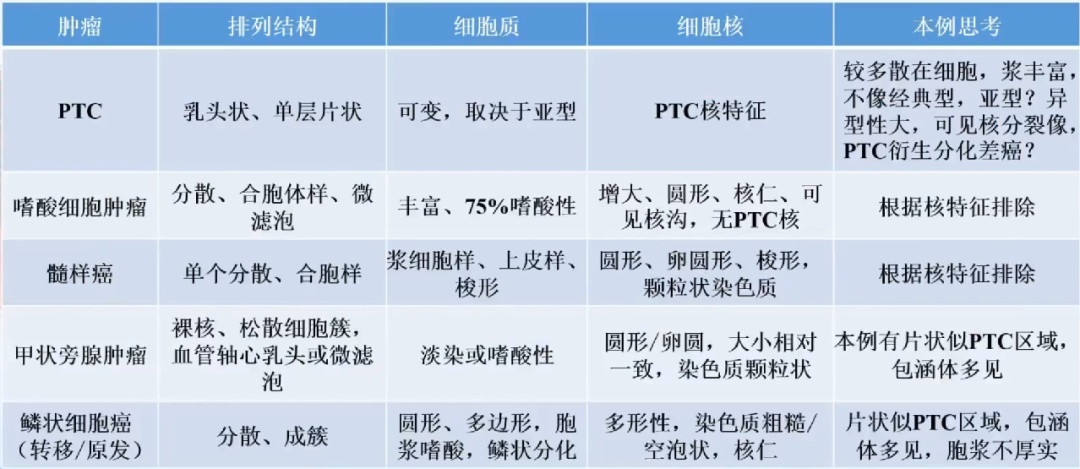
-
细胞学诊断:(甲状腺右叶)见恶性肿瘤细胞,倾向低分化癌,建议术中冰冻(TBSRTC Ⅵ)
-
BRAF V600E:存在点突变
-
病理诊断:肿物全部取材,可见乳头状癌成分,部分肿瘤细胞呈实性巢状生长,细胞胞浆丰富嗜伊红,细胞核空泡状,部分核仁明显,部分区可见鳞化,小灶可见坏死,核分裂像密集区约2个/10HPF,结合免疫组化结果,考虑乳头状癌(约占70%),部分区分化降低,呈高级别分化型甲状腺癌(约占30%)。
-
免疫组化:TG(部分+)、TTF-1(部分+)、CD56(+)、CK19(+)、Galectin-3(少量弱+)、Ki-67(10%+)、P40(少量+)、P63(少量+)
-
高级别分化型甲状腺癌(DHGTC):2022年WHO第5版甲状腺肿瘤分类中新命名的一种甲状腺侵袭性癌,具有高级别形态学特征(高分裂像活性、肿瘤坏死),中等预后风险。分子特征:BRAF、RAS、TERT等
启示:
BRAF V600E可用于鉴别诊断,排除甲状腺低风险肿瘤、髓样癌、嗜酸细胞癌、甲状旁腺肿瘤等诊断。
总结
1、甲状腺UG-FNA用于术前诊断,有助于决定临床处理方案,加BRAF检测,可降低诊断不确定性,并可用于少见细胞形态肿瘤的鉴别诊断。
2、单一BRAF检测,检测成功率高(所需细胞量少)、可及度高(ARMS 1000元)、时效性高(3-4天出结果),尤其在我国BRAF阳性率高的情况下,适于普遍开展。
3、单一BRAF检测,阴性预测值有限,识别高危PTC患者临床意义有限,难以指导预后分层。条件允许的情况下,应与其他基因变异一同评估。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







