Lancet:双特异性抗体治疗肿瘤的新进展—血液肿瘤
2023-06-10 聊聊血液 聊聊血液 发表于上海
文中描述了血液肿瘤和实体瘤中T细胞衔接BsAbs的新进展,现翻译文中血液肿瘤疗效和毒副作用的部分供各位老师参考。
双特异性抗体
目前常见的两种新型T细胞治疗策略,即嵌合抗原受体 (CAR) T细胞和双特异性抗体 (BsAb),可将T细胞重定向到肿瘤细胞。目前已有多个CAR T 细胞疗法获得监管部门批准,用于治疗 B 细胞急性淋巴细胞白血病 (B-ALL)、淋巴瘤或多发性骨髓瘤患者。然而由于个性化 CAR T 细胞的生产、运输和质量控制所需的时间,大多数 CAR T 细胞治疗具有明显的静脉-静脉时间(约6-8周),从而限制了其在快速进展疾病患者中的可行性。CAR T 细胞治疗还可能伴随严重的细胞因子释放综合征 (CRS) 和神经系统症状,因此妨碍了老年、临床更易感患者的治疗。相比之下,BsAbs是直接可用的,即所谓的现成产品,不需要桥接治疗。此外,≥3级CRS 或神经毒性的发生率通常低于 CAR T 细胞治疗,如果需要也可停止治疗,使得BsAb 治疗能够扩展至晚期疾病患者和老年患者。
T 细胞衔接(T-cell-engaging)BsAbs可同时与肿瘤细胞上的抗原和 T 细胞上的 CD3 亚基结合,使T细胞募集到肿瘤上,随后T细胞活化和脱颗粒并消除肿瘤细胞。已在多种血液恶性肿瘤中显示出显著活性,包括急性淋巴细胞白血病、B细胞非霍奇金淋巴瘤及多发性骨髓瘤,但实体瘤的进展较慢。CRS也是与 BsAb 治疗相关的最常见毒性,由分泌促炎性细胞因子的活化 T 细胞所引起。
《The Lancet》近日发表一篇综述“T-cell-engaging bispecific antibodies in cancer”,文中描述了血液肿瘤和实体瘤中T细胞衔接BsAbs的新进展,现翻译文中血液肿瘤疗效和毒副作用的部分供各位老师参考。

T细胞衔接BsAbs在血液肿瘤的活性
前体B细胞急性淋巴细胞白血病 (B-ALL)
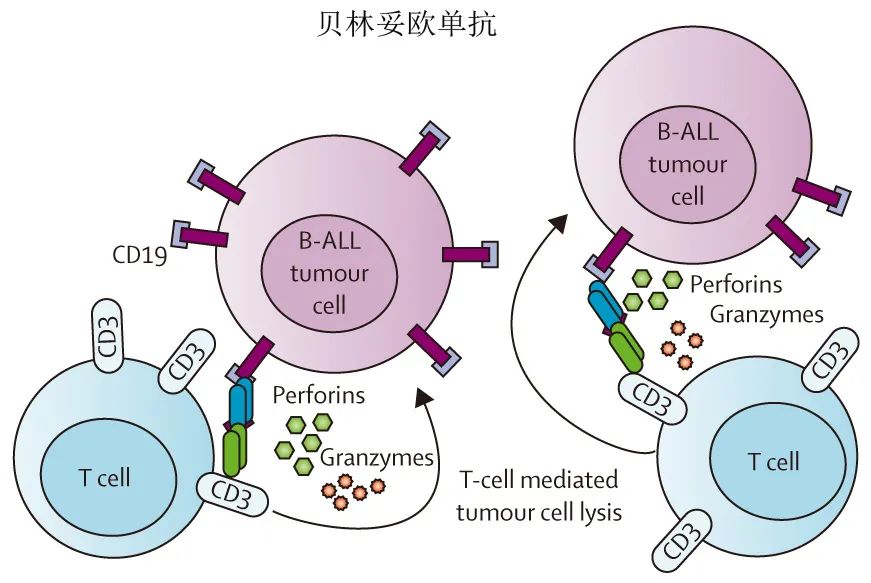
尽管强化治疗可改善前体 B-ALL 成人患者的预后,但约10%的患者为原发难治,此外约半数CR的患者会复发,复发后5年生存率只有10-30%。对于这些患者,贝林妥欧单抗(blinatumomab)是首创BiTE,在复发或难治性费城染色体 (Ph) 阳性和 Ph 阴性 ALL 的2期研究中显示活性。3期、随机TOWER 研究显示,在既往接受过多线治疗的 Ph 阴性前体 B-ALL 患者中,贝林妥欧单抗在CR率、微小残留病 (MRD) 阴性和无事件生存期(EFS;表1)方面优于标准化疗,中位总生存期(7.7个月)也高于标准化疗(4.0个月)。有研究在形态学CR期间 MRD 仍为阳性的患者中探索了贝林妥欧单抗,其对预后产生负面影响。贝林妥欧单抗可使大多数 MRD 阳性 ALL 患者(约80%)转变为 MRD 阴性,意味着金额延长无白血病生存期。此外,2项随机3期研究显示,在首次复发 B-ALL 儿童中,在异基因干细胞移植 (allo-SCT) 前使用贝林妥欧单抗进行再诱导治疗,MRD阴性率高于标准化疗,从而进行 allo-SCT 的可能性更大,并且总生存期也有所改善(表1)。这些研究促使欧洲药品管理局 (EMA) 和美国食品药品监督管理局 (FDA) 批准贝林妥欧单抗用于治疗复发或难治性 Ph 阳性和 Ph 阴性 ALL 患者,以及首次或第二次CR且MRD≥0.1%的患者。

贝林妥欧单抗未来有望与常规化疗联合使用,成为一线治疗的一部分,该策略已得到多项研究的支持,包括一项2022年的随机化3期研究,显示在巩固化疗基础上加用贝林妥欧单抗治疗新诊断的 Ph-阴性前体 B-ALL 患者(30-70岁)的总生存期统计学显著改善,患者在强化化疗后为 MRD 阴性(表1)。贝林妥欧单抗也可用于老年一线患者,在新诊断Ph 阴性 ALL 老年患者(中位年龄75岁)中,贝林妥欧单抗单药治疗之后进行化疗维持的耐受性良好。已在新诊断Ph 阳性 ALL 患者中评估贝林妥欧单抗与酪氨酸激酶抑制剂的无化疗联合治疗,并且在2期研究中显示了有希望的结果(与达沙替尼联用的3年总生存率为80%;与ponatinib联用的2年总生存率为95%),从而可以减少对 alloSCT 的需求。最后,已研究基于贝林妥欧单抗的新型免疫疗法联合方案,例如联合 PD-1 和 PD-L1抑制剂、CTLA-4阻断抗体或奥加伊妥珠单抗治疗方案。
B细胞非霍奇金淋巴瘤
化疗联合裸抗 CD20 抗体(例如利妥昔单抗)使 B 细胞非霍奇金淋巴瘤患者的结局出现统计学显著改善,但多线治疗患者的预后仍较差,突出了对新型药物的需求。这些患者的治疗选择正在迅速演变,CAR T细胞治疗和 T 细胞重定向抗体显示出有前景的活性。
贝林妥欧单抗
贝林妥欧单抗在既往多线治疗的淋巴瘤患者中的缓解率较高,但神经毒性的频繁发生(包括头痛、意识模糊、言语障碍、震颤和癫痫发作)和连续输注的需求限制了治疗 B 细胞淋巴瘤的进一步发展。
CD20 × CD3 BsAbs
已有一些半衰期更长的 IgG 样BsAbs(能够实现更实用和可控的给药方式)正在临床开发中,用于治疗淋巴瘤患者。淋巴瘤中最晚期的 IgG 样 BsAbs 是靶向CD20。
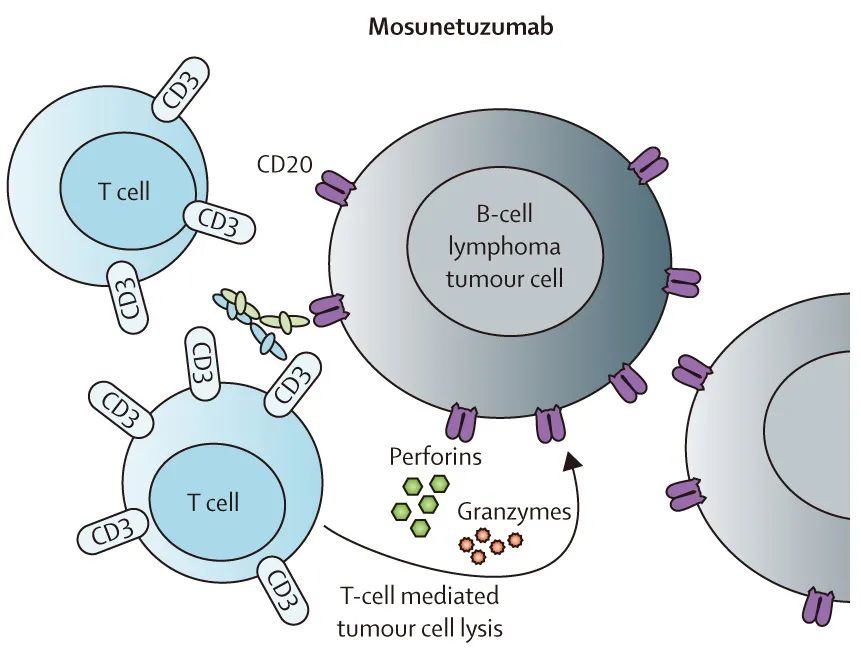
在 I 期剂量递增试验中,有证据表明epcoritamab、mosunetuzumab、odronextamab、glofitamab、plamotamab和 Igm-2323 在复发或难治性侵袭性和惰性非霍奇金淋巴瘤患者中具有显著活性,包括抗 CD20 治疗难治或既往接受过 CAR T 细胞治疗的患者。CRS是最常见的不良事件(但多为低级别),而神经毒性的频率较低(表2)。年龄≥75岁患者也可以用CD20×CD3 BsAbs成功治疗。这些抗体之间的差异包括治疗持续时间(直至进展 vs 固定持续时间治疗)和给药方法(静脉 vs 皮下;表2)。

几个扩展队列评估了特定淋巴瘤亚型,包括在既往接受过≥两种治疗的复发或难治性滤泡性淋巴瘤患者中以推荐的 II 期剂量给予mosunetuzumab的 II 期扩展研究。在这项研究中,固定持续时间的mosunetuzumab可诱导深度和持久的缓解(CR率为60.0%;中位PFS为17.9个月)。EMA(2022年06月03日)和FDA(2022年12月22日)批准mosunetuzumab用于既往接受过两种或两种以上全身治疗的滤泡性淋巴瘤患者。其他扩展队列显示,epcoritamab和 glofitamab 在复发或难治性弥漫性大 B 细胞淋巴瘤患者中具有高活性;ORR为50-60%,CR率约为40%。
鉴于CD20×CD3 BsAbs的强效抗肿瘤活性和可控的安全性特征,还在复发或难治性淋巴瘤患者中研究了其联合其他抗淋巴瘤疗法(例如联合化疗 [例如GemOx47]、免疫化疗 [例如R-DHAX/C]、检查点抑制剂 [例如抗 PD-L1 和抗TIGIT]、伊布替尼、或维泊妥珠单抗)。此外,初步结果显示CD20×CD3 BsAb和免疫调节剂 (IMiD) 来那度胺联合治疗复发或难治性滤泡性淋巴瘤具有较好疗效:mosunetuzumab联合来那度胺 ORR 为92%,CR率为77%;epcoritamab联合来那度胺-利妥昔单抗 ORR 为100%,CR率为96%。基于这些结果,已启动3期研究以评估这种新型联合是否优于来那度胺+利妥昔单抗。还在新诊断弥漫性大 B 细胞淋巴瘤患者中评估CD20×CD3 BsAbs联合环磷酰胺-羟基柔红霉素-长春新碱-泼尼松 (CHOP)、利妥昔单抗-CHOP 或维泊妥珠单抗-R-CHP,旨在改善总生存结局
其他BsAbs
正在评估用于治疗淋巴瘤的其他 BsAbs 包括靶向ROR1、CD22或 CD79b 的BsAbs。半衰期长于贝林妥欧单抗的 CD19 T 细胞重定向抗体也在开发中。
多发性骨髓瘤
由于蛋白酶体抑制剂、IMiD和 CD38 靶向抗体的引入,多发性骨髓瘤患者的生存期大幅改善;但对这些药物难治(三类难治)的患者临床结局极差,中位 PFS 仅3.9个月,中位总生存期仅11.1个月,表明需要具有新作用机制的药物。近2年发表的研究表明,T细胞重定向免疫治疗在这些强化预治疗的患者中具有较高活性。
BCMA×CD3 BsAbs
BCMA 在成熟 B 细胞和浆细胞上的选择性表达使其成为多发性骨髓瘤患者 T 细胞重定向策略的有吸引力的靶点。一些 BCMA 靶向 BsAbs 正在广泛预治疗的多发性骨髓瘤患者中进行评估。AMG-420(靶向BCMA的首创BiTE)的 I 期研究提供了概念验证证据,证明 BsAbs 可有效治疗晚期多发性骨髓瘤(MTD时 ORR 为70%;50%为CR);但由于半衰期较短需要连续输注,导致其临床开发停止。
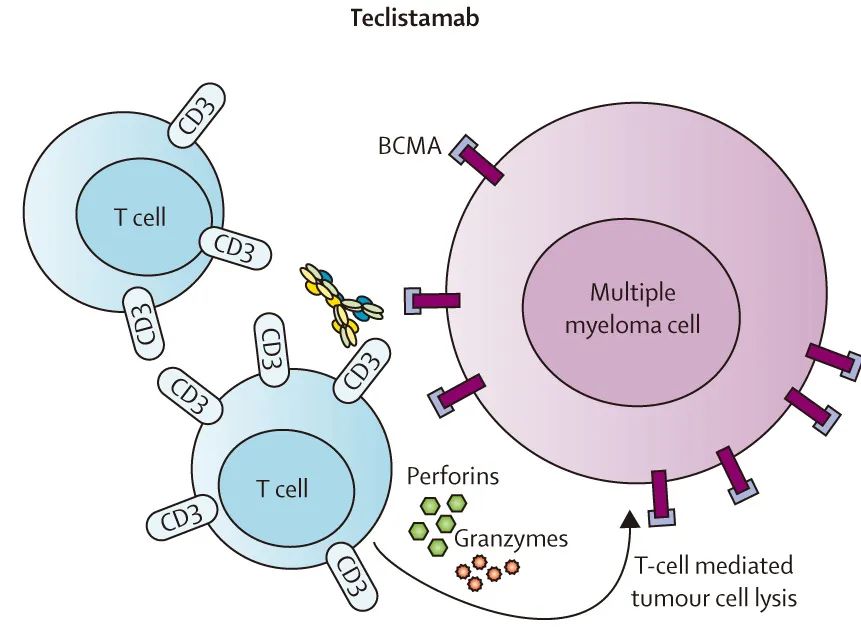
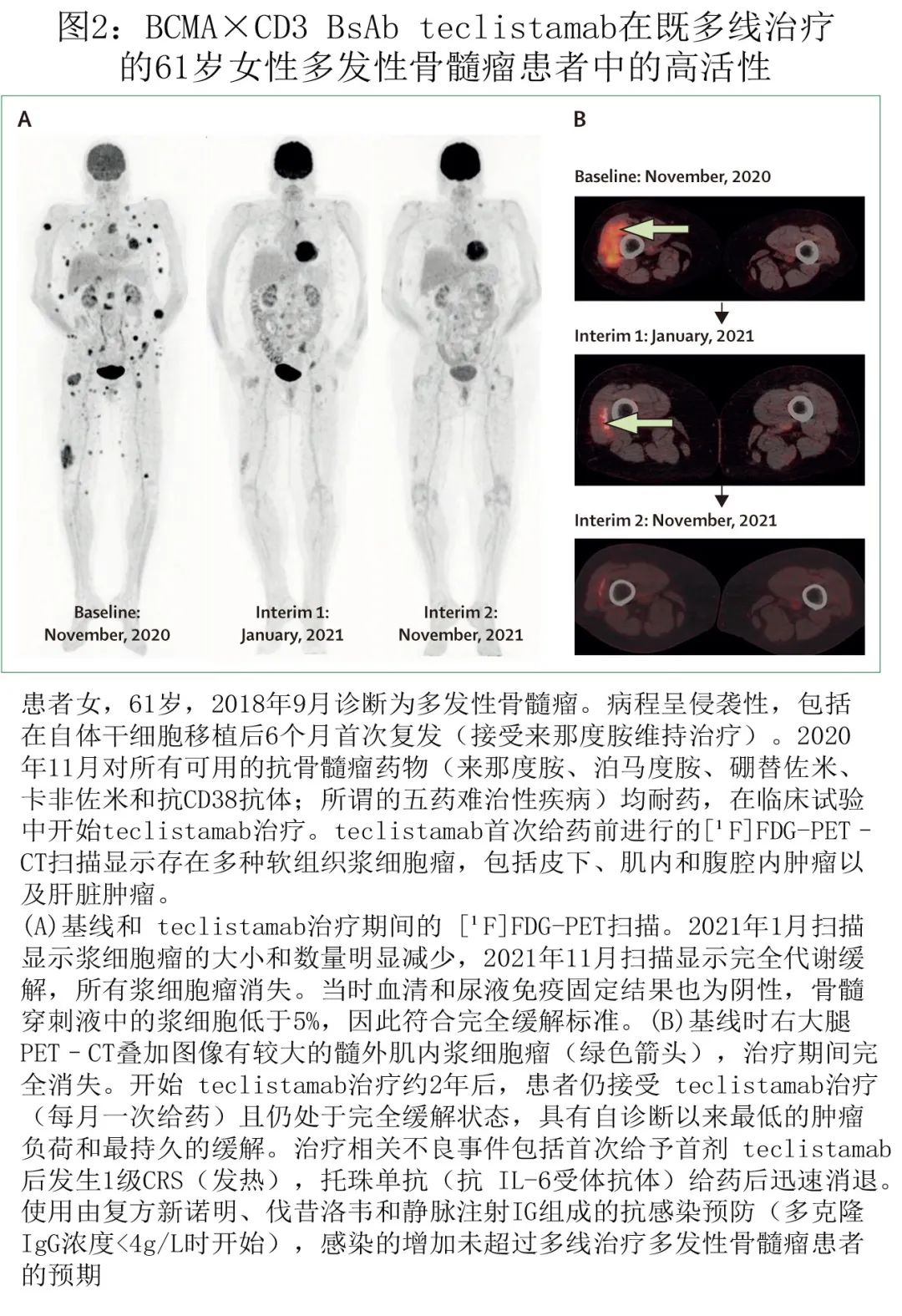
Teclistamab 是靶向BCMA的 IgG 样BsAb,EMA(2022年08月24日)和FDA(2022年10月25日)已批准 Teclistamab 用于既往多线治疗的多发性骨髓瘤患者。在接受推荐的 II 期剂量治疗的165例三类暴露患者(77.6%为三类难治)中,Teclistamab显示出高活性(63.0%的患者达到≥PR;39.4%的患者达到≥CR;中位 PFS 为11.3个月)。接受 teclistamab 有效治疗的多线治疗患者的临床病例见图2。此外无论患者年龄为≥75岁、65-75岁或<65岁,均可达到该疗效。Teclistamab耐受良好,血液学毒性和CRS(主要是低级别)是最常见的不良事件。
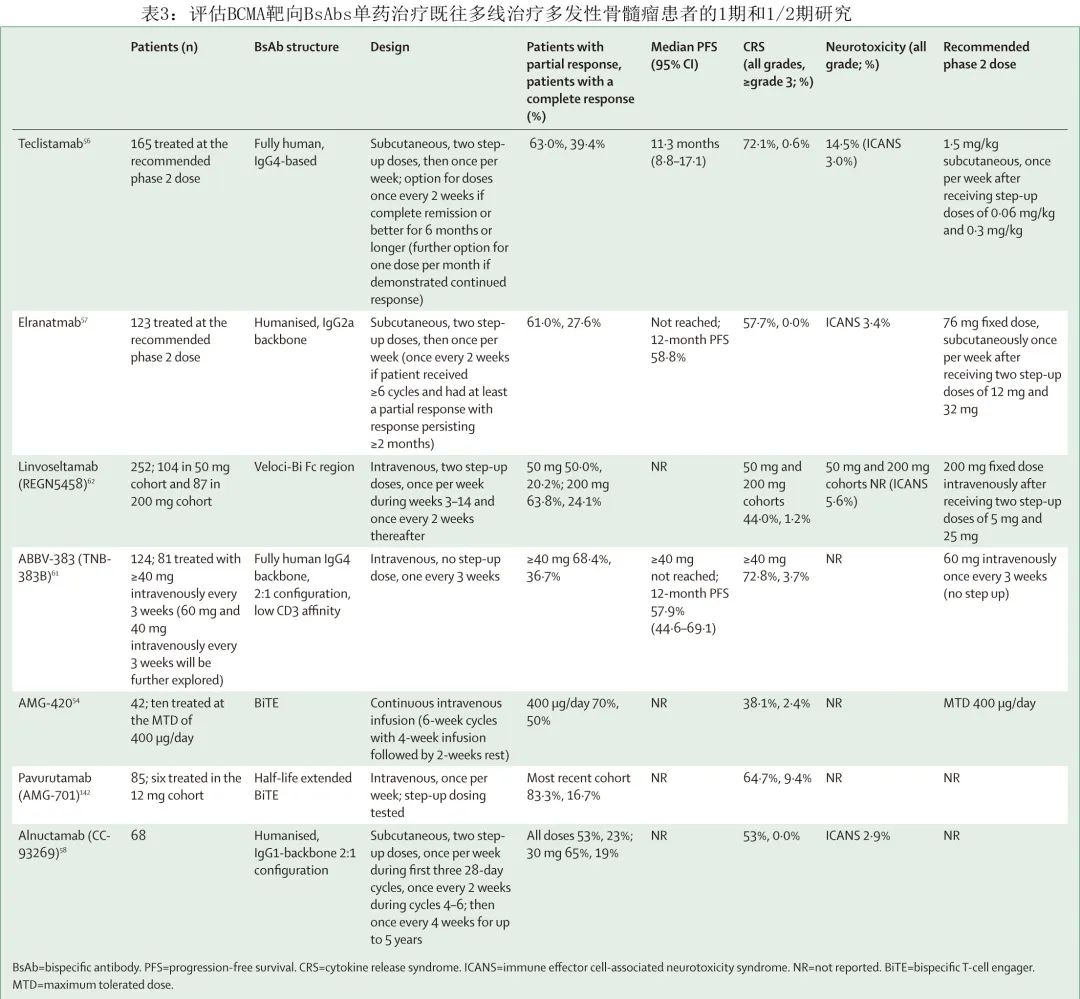
此外,BCMA靶向 BsAb elranatamab 正处于晚期临床开发阶段,在三类难治多发性骨髓瘤患者中具有良好的活性和可控的毒性特征(≥PR 61.0%;≥CR 27.6%;9个月 PFS 率63.0%)。其他 BCMA 靶向 BsAbs 包括alnuctamab、HPN217、WVT078、ABBV-383和linvoseltamab(表3)。这些 BsAbs 均耐受性良好,在多线治疗患者中缓解率较高。尽管这些 BCMA 靶向 BsAb 的活性和安全性相似,但在给药途径(皮下 vs 静脉)和方案方面存在差异(例如每周给药一次 [teclistamab 和 elranatamab] vs 治疗开始后每3周给药一次 [ABBV-383];表3)。这些靶向 BCMA 的 BsAb 之间,对递增剂量和住院监测不良事件(例如CRS)的需求也各不相同(表3):ABBV-383 可以不递增剂量给药,因此监测要求相对较短(初次给药后48 h),这可以通过 ABBV-383 的低亲和力 CD3 结合域来解释,在临床前研究中发现其可减少细胞因子释放。
进行中的研究正在评估这些药物联合其他抗骨髓瘤药物,如 CD38 抗体(如达雷妥尤单抗)和IMiD,以及在早期治疗线中,如新诊断的疾病。TRIMM-2 研究的早期数据显示,在既往多线治疗的多发性骨髓瘤患者(63.1%为CD38 抗体难治)中,teclistamab可与达雷妥尤单抗有效联合治疗(74-100%的患者达到≥PR),且毒性无重叠。另一项进行中的研究正在探索teclistamab–达雷妥尤单抗–来那度胺联合治疗既往1-3线治疗的患者(来那度胺难治性28.1%;CD38抗体难治性18.8%)。初步数据表明该联合治疗可产生深度和持久的缓解(93.5%的患者达到≥PR;54.8%的患者达到≥CR)。在不适合移植或不预期移植的新诊断多发性骨髓瘤患者中比较teclistamab–达雷妥尤单抗–来那度胺与达雷妥尤单抗–来那度胺–地塞米松的随机化 III 期 MajesTEC-7 研究,也正在评估这种全免疫三联方案的活性。
GPRC5D
由于 BCMA 靶向治疗在多发性骨髓瘤中的应用越来越多,其可降低 BCMA 表达或导致 BCMA 完全丧失,因此需要 T 细胞重定向 BsAbs 的额外靶点。
Talquetamab 与 GPRC5D 分子(在多发性骨髓瘤细胞上高表达)和 CD3 受体结合,导致多发性骨髓瘤细胞有效的 T 细胞重定向溶解。一项 I/II 期研究纳入既往接受过多线治疗的多发性骨髓瘤(71.5%为三类难治)患者,定义了两种不同的 talquetamab 推荐 II 期剂量且疗效相似(400 μg/kg皮下给药每周一次,74.1%达到≥PR;,800 μg/kg每2周一次皮下给药,73.1%达到≥PR。最常见的不良事件为血细胞减少和CRS,与靶向 BCMA 的 BsAbs 相似。GPRC5D 也在毛囊和硬角化组织的部分细胞群中表达,从而解释了特定的靶向肿瘤外相关副作用,如味觉障碍、皮肤疾病和指(趾)甲疾病;这些不良事件可以通过外用药物或重度患者中断给药进行管理。talquetamab 联合抗 CD38 抗体或 IMiD 的研究正在进行中;早期数据表明,在复发或难治性多发性骨髓瘤(75.9%为CD38靶向抗体难治)患者中,talquetamab可安全有效地与达雷妥尤单抗联合,80.4%的患者达到≥PR。
其他靶向 GPRC5D的 BsAbs 也处于临床开发阶段,包括RG6234 (forimtamig),它通过两个结构域与 GPRC5D 结合,以提高结合亲和力。一项 I 期剂量递增研究的初步结果显示,静脉给药(71.4%达到≥PR)和皮下给药(63.6%达到≥PR)均具有活性;不良事件特征与 talquetamab 相似。
FcRH5
Cevostamab 靶向多发性骨髓瘤细胞上 FcRH5 和 T 细胞上 CD3 的膜近端结构域,正在多线治疗多发性骨髓瘤患者(84.5%为三类难治)中开展I期剂量递增研究。Cevostamab 具有可控的毒性特征,血细胞减少和 CRS 是最常见的不良事件。缓解率随目标剂量增加而增加:56.7%的患者在 132-198 mg 剂量下达到≥PR。CAMMA-1 研究正在评估 cevostamab 联合泊马度胺或达雷妥尤单抗的安全性和活性。
急性髓系白血病(AML)
AML 是一种异质性疾病,尤其是从分子学角度来看,相当大比例的患者强化化疗后无完全缓解或早期复发,化疗耐药的白血病干细胞是疾病复发的基础。BsAbs 免疫疗法是重要的新型抗白血病治疗策略,能够同时消除白血病原始细胞和白血病干细胞,而这是产生持久抗肿瘤反应的先决条件。治疗靶点包括CD33、CD123和 C 型凝集素样分子1(CLL-1)。从治疗靶点的角度来看,与分化程度较高的 AML 细胞相比,白血病干细胞上 CD123 的高表达更值得感兴趣。这些靶点的缺点之一在于是它们不是真正的 AML 特异性的,在不同的正常造血细胞群上的表达可导致血细胞减少,但血细胞减少是可逆的,因为 AML 表面抗原不表达 (CLL-1) 或仅在正常造血干细胞上以低浓度表达(CD33和CD123),从而可以重建正常造血。
Flotetuzumab 是一种CD123×CD3双特异性DART,在复发或难治性 AML 患者的 I/II 期研究中显示出可接受的毒性特征和活性(推荐 II 期剂量下 ORR 为24%)。最常见的不良事件是血细胞减少和CRS,但治疗有效的患者在 flotetuzumab 治疗期间血细胞计数恢复。Flotetuzumab 必须通过连续静脉输注给药,而同样靶向 CD123 的全长免疫球蛋白分子 XmAb14045 可间歇给药;在既往多线疗的 AML 患者中,XmAb14045在最高剂量下具有良好活性。
在既往多线治疗的 AML 患者中,靶向CD33 BsAb(例如 AMG 330 和AMG 673)也有抗白血病活性,但MCLA-117(一种CLL-1×CD3 BsAb)的临床试验因疗效不佳而停止。
毒性
CRS
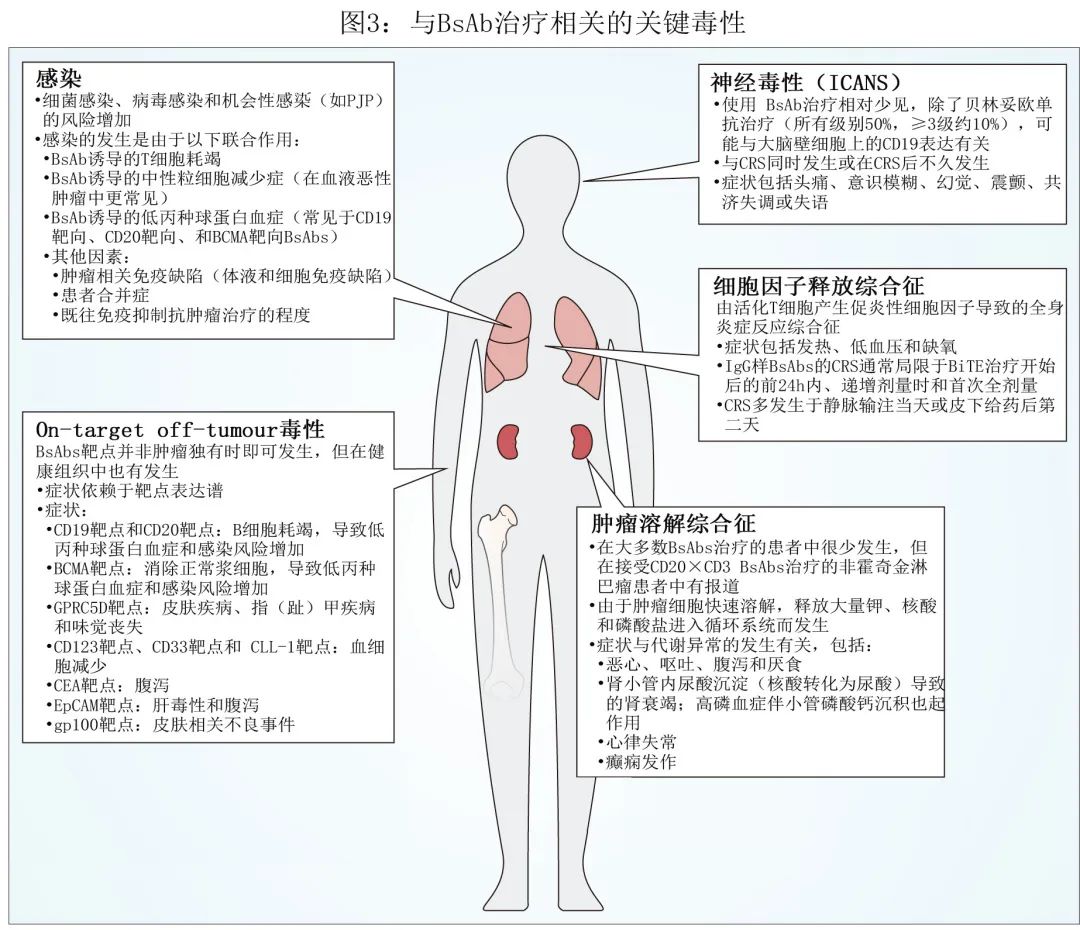
BsAbs 治疗可导致 T 细胞活化和脱颗粒,并产生促炎性细胞因子(如IL-2、IL-6、IFN-γ和TNF-α)。细胞因子的增加通常可导致全身炎症反应综合征(CRS;图3),其临床表现多变,如不迅速恰当处理,可能介于发热等轻度症状到缺氧、低血压等严重症状。CRS 分级量表多种多样,但建议使用美国移植和细胞治疗学会的共识分级指南,以提高研究间的一致性。BiTE 连续给药时,在输注开始后第1天达到最高细胞因子浓度,第2天后细胞因子浓度快速下降,表明 CRS 主要发生在 BiTE 治疗开始后的前 24 h 内。此外,BsAb间歇性给药后,细胞因子反应会在前几次给药后减弱,CRS事件通常局限于递增剂量或首次全剂量。IgG 样 BsAbs 引起的 CRS 通常发生在静脉输注当天,而发生在皮下给药后第二天。与静脉给药相比,皮下给药的至发作时间更长,这可以通过皮下给药后血清浓度增加较缓慢来解释。
已经开发了各种策略来降低重度 CRS风险。逐步增加剂量可缓解细胞因子分泌,并降低 CRS 的频率、严重程度和中位持续时间,从而可以较高剂量的安全给药。此外,前驱用药(包括类固醇)可减少促炎细胞因子(如IFN-γ、IL-2、TNF-α和IL-6)的生成,从而降低 CRS 风险。有临床证据表明,与静脉给药相比,皮下给药可降低重度 CRS 风险。最后,以低亲和力结合 CD3 的 BsAbs 的 CRS 率较低,正如ABBV-383。
发生 CRS 的患者应开始支持治疗,包括及时给予 IL-6 受体阻断抗体(托珠单抗)或类固醇。此外,如果通过连续静脉输注给予半衰期较短的BsAb(例如BiTes和DART),则可暂时降低剂量或中断给药。其他支持性治疗措施包括退热药(对乙酰氨基酚)、静脉补液和补氧。患者通常在标准支持治疗后可迅速恢复,但重度 CRS 可能需要在重症监护室进行强化监测和支持(例如血管加压药治疗)。对于疑似CRS 患者,由于体征和症状重叠以及通常伴随的中性粒细胞减少症,应注意可能的感染。
神经毒性
与 BsAb 治疗相关的神经毒性并不常见,通常与 CRS 同时发生或在 CRS 后不久发生;但也可独立于 CRS 发生。这种类型的神经毒性(也称为免疫效应细胞相关神经毒性综合征 [ICANS])的特征为头痛、意识模糊、幻觉、癫痫发作、震颤、共济失调或失语。ICANS风险可以通过逐步增加剂量和使用前驱用药来降低。发生 ICANS 的患者的支持性治疗措施包括给予托珠单抗(仅在并发 CRS 的情况下)、类固醇或抗癫痫药物
虽然贝林妥欧单抗的不良事件并不常见,但神经毒性的发生率较高(所有级别47-53%,≥3级7-13%),大部分都可以完全消退。与靶向其他抗原的治疗相比,CD19 BsAbs 的神经毒性发生率更高,可以通过大脑壁细胞上 CD19 的定义表达来解释;这些细胞围绕内皮细胞,对于调节血脑屏障的完整性至关重要;在 CD19 CAR T 细胞中也观察到相似的神经系统事件。
感染
感染在BsAb 治疗中很常见,但临床研究之间的感染率存在显著异质性(表4)。除肿瘤类型外,也可能与既往免疫抑制治疗的程度及 BsAb 介导的中性粒细胞减少症(常见于血液恶性肿瘤)的频率差异有关。此外,消耗正常浆细胞(BCMA靶向或 GPRC5D 靶向BsAbs)或正常 B 细胞(CD19靶向或 CD20 靶向BsAbs)的 T 细胞重定向抗体经常可诱发低丙种球蛋白血症。此外,由持续 BsAb 介导的 T 细胞活化引起的 T 细胞耗竭可能导致感染风险增加,其发生率和严重程度也可能随着联合治疗而增加。

密切监测感染症状至关重要。在对疑似感染患者的检查中,应监测罕见机会性感染的可能性(例如腺病毒 [肝炎和肺炎]、巨细胞病毒、EB病毒、细小病毒B19、乙型肝炎、进行性多灶性白质脑病、BK病毒、耶氏肺孢子虫肺炎、弓形虫病和曲霉菌)。
预防感染的支持性治疗包括,中性粒细胞减少症患者给予生长因子支持,低丙种球蛋白血症患者补充静脉注射免疫球蛋白。对于这些感染风险增加的患者,应考虑预防疱疹病毒感染和肺孢子菌肺炎。接受活性治疗的患者可能对新冠肺炎RNA 疫苗接种的体液和细胞免疫应答欠佳,尤其是接受靶向CD19、CD20或 BCMA 治疗的患者,因此应考虑预防措施,如新冠肺炎特异性单克隆抗体,它对循环新冠肺炎变种有效。
肿瘤溶解综合征
尽管 BsAbs 可迅速降低肿瘤负荷,但发生肿瘤溶解综合征的情况很少。有肿瘤溶解综合征风险的患者(例如肿瘤负荷高或肾功能受损的患者)应接受预防治疗,如低尿酸血症药物和水化。
On-target off-tumour副作用
BsAbs 的靶标通常并非肿瘤特异性,在正常细胞上也表达,可能导致发生on-target off-tumour副作用(图3),因此正在开发最小化on-target off-tumour毒性的新策略。其中一种策略是组合靶向正常细胞上不重叠表达的抗原,可以通过使用两种不同的hemibodies完成,包括与抗 CD3 抗体的可变轻链结构域或可变重链结构域融合的肿瘤相关抗原结合结构域,只有当hemibodies在单个细胞上同时结合其靶抗原时,它们才会排列并重建原始的 CD3 结合位点以与 T 细胞结合;同时结合可以实现高精度靶向和杀死双抗原阳性肿瘤细胞,而单抗原阳性细胞幸免。预防on-target off-tumour毒性的另一种方法是通过给予BsAb前体药物版本来限制肿瘤微环境中的 T 细胞活化,可以通过使用抑制 CD3 结合或 TAA 结合的蛋白酶可裂解肽掩模(protease-cleavable peptide masks)来实现。一旦进入肿瘤微环境,在肿瘤特异性蛋白酶存在的情况下,前体药物转化为其活性形式,然后游离与肿瘤细胞和 T 细胞结合。临床前开发中肿瘤激活 BsAb 的示例包括PSMA×CD3 BsAb和EGFR×CD3 BsAb,它们具有肿瘤蛋白酶可裂解肽掩模,可抑制抗体与 CD3 结合;EGFR×CD3 BsAb还具有肿瘤蛋白酶可裂解掩模,可抑制 EGFR 与靶细胞的结合。
参考文献
Niels W C J van de Donk, Sonja Zweegman.T-cell-engaging bispecific antibodies in cancer.Lancet . 2023 Jun 1;S0140-6736(23)00521-4. doi: 10.1016/S0140-6736(23)00521-4.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言