【协和医学杂志】11C-乙酸盐心脏PET/CT成像动力学参数与成像时长关系研究
2023-08-18 协和医学杂志 协和医学杂志 发表于上海
本研究旨在探究不影响药代动力学参数定量计算的前提下缩短动态11C-AC PET/CT数据成像时间的可行性,以期为临床优化11C-AC PET/CT图像采集时间提供依据。
动态11C-乙酸盐(11C-AC)正电子发射断层显像(PET)已广泛应用于心脏功能的定量评估,包括心脏效率、心肌氧代谢和心肌血流量[1-3]。目前PET/CT动态图像分析过程中,图像重建时通常采用时间间隔由短至长的策略。
早期短时间间隔图像重建旨在捕捉示踪剂在体内的峰值剂量;进入平台期后,示踪剂浓度变化逐渐平缓,因此扫描后期采用长时间间隔图像重建。目前,心脏11C-AC PET/CT动态采集时间较长(约为40 min)[4-5]。在扫描过程中,为保证重建图像的效果,要求患者尽量保持固定姿势,以致患者就诊体验不佳、依从性差。
长期以来,研究人员致力于在不影响定量参数计算结果的前提下缩短动态PET成像时间的探索。2000年Torizuka等[6]基于原发性肺癌患者的动态18F-氟代脱氧葡萄糖(18F-FDG)PET数据,采用三室模型进行参数拟合,结果显示30 min成像数据获得的净组织摄取率(Ki)同60 min成像数据的Ki显著相关(r=0.961, P<0.001)。
随后,Visser等[7]采用Patlak模型在13例非小细胞肺癌患者的动态18F-FDG PET数据上进行缩短成像时间的动力学参数估算实验,发现将成像时间缩短至30 min后病灶区域的Ki值同参考标准(50 min)Ki值之间线性回归模型的R2值达0.956。
Monden等[8]采用双组织室模型对脑胶质瘤患者的颅脑18F-FDG PET/CT动态数据进行药代动力学参数估算,发现基于40 min成像数据与60 min成像数据计算的18F-FDG磷酸化速率(k3值)差异仅为3%~5%。
近年研究显示,30~40 min的18F-FDG PET/CT动态扫描可得到与50~75 min常规扫描数据相一致的药代动力学参数[9-10],但目前缩短11C-AC扫描时长的相关研究仍较为匮乏。
本研究旨在探究不影响药代动力学参数定量计算的前提下缩短动态11C-AC PET/CT数据成像时间的可行性,以期为临床优化11C-AC PET/CT图像采集时间提供依据。
1 材料与方法
1.1 研究对象
本研究研究对象来自于一项评估饮酒男性心肌组织和代谢特征的临床研究[3]。46名受试者(34名饮酒受试者,12名健康受试者)均于北京协和医院接受11C-AC PET/CT心脏成像检查。
饮酒受试者纳入标准:(1)男性;(2)有饮酒史,饮酒时间超过10年且日均饮酒量>28 g 纯乙醇。
排除标准:(1)合并高血压、糖尿病、冠状动脉疾病、肝硬化、先天性心脏病、肾功能不全(肾小球滤过率<60 mL/min)的患者;(2)心电图示房颤或早搏;(3)左心室射血分数<50%或超声显示心脏结构异常;(4)有心脏磁共振检查禁忌证。
健康受试者纳入标准:与饮酒受试者年龄匹配且无饮酒史或每月摄入纯乙醇<100 g。
本研究已通过清华大学伦理审查委员会审批(审批号:20160012)。
1.2 研究方法
1.2.1 标准时长的11C-AC PET/CT显像检查
检查前24 h内禁饮咖啡、茶及酒精类饮料等。受试者取仰卧位,先进行低剂量CT检查;随后接受740 MBq 11C-AC静脉注射并在同一台PET/CT设备(PoleStar m660,北京赛诺联合医疗科技有限公司)完成40 min动态扫描。数据采集模式为“list-mode”,采集的PET数据均经过死时间校正和时间衰减校正。采用结合飞行时间的有序子集最大期望值法进行图像重建,获得53帧图像(15×10 s,15×30 s,16×60 s,7×120 s),图像尺寸为192×192×117,分辨率为3.147×3.147×1.867 mm3。11C-AC PET动态图像及时间活度曲线见图1。

图1 1例受试者PET动态图像及11C-AC代谢的时间活度曲线
A.PET检查过程中5个不同时间(帧)的图像,蓝色圆形框所选为左心室血池区域;B.基于血池区域测量获得的11C-AC代谢时间活度曲线
PET:正电子发射断层显像;11C-AC:11C-乙酸盐
1.2.2 11C-AC药代动力学参数拟合实验流程
根据美国心脏协会制定的标准生成17节段靶心图[11],并计算每个节段内的11C-AC活度平均值。采用单组织室模型计算每个节段的11C-AC药代动力学参数K1和k2[12],其分别表示11C-AC从血浆到组织的流入速率以及从组织到血浆的流出速率。微分方程见公式(1):
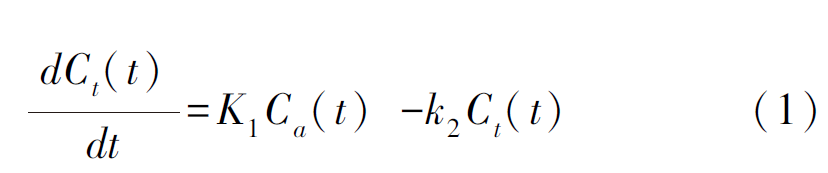
其中,Ca(t)表示血液中被标记的11C-AC浓度,即动脉输入函数;Ct(t)和dCt(t)/dt分别表示心肌中的11C-AC浓度和浓度变化速率。由于11C-AC药物的代谢特点,在PET心脏动力学参数计算时需对输入函数进行代谢校正并对心肌区域中11C-AC的浓度进行溢出与恢复校正。校正后的血池11C-AC浓度Ca(t)以及测量的心肌区域11C-AC浓度Cs(t)计算方法见公式(2)和公式(3):
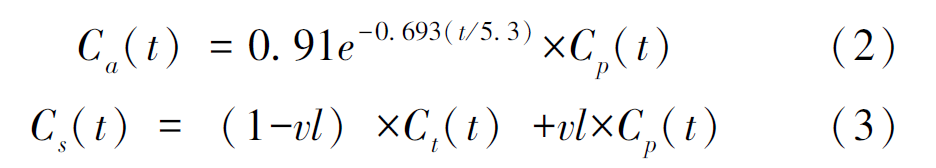
其中Cp(t)表示图像中测量得到的左心室血池中的11C-AC浓度,Ct(t)表示真实心肌中的11C-AC浓度,vl 表示左心室血池区域和心肌组织共同拥有的血液体积分数。
以基于40 min(53帧)标准时长动态数据拟合的动力学参数为参考标准,从最后一帧开始依次减少纳入的动态数据帧数(相当于缩短成像时间),并计算11C-AC药代动力学参数。
1.3 评价指标
采用线性回归模型评估缩短成像时间得到的11C-AC药代动力学参数与参考标准的一致性,评价结果以K1值、k2值与参考标准之间线性回归模型拟合结果的R2、回归系数以及K1值、k2值与参考标准的差异性表示。其中R2为线性回归模型对两组数据拟合程度的评价指标,其值越高表示线性回归模型拟合度越好,数据的相关性越强。
以靶心图中所有节段11C-AC药代动力学参数K1值、k2值与参考标准线性回归模型拟合优度评价指标R2均大于0.9时对应的成像时间为最短成像时间。
回归系数为两组数据变化趋势一致性的评价指标,其值越接近于1,表示两组数据变化趋势的一致性越好。
采用相对差异(RD)评估最短成像时间与参考标准之间左心室每个心肌节段11C-AC药代动力学参数K1值与k2值的差异性,其计算方法见公式(4):
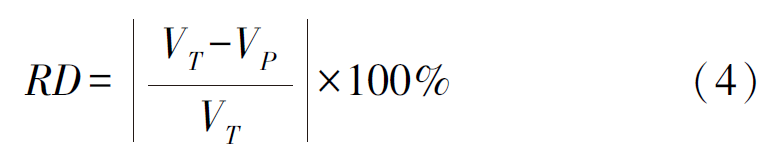
其中VT、Vp分别表示根据参考标准(40 min)数据和缩短成像时间数据拟合的11C-AC药代动力学参数值。
1.4 统计学处理
采用SPSS 25.0软件进行统计学分析。11C-AC药代动力学参数K1值与k2值为计量资料且满足正态分布,以均数±标准差表示;组间比较采用配对t 检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 基于不同成像时间图像数据计算的11C-AC药代动力学参数与参考标准的关系
缩短动态成像时间后,基于获取的图像信息采用单组织室模型计算11C-AC药代动力学参数,并将其与参考标准进行相关性分析,结果如图2所示。
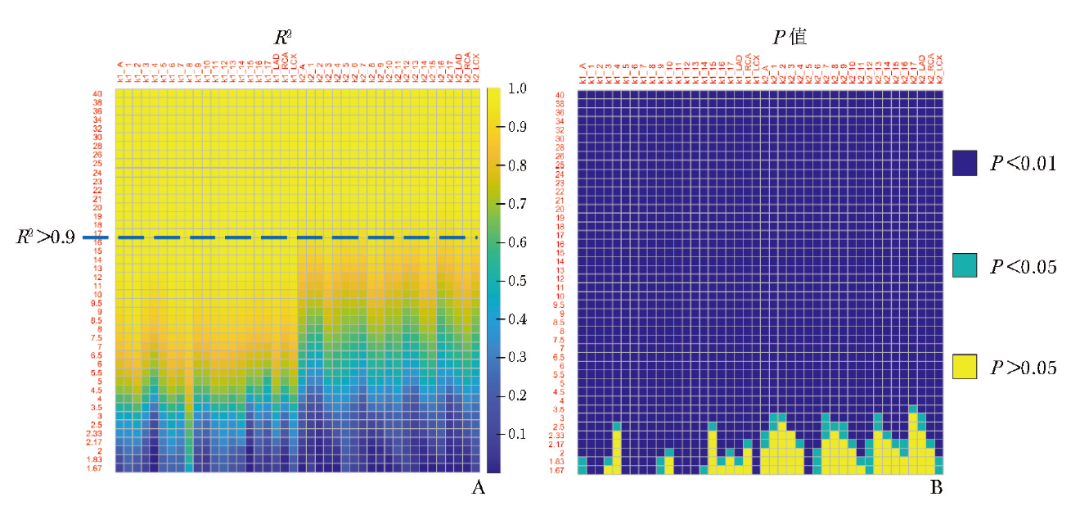
图2 不同成像时间计算的11C-AC药代动力学参数与参考标准的相关性分析
1~17:17个心肌节段;LAD:左前降支;RCA:右冠状动脉;LCX:左回旋支;R2:线性回归模型拟合度评价;P值:线性回归模型显著性检验; 11C-AC:同图1
图中纵坐标表示成像时间,横坐标表示不同的心脏区域[由左向右分别为心肌整体均值、1~17节段、左前降支(LAD)、右冠状动脉(RCA)、左回旋支(LCX)]中11C-AC药代动力学参数K1值与k2值同参考标准的相关性评价结果(以R2表示,图2A)及对应的P值(图2B)。
整体来看,随动态成像时间增加,K1值、k2值与参考标准的相关性逐渐增强,当成像时间≥17 min(37帧)时所有心肌节段中的K1值、k2值与参考标准的相关性均较好(R2均>0.9)。其中第8节段K1值与参考标准的相关性受成像时间的影响最小,多数节段的K1值与参考标准的相关性在成像时间缩短至10 min(30帧)时开始显著降低;各个节段k2值与参考标准的相关性在成像时间缩短至17 min(37帧)时明显下降,提示17 min是可接受的最短成像时间。
2.2 心肌平均11C-AC药代动力学参数与参考标准的关系
表1 缩短成像时间获得的11C-AC药代动力学参数与参考标准拟合模型的回归系数
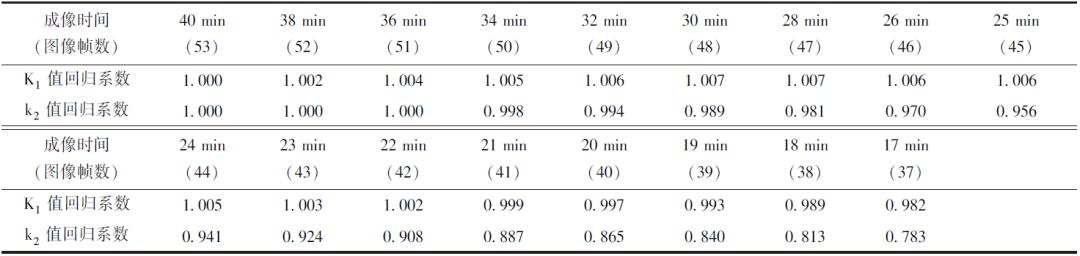
表1展示了动态成像时间≥17 min(37帧)时计算的心肌组织平均11C-AC药代动力学参数(17个心肌节段的均值)与参考标准拟合的线性回归模型的回归系数,结果所示K1值回归系数分布于0.982~1.007,k2值回归系数分布于0.783~1.000,同参考标准拟合数据变化趋势均具有良好的一致性。其中当成像时间为17 min(37帧)时,K1值相较于k2值而言同参考标准的一致性更好(图3)。
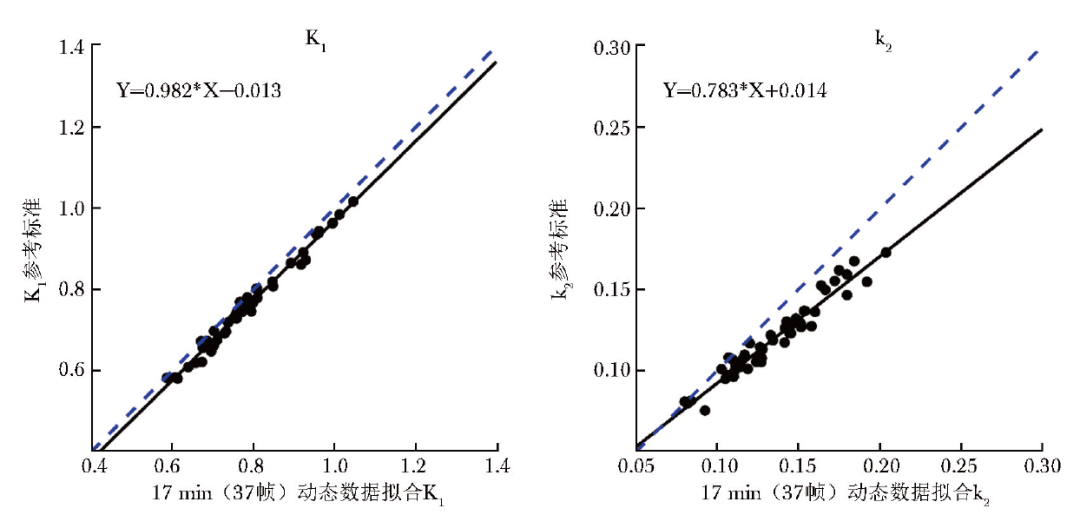
图3 17 min(37帧)成像时间图像数据计算的11C-AC药代动力学参数与参考标准的线性回归模型拟合结果
11C-AC:同图1
2.3 17 min(37帧)成像时间图像数据计算的11C-AC药代动力学参数与参考标准的差异
当图像成像时间为17 min(37帧)时,17个心肌节段的11C-AC药代动力学参数K1值、k2值与参考标准的差异性比较结果如图4所示,结果提示17 min(37帧)数据拟合的所有心肌节段的K1值、k2值相较于参考标准均偏高(P<0.001)。其中,第17节段K1值的RD均值最大(4.46%),第4节段K1值的RD均值最小(1.87%);第17节段k2值的RD均值最大(16.96%),第4节段k2值的RD均值最小(7.05%)。
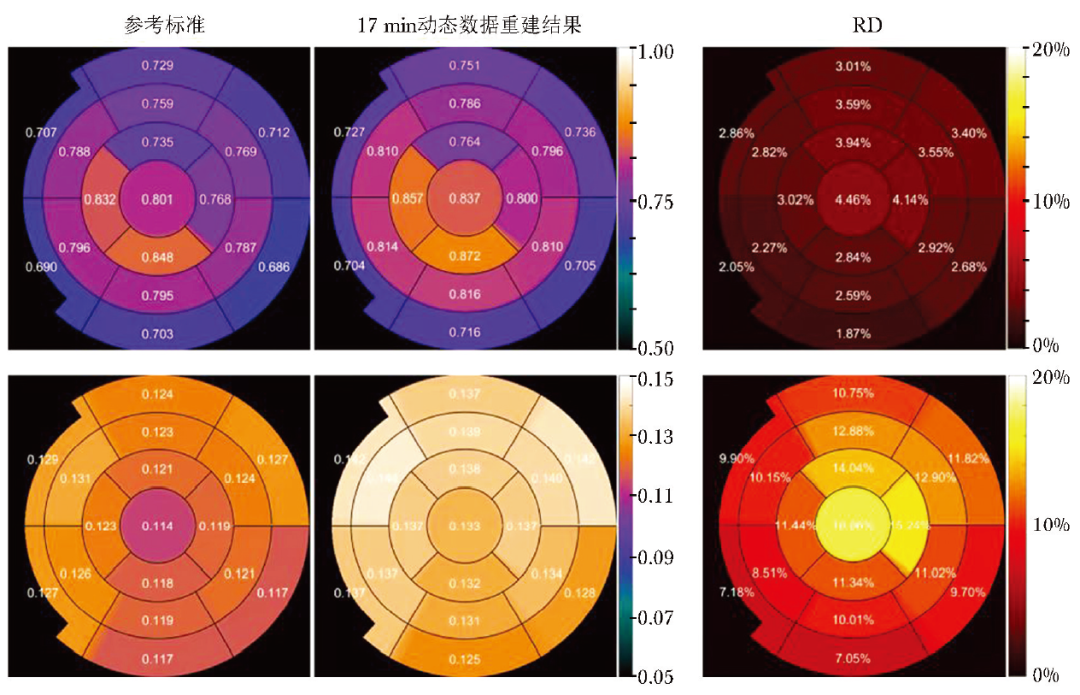
图4 17 min(37帧)成像时间图像数据拟合的17个心肌节段11C-AC药代动力学参数与参考标准的差异
RD:相对差异;11C-AC:同图1
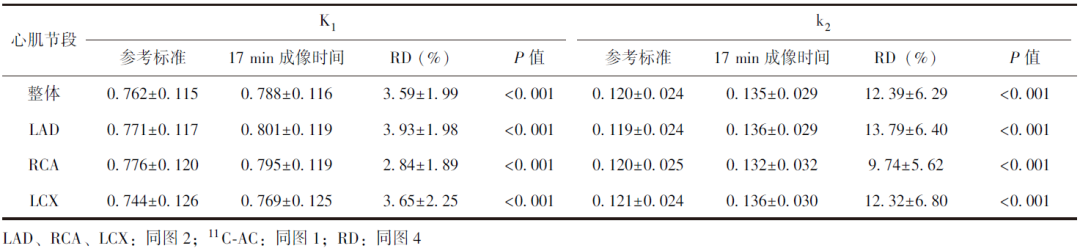
LAD、RCA、LCX灌注区域的11C-AC药代动力学参数K1值、k2值与参考标准均具有显著差异(表2)。其中RCA灌注区域K1值、k2值与参考标准之间的RD最小,LAD灌注区域K1值、k2值与参考标准的RD最大。
表2 17 min(37帧)成像时间图像数据拟合的不同区域11C-AC药代动力学参数与参考标准的差异
3 讨论
本研究基于11C-AC PET/CT心脏动态成像数据,探究了缩短成像时间对11C-AC单组织室模型药代动力学参数准确性的影响,结果表明利用17 min(37帧)成像时间图像数据计算得到的11C-AC药代动力学参数与参考标准(40 min标准成像时间)拟合数据在所有心肌节段中均具有良好的相关性和变化趋势一致性,提示在保证示踪剂药代动力学参数一致的前提下适当缩短成像时间具有可行性,以提升患者就诊体验、提高检查效率,并节约医疗资源。
相较于静态PET/CT成像,基于动态PET/CT成像数据计算得到的药代动力学参数可提供更多的附加信息,已被用于肿瘤诊断[13-14]、分期[15]、表征[16-17]、治疗监测[18],且具有更高的特异性[19],在临床疗效评价方面亦更具优势[20]。
但该检查所需时间较久,以11C-AC 心脏PET/CT检查为例,检查全程约需2~3 h,其中标准的图像采集时间约为40 min,在动态图像扫描过程中需患者保持固定的姿势,以致就诊体验差,尤其空间幽闭恐惧症患者,长时间处于狭小空间易产生恐慌,因此,在保障检查质量(示踪剂药代动力学参数一致)的基础上适当缩短图像采集时间具有必要性。
既往优化成像时间相关研究主要集中于18F-FDG PET/CT检查,且研究证实图像扫描时间缩短至30~40 min后,拟合的示踪剂药代动力学参数与50~75 min标准扫描时间对应数据相一致[6-10]。
本研究基于46名男性受试者的临床资料,探究了缩短心脏11C-AC PET/CT检查动态图像采集时间的可行性,结果显示成像时间为17 min时,计算的11C-AC药代动力学参数K1值、k2值与40 min标准时长的药代动力学参数高度相关(所有心肌节段的拟合优度评价指标R2均>0.9),线性回归模型的回归系数分别为0.982、0.783,提示成像时间降至17 min时仍可获得与参考标准(40 min)相一致的11C-AC药代动力学参数,为临床优化心脏11C-AC PET/CT检查图像采集时间提供了数据支撑。本研究结果与既往18F-FDG PET/CT相关文献报道的检查时长存在一定差异,可能与此两种示踪剂的代谢途径及半衰期不同有关。
基于线性回归模型的回归系数,本研究对缩短成像时间后计算的11C-AC药代动力学参数与参考标准变化趋势的一致性进行了评估,结果显示当成像时间≥17 min(37帧)时,K1值回归系数接近于1,提示缩短时间数据重建的动力学参数K1值同参考标准之间一致性良好。
此外,由图3可知17 min(37帧)图像数据计算的K1值与k2值均稍高于参考标准,可能会造成药代动力学参数被高估。进一步对缩短成像时间、标准时长两种方法获取的11C-AC药代动力学参数进行定量评估(图4),结果显示在17个心肌节段中,K1值与参考标准的差异较小(RD分布于1.87%~4.46%),而k2值与参考标准的差异较大(RD分布于7.05%~16.96%),此结果在针对LAD、RCA、LCX灌注区域的分析中得到了进一步验证(表2),可能原因:
(1)相较于K1值而言,k2值数据偏小,相同的差值下其RD更大;
(2)k2值受动态成像时间的影响更大,如图2所示,K1值在动态图像成像时间缩短至10 min(30帧)时仍与参考标准具有较强的相关性,而k2值与参考标准的相关性在成像时间减至17 min(37帧)时已出现明显下降。
11C-AC PET/CT成像常用于心肌氧摄取量及心肌效率的估计,由于缩短成像时间后计算的药代动力学参数同参考标准具有极强的一致性,在疗效评估或对照实验中均使用短时长成像协议一般不会对检查结果产生影响,但在不同成像协议下进行定量比较时,可能会出现K1值与k2值估计结果存在偏差的现象,特别是对于k2结果的估计。
如需获得与参考标准相一致的定量参数结果,可在缩短成像时间得到的示踪剂药代动力学参数与参考标准之间构建线性预测模型,从而对缩短成像时间拟合的相关参数进行修正,以保证在缩短扫描时长的同时实现准确的定量参数估计。
本研究局限性:(1)研究对象多数为饮酒男性个体,且未存在心脏11C-AC异常摄取;(2)仅针对心脏11C-AC PET/CT检查,其他脏器的成像时长需进一步研究。
综上所述,饮酒或健康的男性人群接受心脏11C-AC PET/CT成像检查时,缩短成像时间至17 min(37帧)可获得与标准时间相一致的示踪剂药代动力学参数,该结果在一定程度上可为优化此检查的成像时间提供参考。
参考文献
[1]Lindner O, Sorensen J, Vogt J, et al. Cardiac efficiency and oxygen consumption measured with 11C-acetate PET after long-term cardiac resynchronization therapy[J]. J Nucl Med, 2006, 47: 378-383.
[2]Sorensen J, Valind S, Andersson LG. Simultaneous quantification of myocardial perfusion, oxidative metabolism, cardiac efficiency and pump function at rest and during supine bicycle exercise using 11C-acetate PET - a pilot study[J]. Clin Physiol Funct Imaging, 2010, 30: 279-284.
[3]Liu S, Lin X, Shi X, et al. Myocardial tissue and metabolism characterization in men with alcohol consumption by cardiovascular magnetic resonance and 11C-acetate PET/CT[J]. J Cardiovasc Magn R, 2020, 22:23.
[4]Ukkonen H, Knuuti J, Katoh C, et al. Use of [11 C] acetate and [15 O] O2 PET for the assessment of myocardial oxygen utilization in patients with chronic myocardial infarction[J]. Eur J Nucl Med, 2001, 28: 334-339.
[5]Nesterov SV, Turta O, Han C, et al. 11C acetate has excellent reproducibility for quantification of myocardial oxidative metabolism[J]. Eur Heart J Cardiovasc Imaging, 2015, 16: 500-506.
[6]Torizuka T, Nobezawa S, Momiki S, et al. Short dynamic FDG-PET imaging protocol for patients with lung cancer[J]. Eur J Nucl Med, 2000, 27: 1538-1542.
[7]Visser EP, Kienhorst L, Geus-Oei L, et al. Shortened dynamic FDG-PET protocol to determine the glucose metabolic rate in non-small cell lung carcinoma[C]. 2008 IEEE Nuclear Science Symposium Conference Record. IEEE, 2008: 4455-4458.
[8]Monden T, Kudomi N, Sasakawa Y, et al. Shortening the duration of [18 F] FDG PET brain examination for diagnosis of brain glioma[J]. Mol Imaging Biol, 2011, 13: 754-758.
[9]Liu G, Yu H, Shi D, et al. Short-time total-body dynamic PET imaging performance in quantifying the kinetic metrics of 18F-FDG in healthy volunteers[J]. Eur J Nucl Med Mol Imaging, 2022, 49: 2493-2503.
[10]Samimi R, Kamali-Asl A, Geramifar P, et al. Short-duration dynamic FDG PET imaging: optimization and clinical application[J]. Phys Med, 2020, 80: 193-200.
[11]Cerqueira MD, Weissman NJ, Dilsizian V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: a statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association[J]. Circulation,2002, 105: 539-542.
[12]何升级,刘帅,张辉,等. 基于交替方向乘子法(ADMM)直接重建心脏11C-acetate PET动力学参数图[J]. 中国医学影像技术, 2022, 38: 758-763.
[13]Dimitrakopoulou-Strauss A, Strauss LG, Heichel T, et al. The role of quantitative (18)F-FDG PET studies for the differentiation of malignant and benign bone lesions[J]. J Nucl Med, 2002, 43: 510-518.
[14]Dimitrakopoulou-Strauss A, Strauss LG, Schwarzbach M, et al. Dynamic PET 18F-FDG studies in patients with primary and recurrent soft-tissue sarcomas: impact on diagnosis and correlation with grading[J]. J Nucl Med, 2001, 42: 713-720.
[15]Rusten E, Rodal J, Revheim ME, et al. Quantitative dynamic (18)FDG-PET and tracer kinetic analysis of soft tissue sarcomas[J]. Acta Oncol, 2013, 52: 1160-1167.
[16]Strauss LG, Dimitrakopoulou-Strauss A, Koczan D, et al. 18F-FDG kinetics and gene expression in giant cell tumors[J]. J Nucl Med, 2004, 45: 1528-1535.
[17]Dimitrakopoulou-Strauss A, Hohenberger P, Pan L, et al. Dynamic PET with FDG in patients with unresectable aggressive fibromatosis: regression-based parametric images and correlation to the FDG kinetics based on a 2-tissue compartment model[J]. Clin Nucl Med, 2012, 37: 943-948.
[18]Humbert O, Lasserre M, Bertaut A, et al. Breast cancer blood flow and metabolism on dual-acquisition (18)F-FDG PET: correlation with tumor phenotype and neoadjuvant chemotherapy response[J]. J Nucl Med, 2018, 59: 1035-1041.
[19]Ye Q, Wu J, Lu Y, et al. Improved discrimination between benign and malignant LDCT screening-detected lung nodules with dynamic over static 18F-FDG PET as a function of injected dose[J]. Phys Med Biol, 2018, 63: 175015.
[20]Nishiyama Y, Yamamoto Y, Monden T, et al. Diagnostic value of kinetic analysis using dynamic FDG PET in immunocompetent patients with primary CNS lymphoma[J]. Eur J Nucl Med Mol Imaging, 2007, 34: 78-86.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







