ADC连接子的研究前沿动态
2022-09-20 小药说药 小药说药
ADC的结构优化和机制扩展方面取得了许多进展。新的可切割连接子已经被开发出来,以获得对肿瘤的更高选择性。尤其新型光响应可切割连接子和生物正交可切割连接子可以打破传统ADC的细胞内药物释放限制。
前言
由于有效载荷、连接子和偶联方法的改进,抗体偶联药物(ADC)的发展在过去十年中取得了显著进展。特别是,连接子设计在调节ADC在体循环中的稳定性和肿瘤中的有效载荷释放效率方面起着关键作用,从而影响ADC的药代动力学(PK)、疗效和毒性特征。
一些关键的连接子参数,如偶联化学、连接子长度和连接子空间位阻都会对ADC药物的PK和功效产生影响。理想的连接子应在循环系统中保持稳定,并在肿瘤中释放细胞毒性有效载荷。然而,现有的连接子通常会非特定地释放有效载荷,并不可避免地导致脱靶毒性。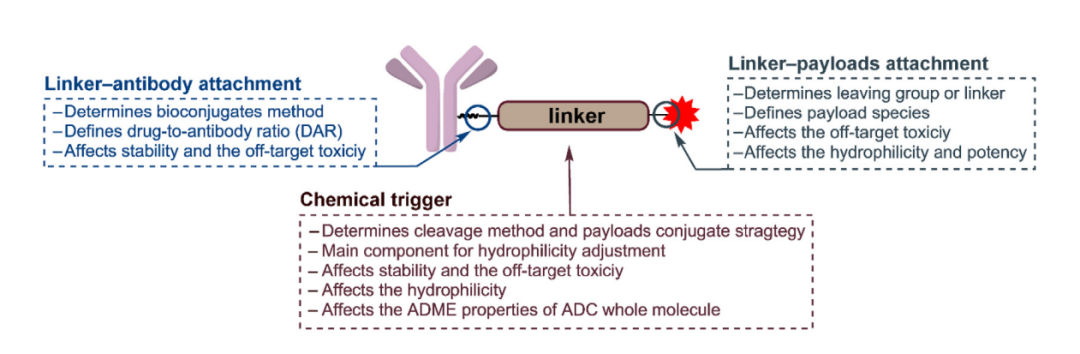
因此,在ADC药物的设计中,正确调整连接子的这些重要参数,从而实现ADC稳定性和有效载荷释放效率之间的平衡,才能达到ADC药物预期的效果。在过去几年中,人们开发了许多新的连接子,包括组织蛋白酶可切割连接子、酸可切割连接子、GSH可切割连接子、Fe(II)可切割连接子、新型酶可切割连接子、光响应可切割连接子和生物正交可切割连接子。其中,组织蛋白酶、GSH和酸可切割连接子已被充分研究并应用于经批准的ADC中。连接子设计取得了许多重要进展,这些工作将有助于指明连接子未来的发展方向。
组织蛋白酶可切割连接子
2017年,Caculitan等人发现缬氨酸瓜氨酸(Val-Cit)连接子对多种组织蛋白酶表现出广泛的敏感性,包括组织蛋白酶B、组织蛋白酶K、组织蛋白酶L等。为了提高选择性,Wei等人设计了一种使用环丁烷-1,1-二甲酰胺(cBu)结构的连接子,该结构主要依赖于组织蛋白酶B。
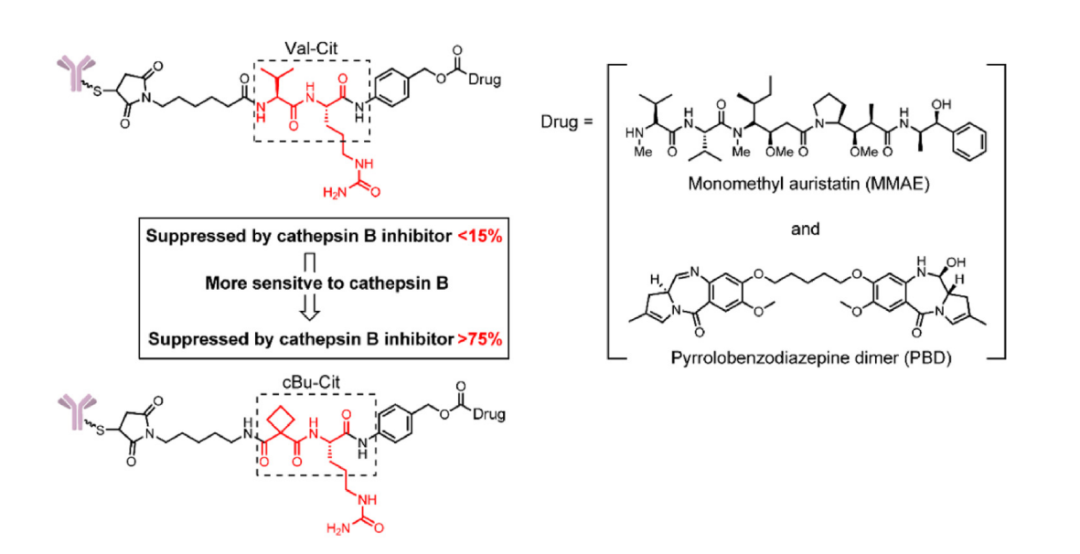
在细胞内,组织蛋白酶B抑制剂能够有效地抑制(超过75%)含cBu-Cit连接子的药物释放,而组织蛋白酶K抑制剂没有显著的效果。相反,传统的含Val-Cit的连接子似乎对所有单一蛋白酶抑制剂耐受(组织蛋白酶B、L和K的抑制剂均小于15%)。同时,与含有Val-Cit连接子的ADC相比,含有cBu-Cit连接子的ADC在体外表现出更大的肿瘤抑制作用。
此外,肽连接子的优化不仅限于开发新的结构,肽连接子可以通过最小的结构变化进行优化,如氨基酸的类型和结构化学。一些研究将Val-Cit和Val-Ala二肽结构与MMAE的有效载荷连接进行了比较。在非内化抗体的情况下,结合到工程化半胱氨酸的Val-Cit和Val-Ala连接子都表现出类似的特征,并且比Val-Lys和Val-Arg类似物表现出更好的性能。在使用随机半胱氨酸结合的抗Her2 ADC的情况下,与Val-Cit相比,Val-Ala在高DAR结构中显示出较少的聚集性。另一方面,两种连接子显示出相似的缓冲稳定性、组织蛋白酶B释放效率、细胞活性和组织病理学特征。
四肽Gly-Gly-Phe-Gly显示出稳定和有效的可切割连接子的所有特性,已上市的ADC药物Enhertu使用了此类连接子。第一三共的Enhertu是一种血浆稳定的ADC,DAR为7.7,在溶酶体中发生蛋白酶降解,释放DX-8951f,这是一种有效的拓扑异构酶I抑制剂,来源于exatecan。由于连接子不含增溶剂,达到如此高的DAR是非常可观的,因为它与广泛确立的原理相矛盾,即高DAR结合物可能具有较差的药代动力学特征。这里使用的自降解间隔子是简单和紧凑的半胺化,而不是Val-Cit连接子使用的PABC。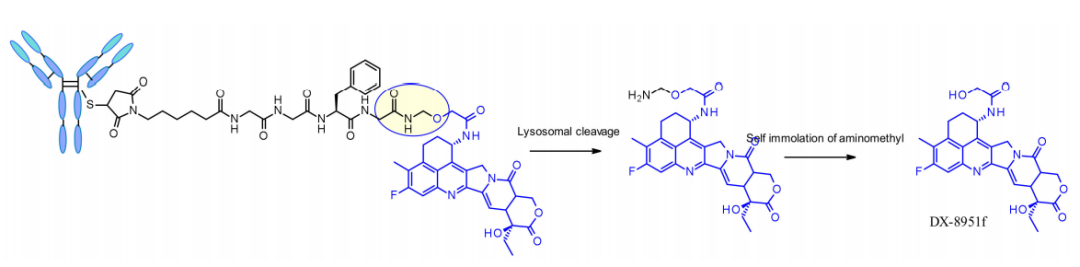
酸可切割连接子
酸切割连接子利用肿瘤组织(4.0–5.0)和血浆之间的pH差(∼7.4)选择性地向肿瘤组织释放有效载荷。这种策略在Mylotarg获得了最早的临床成功,后来也在Besponsa中得到应用。然而,酸切割连接子的稳定性不足严重限制了其在ADC中的应用,苯酮衍生的腙连接子在人和小鼠血浆中以2天的半衰期水解,Sacituzumab-govitecan(Trodelvy)的血清稳定性也不令人满意,其半衰期为36小时。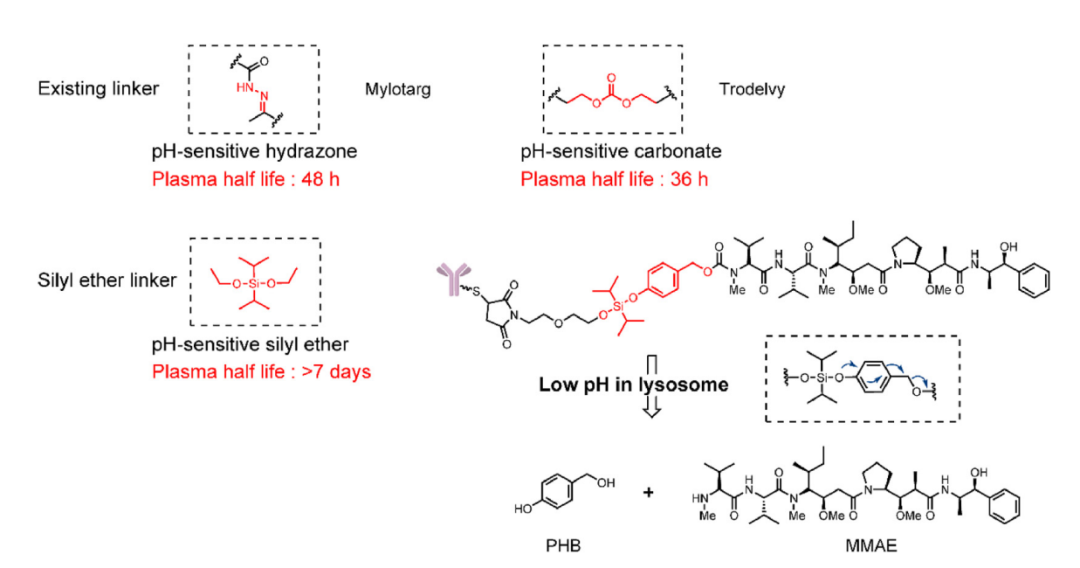
因此,酸裂解ADC需要更稳定的连接子,或者只能使用中度细胞毒性的有效载荷。2019年,一种新型的硅醚基酸裂解ADC被开发出来,携带高细胞毒性的单甲基auristatin E(MMAE)。这种设计极大地提高了酸裂解连接子的稳定性,此外,这种使用新型硅醚连接子的ADC在人血浆中的半衰期超过7天,并且在小鼠异种移植模型中显示出良好的治疗效果。
GSH可切割连接子
与血浆(∼5μmol/L)中相比,GSH切割的连接子依赖于细胞质中较高水平的谷胱甘肽(1–10 mmol/L)。二硫键在这些连接子中最常用,然而,目前的二硫键结构无法实现高循环稳定性和高效细胞内释放的完美结合。
2017年,Thomas等人试图通过将小分子药物直接连接到硫单抗中的工程化半胱氨酸来解决这个问题。通过直接连接抗体,抗体的空间保护将提高循环稳定性。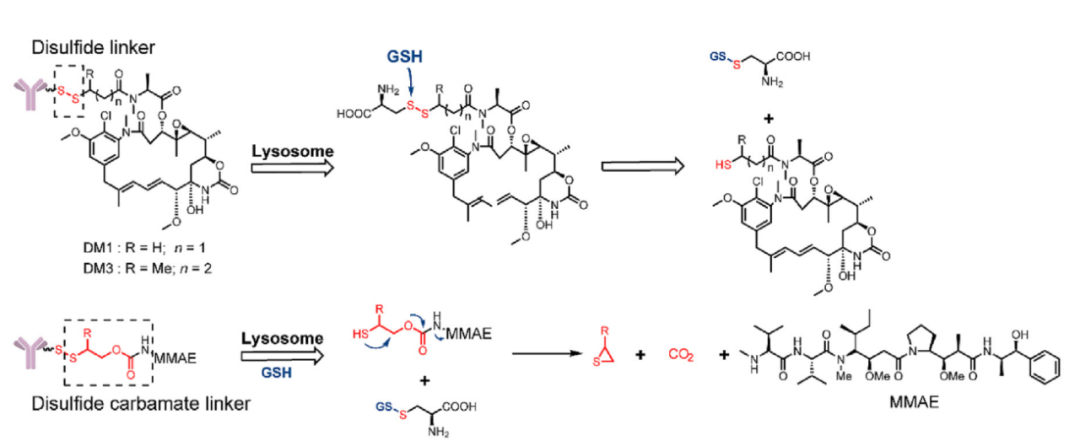
体内稳定性研究表明,当DM1通过二硫键连接到单抗的K149C上时,超过50%的药物即使在七天后仍保持连接。体内药效研究表明,在人类淋巴瘤-肿瘤异种移植小鼠模型中,这种新型抗CD22-DM1-ADC可诱导肿瘤消退。

同年,这种新策略被用于PBD作为有效载荷的ADC。与马来酰亚胺肽(Val-Cit)-PBD-ADC相比,在人类非霍奇金淋巴瘤异种移植小鼠模型中,新型二硫键的ADC表现出类似的活性。同时,这种新型二硫键ADC的MTD高于Val-Cit ADC(10 vs2.5 mg/kg)。
Fe(II)可切割连接子
铁代谢异常可提高游离亚铁的水平,基于这一策略,增加未结合的亚铁浓度已用于前药设计。2018年,Spangler等人报告了一种Fe(II)反应性1,2,4-三氧烷骨架的(TRX)连接子,并将这种连接子用于ADC。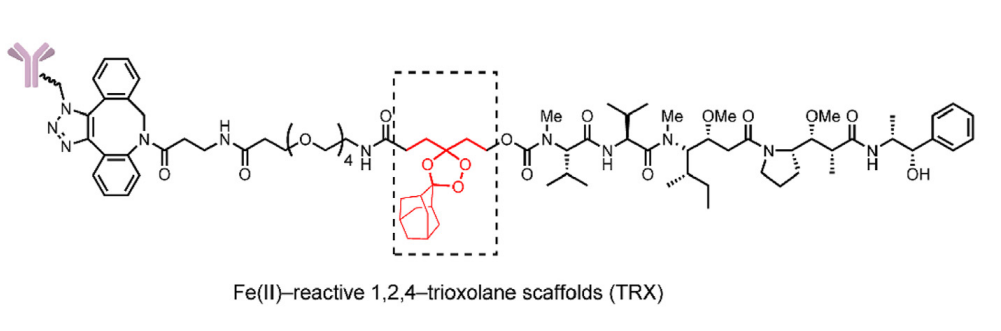
通过TRX和Fe(II)的O–O键之间的Fenton反应裂解连接子,提供羰基中间体并通过β-消除释放有效载荷。
在体外细胞毒性研究中,含有TRX连接子的ADC在抗原阳性细胞中的活性与含有Val-Cit连接子的经典ADC相似。然而,在抗原阴性的MDA-MB-468细胞系中,含有TRX连接子的ADC仍然显示出显著的毒性。这种不稳定性是由金刚烷部分和抗体上附近位点之间的非特异性相互作用引起的。
新型的酶可切割连接子
与组织蛋白酶一样,焦磷酸酶和磷酸酶也是在溶酶体中选择性表达的水解酶。2016年,默克公司的研究人员设计了含有磷酸和焦磷酸的连接子与组织蛋白酶B敏感的Val-Cit-PABA搭配,旨在传递糖皮质激素。这种亲水性和永久性带电基团的优点是溶解性,不仅能够与亲脂性糖皮质激素衍生物进行生物偶联,而且促进ADC纯化, ADC中的残余连接子少于0.10%。含有磷酸和焦磷酸的ADC在体外都具有活性。
默克公司的同一组研究人员还开发了一种独特的基于焦磷酸酶的连接子,用于释放含羟基有效载荷地塞米松和丙酸氟替卡松。
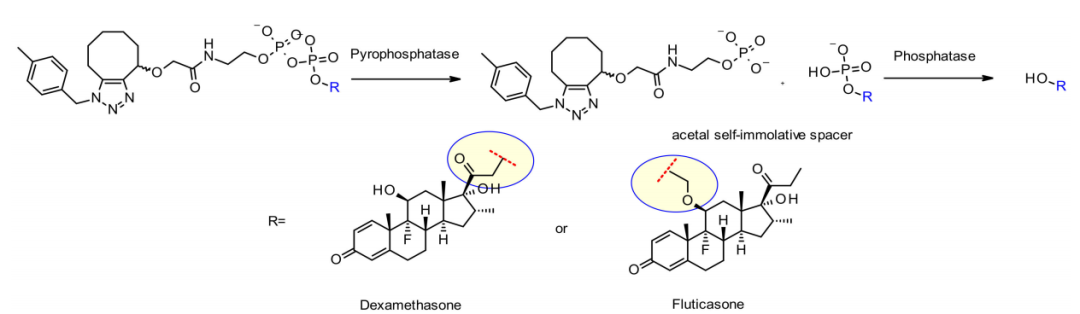
两种ADC在体外均表现出良好的稳定性,对肿瘤细胞系具有较强的活性。
除了2006年为ADC开发的经典β-葡萄糖醛酸酶可切割连接子外,还发现β-半乳糖苷酶在肿瘤细胞中过度表达并具有水解活性。最近报道了一种使用β-半乳糖苷酶裂解连接子的ADC,其中包含PEG10间隔子。间隔子被硝基取代,以提高自降解速率。类比β-葡萄糖醛酸酶连接子,其解离机制涉及水解β-半乳糖苷酶部分,它赋予化学前体亲水性。另一个优势是β-半乳糖苷酶仅存在于溶酶体中,而β-葡萄糖醛酸酶在溶酶体中表达,也在实体瘤的微环境中表达。研究证明,在抗HER2-ADCs释放MMAE的背景下,含β-半乳糖苷酶连接子的 ADC在体外和体内均比T-DM1更为有效。
最近,还出现了硫酸酯酶裂解的连接子,硫酸酯酶在几种癌症类型中过度表达,表现出潜在的选择性。研究涉及以MMAE为有效载荷的抗Her2抗体,与经典的可切割Val-Cit和Val-Ala连接子相比,硫酸酯酶连接子对Her2+细胞系显示出相似的效力。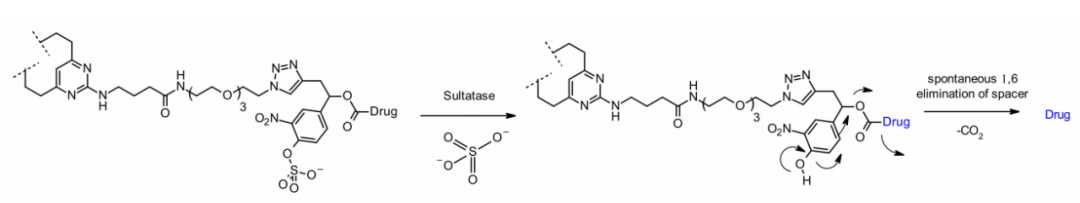
光响应可切割连接子
近年来,基于光响应切割的有效载荷释放策略逐渐出现。光响应可切割具有以下优点,包括低毒性、快速反应、高灵敏度和特异性。
2015年,Nani等人首次对ADC采用近红外(NIR)光照锁定策略。光响应切割基于七甲川菁荧光团骨架。在用NIR光(λ=650–900nm)照射后,ADC以位点特异性方式在受照肿瘤区域有效释放小分子细胞毒素CA-4。

在体外细胞毒性实验中,含有NIR光裂解连接子的ADC在EGFR+细胞系中经辐射后表现出相当于CA-4的活性,而未经辐射时表现出低活性。然而,这种连接子的自聚集和光不稳定特性限制了其作为药物的进一步开发应用。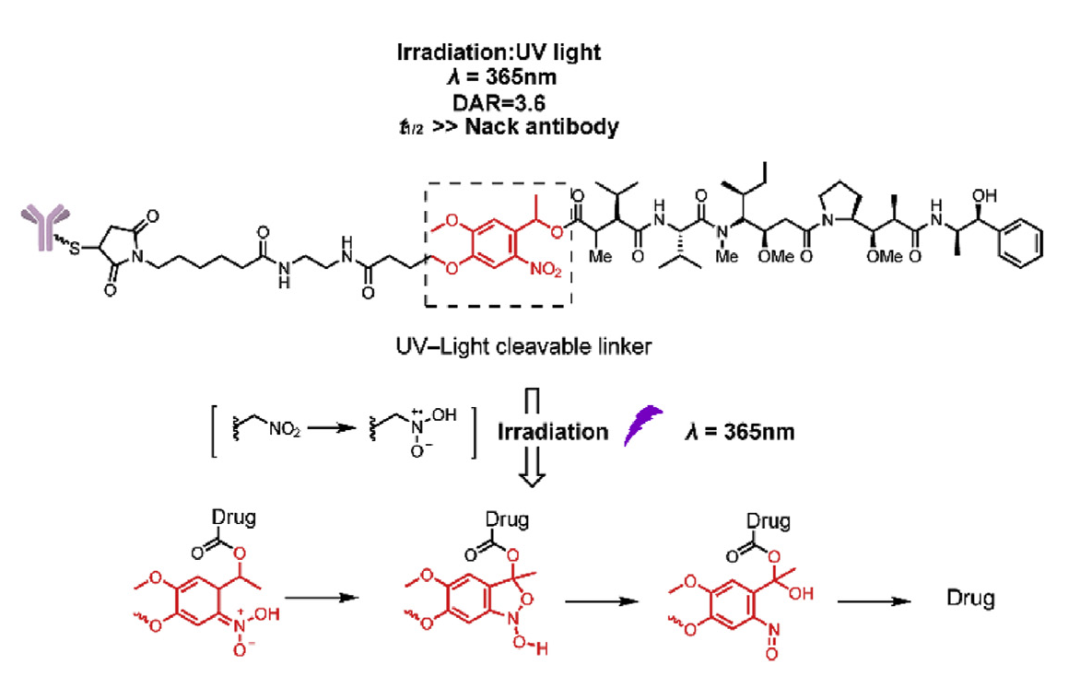
最近,有研究报告了一种新型的紫外(UV)光控ADC。连接子引入了紫外光控制的邻硝基苄基作为切割触发。在稳定性和释放研究中,这种含有MMAE的连接子在自然光下6天内释放<1%,在辐照后10分钟内显示MMAE的快速释放,并达到最高平台。在体外细胞毒性实验中,用365nm(40W)紫外光照射后,含有邻硝基苄基连接子的ADC的活性显著增加,比未经照射的ADC高50倍。
2019年,报道了一种光响应、自断裂的连接子,使用光笼C40氧化碱性位点(PC4AP)。与前面提到的两个ADC相比,这种连接子在设计上具有“双重保险”。在365 nm辐射下,PC4AP的羟基与其自身抗体上附近的胺发生分子内加成反应,随后的消除反应导致裂解和有效载荷释放。含有肽-PC4AP-DOX的ADC在阳性细胞中显示出与有效载荷DOX相当的毒性,并且在没有辐射的情况下没有细胞毒性。
生物正交可切割连接子
生物正交化学具有选择性高、加工快速简便、副产物无毒等特点。2019年,Wang等人开发了一种生物正交可切割连接子,该连接器使用了经典的生物正交切割对Cu(I)-BTTAA和dsProc。
然而,生物正交可切割连接子目前主要集中在体外探索上。在反应效率、反应速率、底物稳定性、生物相容性和操作方便性方面仍存在问题,离临床应用还很远。
小结
在过去的几年里,ADC的结构优化和机制扩展方面取得了许多进展。新的可切割连接子已经被开发出来,以获得对肿瘤的更高选择性。尤其新型光响应可切割连接子和生物正交可切割连接子可以打破传统ADC的细胞内药物释放限制。这些新型连接子的初步数据令人鼓舞,未来将极大地促进ADC药物的迅猛发展。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






