南方医科大学发现胃癌细胞缺氧耐受新机制
2023-06-27 转化医学网 转化医学网 发表于上海
长期以来,抗血管生成治疗一直被认为是实体瘤治疗的有效策略。对缺氧的内在耐药性是抗血管生成治疗失败的主要原因,但尚不清楚其潜在机制。
近日,南方医科大学李国新、Ye Gengtai及Li Fengping共同在《Advanced Science》期刊上发表题为“N4-Acetylcytidine Drives Glycolysis Addiction in Gastric Cancer via NAT10/SEPT9/HIF-1α Positive Feedback Loop”的研究论文,该研究新发现了一种mRNA修饰物——N4-乙酰胞苷(ac4C),通过诱导过度糖酵解来增强胃癌(GC)细胞的缺氧耐受性。具体而言,乙酰转移酶NAT10的转录受缺氧诱导因子-1α(HIF-1α)的调控,缺氧诱导因子是细胞对缺氧反应的关键转录因子。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202300898
研究背景
长期以来,抗血管生成疗法一直被认为是治疗实体癌的一种很有前途的策略。对缺氧的内在抵抗是抗血管生成治疗失败的主要原因,但其潜在机制尚不清楚。本研究发现,n4 -乙酰胞苷(ac4C)是一种新发现的mRNA修饰,通过促进糖酵解成瘾来增强胃癌细胞的缺氧耐受性。具体来说,乙酰转移酶NAT10的转录受HIF-1α的调控,HIF-1α是细胞对缺氧反应的关键转录因子。此外,Acrip测序、核糖体分析测序、RNA测序和功能研究证实,NAT10反过来通过介导SEPT9 mRNA ac4C修饰激活HIF-1通路和随后的糖代谢重编程。NAT10/SEPT9/HIF-1α正反馈回路的形成导致HIF-1通路过度激活,诱导糖酵解成瘾。联合抗血管生成和ac4C抑制可减弱体内缺氧耐受性,抑制肿瘤进展。本研究强调了ac4C在糖酵解成瘾调节中的关键作用,并提出了通过阿帕替尼联合ac4C抑制来克服抗血管生成治疗耐药的有希望的策略。
尽管十年来胃癌(GC)研究的进展显著改善了手术实践和综合胃癌治疗方案,但到2020年,胃癌仍然是全球第五大最常诊断的癌症和第四大癌症相关死亡原因。抗血管生成治疗(例如,贝伐单抗,阿帕替尼)是各种肿瘤的公认治疗方法,包括晚期胃癌,可改善无进展生存期(PFS)和总生存期(OS)。然而,抗血管生成治疗也会引起肿瘤内的严重缺氧。在低氧微环境下,肿瘤细胞进行糖代谢重编程,以快速生成大量ATP,以维持细胞存活和增生生长,这通常限制了抗血管生成治疗的效果。因此,有必要揭示代谢重编程的机制,并确定治疗靶点,以破坏肿瘤细胞的缺氧耐受性。
研究过程
几乎所有的人类癌症都会发生表观基因组的改变。肿瘤细胞中独特和可逆的表观遗传状态可能促进转移,导致耐药或预测患者预后。作为近年来表观遗传学领域的一个热点,对mRNA ac4C修饰生物学功能的研究层出不穷。与以往研究一致,研究人员还发现乙酰转移酶NAT10在胃癌中表达上调,并与胃癌患者预后不良呈正相关。更重要的是,研究人员发现ac4C修饰通过增强GC细胞的缺氧耐受性来促进抗血管生成治疗的抗性。研究人员发现HIF-1α与NAT10启动子上的HRE相互作用,导致缺氧时NAT10转录更活跃。由于缺氧是实体肿瘤的共同特征,HIF-1α与NAT10的相关性可能为多种肿瘤组织中NAT10的大量富集提供了明确的解释。
研究表明,在结直肠癌患者的肿瘤组织和血浆中检测到SEPT9启动子区域的高甲基化,这被认为是一种敏感和特异性的生物标志物,可用于无创结直肠癌筛查。因此,SEPT9曾被认为是一种肿瘤抑制因子。然而,泛癌分析显示,SEPT9在食管癌、胃癌和肝癌中的表达增加。crip -seq和Ribo-seq联合分析证实,mRNA ac4C修饰导致了GC中SEPT9的过表达。如既往研究所述,SEPT9还具有致癌基因的功能。此外,SEPT9通过阻止HIF-1α和RACK1之间的相互作用来保护HIF-1α免受降解,并诱导前列腺癌血管生成。在本研究中,研究人员通过分子对接分析和Co-IP检测了SEPT9与HIF-1α的相互作用,但观察到,当干扰NAT10或SEPT9的表达时,细胞核中HIF-1α的积累减少,而不是HIF-1α总蛋白水平下降。这表明在GC细胞中,SEPT9作为载体促进HIF-1α易位进入细胞核。不同的肿瘤背景可能导致SEPT9的功能差异。在这里,研究人员证明了SEPT9与HIF-1α的相互作用是ac4C调节的葡萄糖代谢转移的重要过程。
阿帕替尼,已被证明具有显著的治疗效果,是cFDA批准用于治疗难治性GC的第一个抗血管生成药物。作为血管生成抑制剂,阿帕替尼加重肿瘤组织缺氧,导致肿瘤细胞过度依赖糖酵解来应对增加的代谢和生存应激。与研究结果一致,NAT10/SEPT9/HIF-1α正反馈回路调节糖酵解成瘾。此外,研究人员发现在shNAT10 GC细胞中,负责血管生成的重要HIF-1靶基因VEGFA下调。这些结果表明,抑制ac4C可能会阻碍GC中葡萄糖代谢的重编程,同时抑制血管生成,从而增强阿帕替尼的抗肿瘤作用。同时,靶向mRNA修饰酶的抑制剂已成功应用于急性髓性白血病(AML)的治疗,被认为是一种有前景的抗癌治疗新途径。
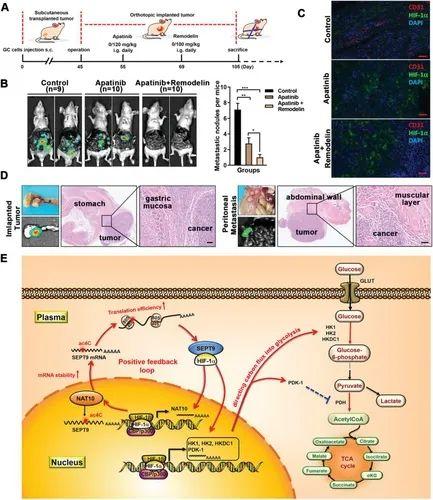
ac4C抑制联合阿帕替尼抗肿瘤效果最佳
研究意义
总之,本研究揭示了mRAN ac4C修饰与抗血管生成治疗耐药性之间的相关性,以及GC中NAT10过表达的新机制。此外,研究人员强调了NAT10/SEPT9/HIF-1α正反馈回路在糖酵解成瘾调节中的关键作用,并提供了令人信服的体外和体内证据,表明靶向mRNA ac4C修饰可能是一种有希望的GC治疗策略。
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202300898
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








