急性冠脉综合征病理生理学机制再评价
2022-10-31 中国医学论坛报今日循环 中国医学论坛报今日循环
急性冠脉综合症传统发病理论遭挑战,从病理生理学机制进行再评价。
急性冠脉综合征是一种常见的严重的心血管疾病,发病率在我国逐年增加。今天我们就请上海交通大学附属胸科医院心内科的沈玲红教授,带领我们从病理生理学机制上对急性冠脉综合征进行再探索。
从20世纪初期,心电图就开始用于临床诊断心肌梗死,100年来我们一直根据这一技术提供的信息对急性心肌梗塞进行诊断和分类:从病理性Q波是否出现,到ST段抬高存在与否。
一般认为,心电图表现为ST段抬高的急性心肌梗死,在病理上是由于包含大的脂质核心的易损斑块破裂,导致血栓形成完全阻塞血管而造成的。并且绝大多数情况下,不同程度的斑块破裂诱发形成不同类型(如红色血栓、白色血栓、混合血栓)和大小的血栓,是引起急性冠脉综合征(ACS)的主要病理机制。
进入21世纪以来,随着冠脉腔内影像学技术的不断进步,我们开始从临床、病理、细胞和分子水平多方位认识ACS的病理生理机制。
越来越多的证据表明,仅仅关注斑块破裂过度简化了复杂的疾病进展过程,掩盖了可能要求不同临床处理方案的其他机制。
ACS发病机制经典理论受到挑战
经典理论认为,ACS的发生是由于脆弱的易损斑块发生破裂引起红色或白色血栓。这类斑块在病理上通常具有大的中心脂质核心,内皮下大量炎症细胞浸润,平滑肌细胞缺乏以及纤维帽较薄的特点。炎性机制引起的胶原蛋白降解,导致纤维帽变薄,是斑块破裂的直接原因。
事实上,人类冠状动脉的病理学研究显示,斑块破裂更常见于没有症状的ACS患者[1]。经血管内超声的反向散射超声射频信号证实的薄帽纤维粥样斑块(TCFA)中,仅有不到5%在3年以上的随访期间发生临床事件,大多数所谓的TCFA实际上相当稳定。
血管内超声随访观察还发现,TCFA通常在1年内转变为明显更稳定的形态特征(可能是病变的自然发展过程,也可能由于患者坚持了正确的生活行为方式和药物治疗)[2]。
最近的光学相干断层扫描(OCT)也研究发现,只有不到一半的ACS患者有斑块破裂证据,1/3的ACS是由斑块侵蚀引起的,1/5的ACS甚至缺乏冠脉血栓证据[3]。由此可见,斑块破裂作为ACS的主要机制的地位已经受到挑战和质疑。
其次,我们已经广泛接受的概念是炎症反应促进了动脉粥样硬化的形成,同时也是诱发ACS最重要的直接因素。但事实上,炎症不是促使稳定的动脉粥样硬化转变为急性血栓形成事件的唯一因素。41%的急性ST段抬高型心肌梗死(STEMI)患者血浆C-反应蛋白(CRP)在正常水平[4]。OCT研究发现,1/3的ACS伴斑块破裂患者局部缺乏炎症细胞浸润,其中超过半数血浆CRP无明显升高[5]。
上述这些证据促使我们重新认识ACS的病理生理机制,以制定针对性治疗策略。
基于炎症指标和影像学的新分型法
PeterLibby最近在Circulation杂志撰文,提出根据已知的病理机制可以将ACS分为4种类型:斑块破裂伴全身性炎症,斑块破裂但无全身性炎症,斑块侵蚀和无血栓病变[6]。(图1)
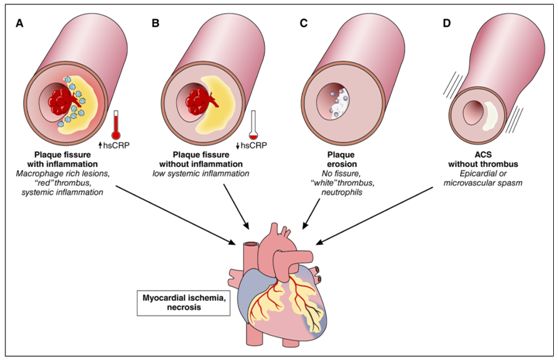
图1. 引起急性冠脉综合征的四种不同机制
1. 斑块破裂伴全身性炎症类型
斑块破裂与局部炎症和全身性炎症(表现为血浆hsCRP升高)相关联,炎症机制是纤维帽脆性和潜在脂质核心血栓形成的关键调节因子。
巨噬细胞激活,分泌基质金属蛋白酶和某些组织蛋白酶,降解细胞外基质,是纤维帽变薄的主要原因。
适应性免疫途径的不平衡也参与斑块的不稳定性,表现为斑块中T细胞活性不平衡,局部维持细胞稳态的适应性免疫应答受到破坏。
针对性策略主要包括对抗炎和免疫抑制治疗方法的尝试,如历史悠久的抗炎药物秋水仙碱,靶向促炎性细胞因子IL-1,针对T细胞激活信号的免疫抑制剂或增强Treg的活性。
其中,抗IL-1β单克隆抗体卡那单抗(canakinumab)最近在一项大样本(n> 10,000)III期临床试验中被证实,在既往有心肌梗死和CRP水平>2 mg/L的患者中,能够使心肌梗死、卒中或死亡的主要终点事件降低15%,包括紧急血运重建在内的次要终点事件下降17%[7]。
这项研究不仅是ACS抗炎治疗领域的突破,同时也进一步验证了炎症与动脉粥样硬化事件之间的因果关系。
2. 斑块破裂但无全身性炎症类型
当斑块破裂发生在没有全身性炎症激活的情况下,其他机制也可能导致发病,包括极端情绪障碍,长期情绪失调的急性加重,剧烈运动和动脉壁水平的局部机械应力改变都可能导致斑块破裂。
病变局部微环境的亚临床炎症可能参与导致冠状动脉不稳定的事件链,但这种局部炎症的诱因和效应因子可能不同于全身炎症患者的作用因子[8]。酯化和游离胆固醇平衡的局部变化可能促使斑块破裂[9]。斑块内的微小钙化也可能引起生物力学不均匀性,导致斑块不稳定[10]。
在治疗策略上,主要通过强化降脂治疗来改变斑块特征,特别是他汀类药物和依折麦布,可能干扰胆固醇结晶的形成。
3. 斑块侵蚀类型
斑块侵蚀常见于高甘油三酯血症、糖尿病、女性和老年患者,通常引起非ST段抬高型心肌梗死。
不同于巨噬细胞介导的炎症,嗜中性粒细胞活化在斑块侵蚀导致的血栓形成中起关键作用。斑块侵蚀与斑块破裂所导致的血栓形成的病变特征也截然不同。斑块侵蚀的血栓通常呈现白色富血小板结构的特征。斑块侵蚀的病变仅包含少量的巨噬细胞或T淋巴细胞,但富含蛋白多糖和糖胺聚糖而不是消除的胶原,有丰富的动脉平滑肌细胞,纤维性病变多,缺乏突出的脂质核心[11,12]。
着重于降低富含甘油三酯的脂蛋白的疗法可能更适合于这类ACS患者。对OCT诊断为斑块侵蚀的患者,强化抗栓治疗,而非机械血运重建,可能是更适合的治疗策略。
4. 无血栓的ACS类型
发病机制上主要与冠脉循环的功能改变有关,可能引起涉及大的心外膜冠状动脉或冠脉微循环的急性缺血。
心外膜冠状动脉血管痉挛可能发生于冠状动脉造影未显示梗阻性动脉粥样硬化斑块的患者,也可能发生在阻塞性动脉粥样硬化血管基础上。
微血管痉挛引起的心肌缺血通常在无阻塞性动脉粥样硬化的情况下发生(如应激性心肌病),仅约15%的患者伴有梗阻性动脉粥样硬化[13]。
心外膜大血管或微血管痉挛可能由血管舒张受损或血管收缩刺激作用于高反应性血管平滑肌细胞(SMC)导致[14]。Rho激酶活性增加是SMC高反应性的主要机制之一[15]。
目前治疗心外膜痉挛使用非特异性血管扩张剂,如长效硝酸酯类和钙通道阻滞剂。对非特异性血管扩张剂治疗反应不佳的患者可以选择Rho激酶抑制剂法舒地尔[16]。
展望
新的ACS分型方法为为临床制定个性化的精确治疗策略打开了窗口。事实上,对每一个ACS患者而言,可能不是单一的机制在起作用,可能存在上述2种以上机制同时致病。
或许,在不远的将来,我们还会发现新的导致ACS的重要机制。但无论如何,不再单纯依靠心电图和心肌损伤标志物提供的信息,从血管病理生理变化的角度认识ACS的发病机制,为患者制定更加个性化和精确的治疗策略,将成为未来的发展趋势。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






