新版日本《胃癌处理规约》解读
2012-06-26 韩方海 詹文华 MedSci原创
日本从1962年开始制定和出版了第1版《胃癌临床和病理处理规约》,经过多次修订,到目前已出版了第14版《胃癌处理规约》。可以说,《胃癌处理规约》[以下简称《规约》]反映了日本胃癌诊疗发展的历史,是日本各个时期胃癌诊治的“金标准”。第13版和第14版《胃癌处理规约》的出版时间间隔10年,在这10年间,胃癌的病理学和临床研究均有了显著的进步。2001年3月,日本制定了《胃癌治疗指南》 [以下简称《
 |
 |
 |
 |
 |

日本从1962年开始制定和出版了第1版《胃癌临床和病理处理规约》,经过多次修订,到目前已出版了第14版《胃癌处理规约》。可以说,《胃癌处理规约》[以下简称《规约》]反映了日本胃癌诊疗发展的历史,是日本各个时期胃癌诊治的“金标准”。第13版和第14版《胃癌处理规约》的出版时间间隔10年,在这10年间,胃癌的病理学和临床研究均有了显著的进步。2001年3月,日本制定了《胃癌治疗指南》 [以下简称《指南》]。从此,《规约》和《指南》有了明确分工,《规约》主要是正确记载胃癌术前和术后的情况,与临床决策有关;《指南》主要是规范胃癌治疗。
为了便于国际交流和国际标准化的需要,日本出版了英文版《规约》和《指南》,采用了与国际抗癌联盟(UICC)相同的TNM分期,关于化疗和放疗的评价标准,在RECIST基础上,增加了胃原发病灶为非目标病灶的评价。新版《规约》具体修改要点如下。
记载法的原则
把原来的术前临床、术中所见、术后病理及综合所见简化为临床分类和病理分类。关于T、N、M,记载认为诊断确实的分类,不采用存在疑问的情况,如CT检查示淋巴结不能诊断为转移,即为N0。
第13版《规约》将所见(findings)区分为临床、手术、病理、综合,新版采用了通用的TNM分类,记载为分类(classification),根据治疗前获得的信息决定临床分类,联合手术获得的病理组织学信息决定病理分类。代表病例综合所见一词不再使用,记载临床分类和病理分类两者。
随着新抗癌药物的研发,新辅助化疗的疗效提高,切除标本的组织学所见未必能正确表示其肿瘤原来的进展度。本版TNM分类的接头词采用y,以区别术前治疗后的临床、病理学分类。
肿瘤的进展度
1.原发病灶的记载
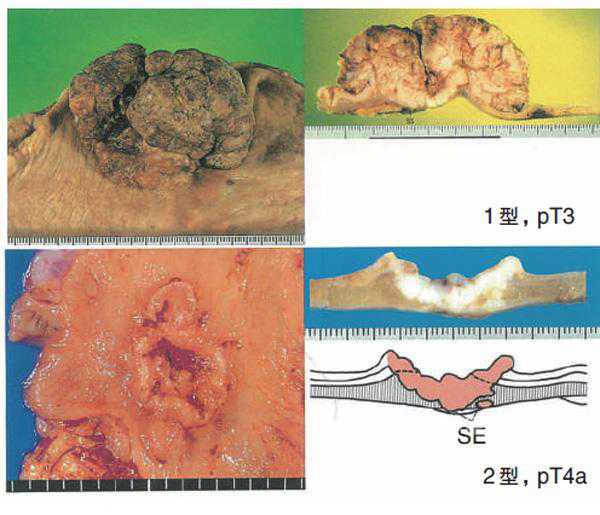
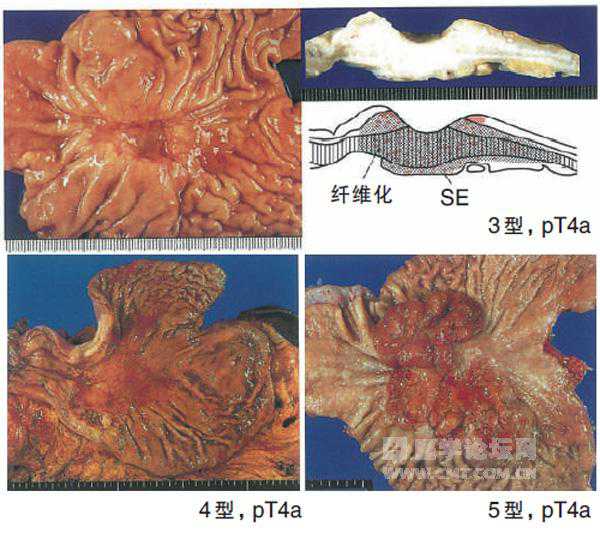
肉眼类型分类
![]()
(1)基本分类
肿瘤浸润深度达黏膜下层时,多数所见的肉眼形态为浅表型,累及到固有肌层时,多半显示的肉眼形态为进展型。从黏膜面观察胃癌,将其形态分为0至5型,0型用于早期胃癌的肉眼形态分类,可进行亚分类。该肉眼分类与浸润深度的判断没有关系,不必同时记载浸润深度(临床分类的推测)。对于接受过新辅助放化疗的病例,在接头词前加y。
0型浅表型:癌组织浸润至黏膜下层时多数可见的肉眼形态。
1型隆起型:显示明显隆起的形态,和周围的黏膜界限清楚。
2型局限溃疡型:形成溃疡,围绕溃疡的胃壁肥厚,和周围黏膜界限形成比较明了的癌堤。
3型浸润溃疡型:形成溃疡,包绕溃疡的胃壁肥厚,和周围黏膜不清,形成不明了的癌堤。
4型弥漫浸润型:没有显著的溃疡和癌堤,以胃壁肥厚、硬化为特征,病灶和周围黏膜的界限不清楚。
5型不能分类:难以分类为上述0~4型中的哪种类型。
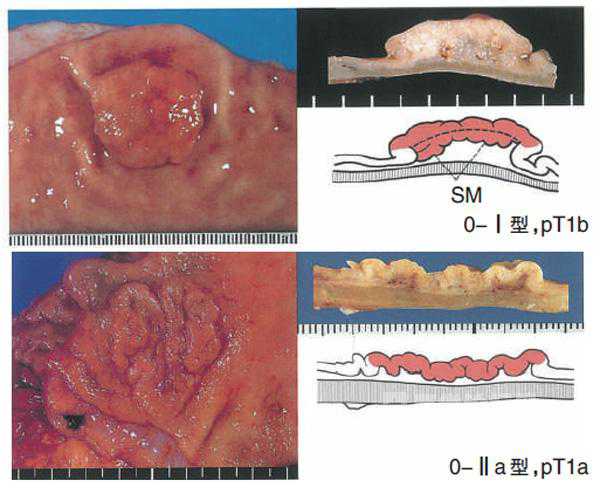
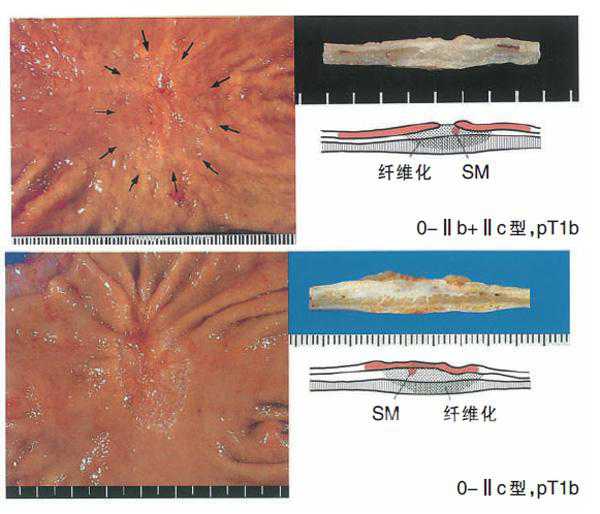
(2)0型(浅表型)的亚分类
0-Ⅰ型隆起型:可见明显的肿瘤状隆起。
0-Ⅱ型浅表型:轻微的隆起或凹陷,或几乎不能辨认。
0-Ⅱa型浅表隆起型:浅表型,可见低的隆起。
0-Ⅱb型浅表平坦型:不超过正常黏膜的凸凹,看不到隆起或凹陷。
0-Ⅱc型浅表凹陷型:可见轻度糜烂或者黏膜的浅凹陷。
0-Ⅲ型凹陷型:可见明显深的凹陷
注:应注意区别0-Ⅰ型和0-Ⅱa型,在第13版《规约》以前,隆起的高度在正常黏膜
2倍以内为0-Ⅱa型,超过该高度则为0-Ⅰ型,实际临床上,一般隆起高度在2~3mm以内为0-Ⅱa型,超过该高度为0-Ⅰ型。
组织学类型分类
恶性上皮性肿瘤进行亚分类时,应按照数量上占优势的组织学类型进行分类,在包含不同组织学类型的情况下,从占优势的组织学类型依次列出(如:tub1>pap)。在TNM分类中,即使肿瘤细胞的数量不占优势,应将低分化程度作为组织型进行分类。TNM组织分化程度分类如下:
GX:不能评价分化程度;
G1:分化良好;G2:中度分化;G3:低分化;G4:分化不明。浸润深度(T)
浸润深度用T分类记载,并表示浸润胃壁各层及其他脏器,记载为M,SM,MP,SS,SE,SI。在表示临床分类和病理学分类时,在T前面分别加接头词c和p,但在M和SM中不用(如:病理学上的黏膜内癌pT1a,不能用pM表示),且M层癌包括黏膜肌层。在多发病灶的情况下,T表示癌细胞浸润深度最深部位的肿瘤。无论有无淋巴结转移,T1肿瘤为早期胃癌。
TX:癌细胞浸润深度不明。T0:没有癌。T1:癌细胞浸润深度局限在黏膜层(M)
或黏膜下层(SM)*。T1a:癌细胞浸润深度局限在黏膜层。T1b:癌细胞的浸润深度局限在黏膜下层。
T2:癌细胞浸润超过黏膜下层,达固有肌层(MP)。
T3:癌细胞浸润深度超过固有肌层,达浆膜下层(SS)。
T4:癌细胞浸润接近浆膜表面或露出,或侵犯其他脏器(SE):T4a:癌细胞浸润接近浆膜表面或者突破浆膜露出在游离腹腔(SE)**;T4b:癌细胞直接侵犯其他脏器(SI)***。
*对SM层进行亚分类的情况为:癌浸润黏膜肌层不足0.5mm为SM1或pT1b1,超过0.5mm则为SM2或pT1b2。
**肿瘤即使浸润了大网膜、小网膜,在没有露出浆膜面的情况下,仍为T3。
***T4b应同时记录浸润脏器的名称,其他脏器是指肝、胰腺、横结肠、脾脏、膈肌、腹壁、肾上腺、小肠和后腹膜腔。浸润浆膜累及大网膜、小网膜时不能定义为T4b。浸润横结肠系膜,累及系膜内血管或系膜后叶时为T4b。TNM分类中,仅浸润横结肠系膜不能认为是T4b。
第7版TNM分类统一了从食道到大肠的消化道T分类,新版《规约》也与此对应。为了避免分期变动的混乱,增加T表示浸润深度,如T1b(SM)、T4a(SE)等。
癌组织的间质量、浸润增殖方式及脉管侵袭(浸润深度在T1b以下肿瘤的记载)
(1)癌组织的间质量
髓样型(medullarytype,med):癌组织间质量特别少。
中间型(intermediatetype,int):介于髓样癌和硬性癌中间。
硬性型(scirrhoustype,sci):癌组织间质量特别多。
注:TNM分类中,多发(multiple)用(m)或(个数)表示。如T2(m)、T1(3)等。
(2)癌组织的浸润增殖方式(INF)
INFa:癌细胞灶显示膨胀性生长,和周围组织境界清楚。
INFb:癌细胞的生长状态处于INFa和INFc的中间状态。
INFc:癌细胞灶显示浸润性生长,和周围组织的境界不清楚。
(3)脉管侵袭
①有关淋巴管侵袭:Ly0:没有发现淋巴管侵袭;Ly1:轻度侵袭;Ly2:中度侵袭;Ly3:重度侵袭。
②有关静脉侵袭:
v0:没有发现血管侵袭;
v1:轻度侵袭;v2:中度侵袭;v3:重度侵袭;
注:对于切除的黏膜标本,表示为ly
(-),ly(+),v(-),v(+)。
2.淋巴结转移的记载
淋巴结的解剖学定义和区域淋巴结
第1~12组及14v组淋巴结为区域淋巴结,在此以远的淋巴结转移为M1。但肿瘤浸润食道时,第19、20、110、111组淋巴结也可作为区域淋巴结。另外,对于残胃癌初次手术时胃空肠吻合的病例,吻合部位的空肠系膜内淋巴结也是区域淋巴结。手术时应该清扫的淋巴结范围根据《指南》决定。
与TNM分类同步,新版《规约》引入基于淋巴结转移个数的N分类。第13、14、16组淋巴结在《规约》中是清扫对象的所属淋巴结,但在TNM分类中,其没有包含在区域淋巴结内,若这些淋巴结转移则为M1,所以,TNM分类不能像《规约》一样正确定义淋巴结的号码,尤其是关于第14v组淋巴结,并没有明确的记载。新版《规约》修改为,第13、16组淋巴结与TNM分类相对应,不属于区域淋巴结,保留了第14v组淋巴结,作为与第6组淋巴结相连续的区域淋巴结。
淋巴结转移的记载方法
对于切除的病例,应记载每组淋巴结的清扫个数和转移个数。不是胃壁周围淋巴结转移,但在胃壁外脂肪组等发现癌细胞,记载为淋巴结外转移。
(1)淋巴结转移程度(N)
NX:区域淋巴结有无转移不明。
N0:区域淋巴结无转移。
N1:区域淋巴结有1~2个转移。
N2:区域淋巴结有3~6个转移。
N3:区域淋巴结有7个以上转移:
N3a:7~15个淋巴结转移;
N3b:16个以上淋巴结转移。
注:要确定N因子,推荐取材16个以上淋巴结,病理学报告不到16个淋巴结,也可定义为淋巴结转移阳性。
N的定义是本次修改版中最大的变更点。术前化疗和临床试验进行分期时,只要发现区域淋巴结有转移,无论转移个数均定义为CN(+),由此确定最低的临床分期。
(2)淋巴结的转移度
记载清扫的每组淋巴结的转移度(转移淋巴结个数︰清扫淋巴结个数)和全部清扫淋巴结的转移度。
根据TNM分类,转移灶在2mm以下的为微转移,可以追加记载为pN1(mi)。应用免疫组化等方法时,发现单独肿瘤细胞或 0.2mm以下的小簇,为游离肿瘤细胞(ITC),仅在这种情况下,pN0记录为pN0(i+),有时,通过HE染色也可以识别ITC。
TNM分类中,最先接受从原发病灶流出的淋巴液的淋巴结为前哨淋巴结,检查确定时,记录为pN0(sn)或pN1(sn)。
以往,远处转移(M)定义为肝转移、腹膜转移及腹腔冲洗细胞学阳性以外的转移,根据新版《规约》,区域淋巴结以外的转移全部称为M1。但H(肝转移)、P(腹膜转移)、CY(腹腔脱落细胞)应与其他远处转移区别处理,若为H0P0CY0,记载为M0即可。
治疗效果的评价
1.应评价术前治疗后的肿瘤
2.药物、放疗的组织学效果判断标准
胃癌接受药物治疗和放射治疗后,可见癌组织中癌细胞和间质反应的变化,重视这类变化及反应程度,尤其坏死量的变化,在组织学上进行疗效分类。
①建议检查和判断时,至少通过病灶中心最大切割平面取材,进行病理学检查。
②以日本食道疾病研究会编写的《放疗和化疗效果的组织学判断标准》为基准。
③在根据组织学切片判断困难的情况
下,须参考临床所见,如隆起性病变脱落的情况等。
④关于疗效的判定,不要仅限于癌组织的中心部,即使没有治疗的病例也会发生一定程度的变性、坏死等,要重视癌细胞浸润周边的组织学变化。
⑤腺癌与扁平上皮癌不同,对坏死物质及角化物质的异物反应少见,却经常发生变形、溶解、消失,且宿主方面的组织反应有时呈现伴多数泡沫状组织球的黄色肉芽肿图像,该图像是确定病灶范围的重要线索。
⑥须注意对弥漫性胃癌(硬癌)的辨认,有时通过组织切片难以确认癌细胞的形态。
⑦治疗内容、最后治疗到手术切除及尸检等时间,均要附加记载。
注:对于活检材料,原则上,不要基于手术材料判断疗效,仅记载每个材料的组织学所见。
切除标本的处理
1.有无淋巴管侵袭(ly)
在癌细胞巢和淋巴管内皮细胞间可见空隙的情况下,判断淋巴管侵袭并不困难,但多数情况下很难判断这个空隙是淋巴管内腔还是人工导致的变化,若不清楚的病例则为阴性。接受内窥镜下黏膜切除(EMR)、内窥镜下黏膜下剥离术(ESD)等的病例,须根据切除标本判断是否需要后续治疗,建议行免疫组化染色(D2-40)确认。
2.有无静脉侵袭(v)
静脉侵袭时,在癌细胞巢和内皮细胞间没有空隙,多为肿瘤栓塞,有时根据HE染色判断有无静脉侵袭比较困难。对于可疑病例,建议行弹力纤维染色(VictoriablueHE染色,Elastica-vanGieson染色)和免疫组化(CD31、CD34)等,确认癌细胞巢和静脉壁弹性纤维及内皮细胞间的关系。
胃活检组织诊断分类(Group分类)
目前,Group分类应用在胃和大肠的活检诊断上。虽同是消化道癌,由于不同脏器存在各自特征性病理学图像,以前《大肠癌处理规约》和《胃癌处理规约》均分别制定,自从要求消化道癌的病理诊断统一为Group分类后,2009年第7版《大肠癌处理规约》补充修订版变更为活检Group分类。通过该修订,Group分类从组织学异型度的分类变更为病变性质的分类。新版《胃癌处理规约》采用和大肠活检组织诊断分类(Group分类)同样的观点,另外,标记方法也统一了运用数字,同时,在活检诊断时,应在记录组织学诊断名称后附加记载Group分类。以下显示和临床对应的活检组织诊断分类(Group分类)。
GroupX:因取材问题,不能进行活检组织诊断
没有采集到上皮标本,即使采取了,但因组织挫灭和热凝固等原因,活检组织不能进行组织病理学诊断。
Group1:正常组织及非肿瘤性病变
包括正常组织、化生性黏膜、炎症性黏膜、化生性息肉等。糜烂、溃疡、化生性息肉等即使镜下所见再生性反应性异型,也诊断为非肿瘤性的组织。
Group2:判断肿瘤性(腺瘤或癌)或非肿瘤性病变困难
进行该判断时,记载为瘤变不明确,建议附加记载判断困难的原因,这些原因包括以下几点:
①存在异型细胞,但取材组织量不足,
根据细胞异型判断肿瘤性病变困难,建议临床上再次活检取材,需确定诊断。
②存在异型细胞,糜烂和炎症变化严重,判断肿瘤或非肿瘤病变困难,建议临床上消炎后再次活检或充分观察临床经过。
③存在异型细胞,病理组织挫灭和损害严重,难以判断肿瘤或非肿瘤性病变,建议临床上再次检查,需确定诊断。
另外,在进行Group2的诊断时,首先病理方面应制作深切片,进行细胞增殖和p53免疫组化染色等相关研究,其次同一病例应再次活检,持续诊断为Group2时,建议专家病理会诊。
Group3:腺瘤
判断为腺瘤,肿瘤具有细胞异型性及结构异型性的特点,诊断为良性肿瘤。
Group4:判断为腺瘤病变中存在可疑癌病变
该诊断为良性病变,但不能鉴别是腺瘤还是癌病变。
Group5:癌
可诊断为癌,若存在2种以上组织病理学类型,建议从数量上占优势的组织学类型开始,依次记载。
新版Group分类重要的更新是把病变性质作为重点进行分类,可对治疗的选择提供必要的病理信息(表1)。关于新版Group2分类,有以下补充说明:
对于可疑肿瘤、不能判定肿瘤性病变或难以判定肿瘤与非肿瘤性病变的病例,适用于Group2。新分类中Group2必须记载判断困难的理由和可疑的诊断,应再次活检确定诊断。
由于胃癌外科的临床实践不同,语言表述上的差异,对日本《胃癌处理规约》的解读,不同作者间存在一定差异,积累丰富的胃癌诊治经验,全面复习文献,熟悉日语文献并较准确的阅读,借鉴和评价性吸收国外经验,了解国际胃癌的统一规范,有助于指导和推进我国胃癌治疗水平的提高,向国际舞台迈进。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#日本#
44