【专题论著】| 示踪用盐酸米托蒽醌注射液与核素用于乳腺癌前哨淋巴结活检的疗效对比研究
2023-08-29 中国癌症杂志 中国癌症杂志 发表于上海
本研究拟在大样本人群中评估MHI在乳腺癌SLNB中的示踪效果,并比较其与核素的差异。
[摘要] 背景与目的:国内外指南均推荐核素用作前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)示踪剂,但多种原因导致该技术在国内未得到普及。示踪用盐酸米托蒽醌注射液(mitoxantrone hydrochloride injection for tracing,MHI)是一种新型乳腺癌前哨淋巴结(sentinel lymph node,SLN)示踪剂,其在乳腺癌SLNB中的效果尚未明确。本研究是一项大样本阳性对照临床试验,旨在评价MHI和核素在SLNB中的示踪差异。方法:试验纳入了2019年12月—2020年7家医院的早期乳腺癌患者。所有入组的早期乳腺癌患者均在手术前注射MHI和核素作为SLN示踪剂。分别统计MHI和核素的SLN检出数量和SLN检出率,分析两种示踪剂示踪效果的差异。结果:MHI的SLN检出率为96.9%(370/382),核素的SLN检出率为97.4%(372/382),两者检出率差异无统计学意义(P>0.05)。两种示踪剂共同检测到362例(94.7%)受试者的SLN;16例(4.1%)发生可能与试验药物相关的不良事件。结论:本研究发现MHI示踪效果不劣于核素。且MHI的使用无需特殊仪器/设备辅助。
[关键词] 乳腺癌;前哨淋巴结活检;示踪用盐酸米托蒽醌注射液;淋巴示踪剂;核素;腋窝淋巴结
[Abstract] Background and purpose: Both domestic and foreign guidelines recommend the use of radionuclide as sentinel lymph node (SLN) biopsy (SLNB) tracer, however this technique has not been popularized in China for a variety of reasons. Mitoxantrone hydrochloride injection for tracing (MHI), a new strategy to identify lymph nodes, has not been tested for axillary node staging in breast cancer. This multicenter, self-controlled, non-inferiority trial aimed to evaluate the differences between MHI and radionuclide in SLNB tracing. Methods: The trial was conducted across 7 hospitals from December 2019 to December 2020. Patients with early-stage breast cancer received MHI and radionuclide (technetium 99 labeled sulfur colloid, 99mTc-Sc) as SLN tracers during the surgery. The number of SLNs detected and sentinel node detection rates of MHI and radionuclide were counted to evaluate differences in the tracing effects between the two tracers. Results: SLN detection rates of MHI and radionuclide were 96.9% (370/382) and 97.4% (372/382), respectively, with no significant difference (P>0.05). SLNs were co-detected by both tracers in 362 (94.7%) patients; 16 (4.1%) had adverse events possibly related to the trial drugs. Conclusion: In this study, it was found that the lymphatic tracing ability of MHI was not inferior to that of radionuclide. Meanwhile, the use of MHI does not require special instrument/equipment assistance.
[Key words] Breast cancer; Sentinel lymph node biopsy; Mitoxantrone hydrochloride injection for tracing; Lymphatic tracer; Radionuclide; Axillary lymph node
乳腺癌已经超过肺癌成为全球新确诊人数最多的癌症[1],2020年全球约有230万新发病例,占所有癌症病例的11.7%,中国女性乳腺癌新发病例数为416 371例,患者人数居世界首位[2]。前哨淋巴结(sentinel lymph node,SLN)活检术(SLN biopsy,SLNB)是目前临床腋窝淋巴结阴性乳腺癌患者腋窝淋巴结分期的标准方法,可提高外科医师检测淋巴结微小病变的能力,同时显著降低术中和术后并发症发生率[3]。大型随机对照试验[4]表明SLNB是一种可靠的微创诊疗方法,SLN检出率>97%,假阴性率(false negative rate,FNR)较低。
蓝染料和核素一直是乳腺癌SLNB最常用的淋巴结示踪剂[5]。但核素具有固定的半衰期需要现用现配,且涉及核医学科医师和辅助仪器设备,部分医务人员对其放射性有顾虑,载体硫胶体在中国也未获得中国国家药品监督管理局(National Medical Products Administration,NMPA)批准,在大部分国家放射性胶体可及性较低。据一份调查报告[6]显示,中国大陆63%的医院单独使用亚甲蓝作为SLN示踪剂。虽然亚甲蓝有更好的可视性,价格低廉,但靶向能力差、易弥散,容易染色次级淋巴结导致检出过多淋巴结,易入血引起过敏反应如皮疹、血压下降等。
现有示踪剂的局限性激发了对新型示踪剂的研究,如吲哚菁绿(indocyanine green,ICG)光学成像[7]和超顺磁性氧化铁(super paramagnetic iron oxide,SPIO)成像[8]。研究[9]显示,ICG对SLN的检出率为94%,Rubio等[10]报道,SPIO与核素在识别乳腺癌中SLN方面效果等同。这些技术具有较高的SLN检出率,但未得到广泛应用。
示踪用盐酸米托蒽醌注射液是国内唯一具有适应证的乳腺癌SLN示踪剂。其临床前药效学研究[11]表明,盐酸米托蒽醌对淋巴系统有较高的亲和力。在组织间隙给药后,盐酸米托蒽醌会自主装配成球形纳米晶体,粒径约为100 nm,大于毛细血管内皮细胞间隙(30~50 nm),小于淋巴管内皮细胞间隙(120~500 nm)。因此,纳米晶体不进入血液循环,可以进入毛细淋巴管通过淋巴引流聚集在区域淋巴结中,在内皮细胞的胞饮及吞噬作用下停留一段时间,将淋巴结染成蓝色。研究[12]显示,示踪用盐酸米托蒽醌注射液(mitoxantrone hydrochloride injection for tracing,MHI)具有理想的淋巴结靶向示踪能力;研究[13]结果显示,MHI和核素对SLN的检出率或检出数量差异均无统计学意义,同时具有较高的安全性和良好的耐受性,当MHI剂量增加至2.0 mL(5.0 mg/mL)时未见剂量限制性毒性作用。本研究拟在大样本人群中评估MHI在乳腺癌SLNB中的示踪效果,并比较其与核素的差异。
1 资料和方法
1.1 试验研究设计
本研究为一项前瞻性、多中心、阳性、自身对照临床试验。所有入组受试者将在术中采用试验药物(示踪用盐酸米托蒽醌注射液)和对照药物(核素)联合示踪SLN,术中观察并记录给药时间、手术开始时间、给药剂量和给药点位,记录两种药物示踪的淋巴结数量(包括着色淋巴管指向淋巴结)和药物不良反应。评估在早期乳腺癌受试者术中使用示踪用盐酸米托蒽醌注射液和核素进行SLN示踪的安全性和有效性。
1.2 研究对象
各中心采取竞争入组方法,所有受试者在入组前均需签署知情同意书。
纳入标准:① 年龄18~70岁的女性患者;② 诊断为原发性浸润性乳腺癌或导管原位癌(ductal carcinoma in situ,DCIS);③ 临床T1-3、cN0;④ 临床淋巴结阴性;⑤ 计划接受SLNB。排除标准:① 开放性活检史;② 隆乳术史;③ 既往接受过乳腺癌手术或新辅助化疗;④ 需要行双侧乳腺癌手术;⑤ 妊娠或哺乳期;⑥ 乙醇或镇静药物依赖;⑦ 精神疾病;⑧ 在研究前4周内参加过任何其他临床试验;⑨ 实验室检查异常有临床意义;⑩ 研究者认为不适合参加研究的受试者。
1.3 干预措施
每例受试者在术前24 h在乳晕或瘤周皮下注射核素(锝99标记的硫胶体,99mTc-Sc,剂量不超过2 mCi,各医院自制)。手术前约15 min在相同部位注射MHI(5.0 mg/mL,总剂量不超过2.0 mL,沈阳天邦制药有限公司提供)。注射后手动按压5 min促进淋巴回流。随后在γ探测器探针和蓝染淋巴管的引导下进行SLNB,任何示踪剂识别的或可疑的肿大淋巴结均视为SLN予以切除。采用标准方案进行SLN切片和处理,进行组织病理学检查。通过术中印片细胞学检查和(或)术中快速冷冻切片病理学检查确定各检出淋巴结的病理学状态。
1.4 样本量计算
本研究的主要研究终点是对比试验药物和对照药物的SLN检出率,目的是评价试验药物非劣于对照药物。假设:核素SLN检出成功率为96%;原假设H0:p1-p2≤ -δ,备择假设Hα:p1-p2>-δ,p1和p2分别代表试验药物和对照药物的SLN检出率。δ为非劣效界值;假设试验药物相对于对照药物的非劣效界值为5%;自身对照;把握度为90%。计算可得到试验总样本量为323例。假设试验脱落率为15%,考虑到适当的扩大样本量可以达到更大的统计检验把握度,最终总样本量定为388例。
1.5 结局指标
全分析集(full analysis set,FAS)包括接受至少1种研究药物(MHI或核素)并接受疗效评价的所有受试者。
主要终点是在FAS中分别计算两种药物的SLN检出率。SLN检出率=(示踪剂检出的受试者数量/FAS受试者总数)×100%。MHI检测到的受试者是指淋巴结蓝染和(或)具有蓝染淋巴管指向淋巴结的受试者。核素检出的受试者是指淋巴结通过γ探测器有热点(γ探头计数值最高或计数值不低于最高计数10%)。
次要终点是在FAS中分析MHI和核素之间的示踪一致性和重合性。一致性是两种示踪剂共同检测的受试者比例。重合性是平均每个受试者被两种示踪剂共同检测到SLN的比例。并分别统计两种示踪剂对阳性SLN和阳性受试者的检出率差异。
安全性分析集(safety-analysis-set,SS)包括所有接受至少一种研究药物(对照药物或试验药物)并有基线后安全性评价的受试者。在SS中分析安全性。根据美国国立卫生研究院(National Cancer Institute,NCI)发布的常见不良反应术语评定标准(Common Terminology Criteria For Adverse Events,CTCAE)第5.0版对不良事件(adverse effect,AE)进行分类,统计AE发生率。如果1例受试者同一AE发生多次,则在计算AE的发生率时记录为1例。
1.6 统计学处理
连续变量通常表示为平均值、标准差、中位数、最小值和最大值。分类变量以频率和百分比表示。采用 Clopper Pearson法[14]计算SLN检出率的95%可信区间(confidence interval,CI)。通过WALD方法[15]计算两组之间的差异及其95% CI,并使用近似正态检验计算P值。当SLN检出率的95% CI下限≥-5%时,达到非劣效性。数据统计使用SAS 9.4软件。P<0.05为差异有统计学意义。
1.7 质量控制措施
本研究于2019年在全国7家药品临床研究基地开展,分别获得了所有参研单位的伦理委员会批准。研究符合《药物临床试验质量管理规范》和ICH-GCP原则、《药物临床试验伦理审查工作指导原则》、世界医学会《赫尔辛基宣言》、中国的相关法律及法规。所有参研单位具有临床研究资质,实验室和临床病房符合要求,并经过临床试验培训,试验用药由专业培训的护理人员负责保管,临床数据录入电子数据采集系统进行电子化数据管理。
2 结 果
2.1 受试者入组情况
2019年12月—2020年12月,共筛选了592例受试者,其中1例因使用方案禁用药物“亚甲蓝”而未被纳入FAS或SS。最终,382例受试者被纳入FAS,387例受试者被纳入SS(图1)。MHI组和核素组的受试者基线特征相似(表1)。
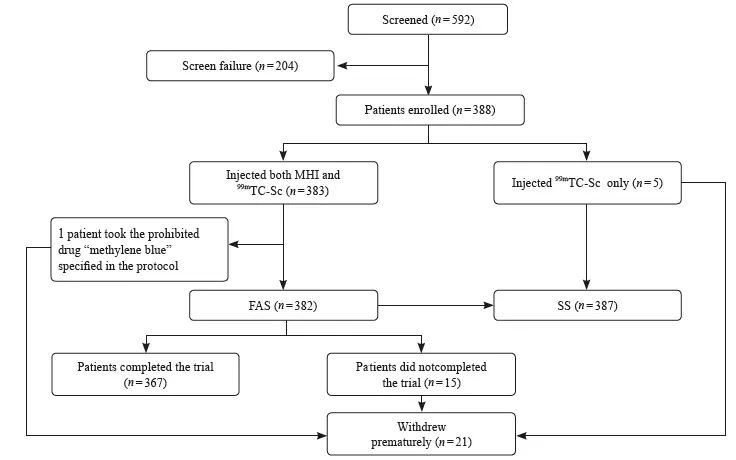
图1 受试者入组情况
Fig. 1 Disposition of the patients
2.2 观察指标
2.2.1 SLN检出率
被纳入FAS的382例受试者中,MHI组SLN检出病例数为370例(96.9%);核素SLN检出病例数为372例(97.4%)。MHI和核素的SLN检出率为96.9%(95% CI:94.6%~98.4%)和97.4%(95% CI:95.2%~98.7%)。两组SLN检出率差异无统计学意义(P>0.05)。两组间SLN检出率差值为-0.5%(95% CI:-2.9%~1.8%),由于95% CI下限≥-5%,故MHI的SLN检出率非劣于核素。
2.2.2 SLN示踪一致性
两种药物共同示踪病例数为362例,受试者共同示踪率及其95% CI为94.8%(92.0%~96.8%,图2)。
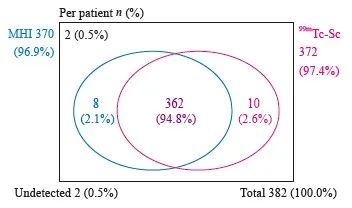
图2 两种示踪剂检出的受试者分布
Fig. 2 Distribution of patients detected by two tracers
2.2.2.1 SLN示踪重合性
试验平均检出SLN(4.0±2.0)枚,中位检出SLN 4枚,检出SLN范围1~14枚。MHI和核素同时检测出354例受试者的SLN,检出相同编号SLN的平均数量为(2.5±1.6)枚/人,中位数量为2枚,检出相同SLN的数量为1~12枚。两种示踪剂的重合率为91.0%。
2.2.2.2 联合用药的SLN检出率
MHI联合核素共检出380例受试者。MHI联合核素的SLN检出率为99.5%(95% CI 98.1%~99.9%)。联合组的SLN检出率与MHI组差异有统计学意义(P=0.007 0)。
2.2.2.3 阳性SLN和阳性受试者的检出率
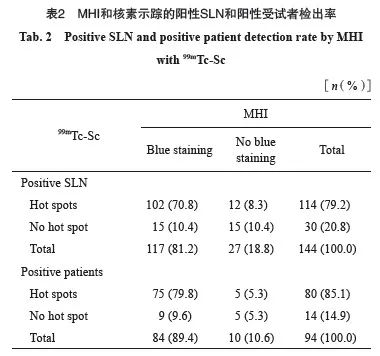
阳性SLN检出率:共102个(70.3%)阳性SLN同时被MHI和核素示踪,15个(10.3%)阳性SLN仅被MHI染色,12个(8.3%)阳性SLN仅被核素示踪,但未被MHI染色。另有16个(11.0%)可疑淋巴结示踪失败,但最终病理学检查显示为阳性。两者阳性SLN检出率差异无统计学意义(P>0.05,表2)。
阳性受试者检出率:阳性患者被定义为阳性SLN数量≥1个的受试者。共94例受试者检出阳性SLN;MHI和核素共同检出其中75例(79.8%),9例(9.6%)阳性受试者仅被MHI检出,5例(5.3%)阳性受试者仅被核素检出,另有5例(5.3%)阳性受试者示踪失败。两者阳性受试者检出率差异无统计学意义(P>0.05, 表2)。
综合比较,MHI识别的阳性SLN和阳性SLN受试者不少于核素,我们可以推测MHI的FNR不高于核素。显然,MHI联合核素时FNR更低。
2.3 安全性
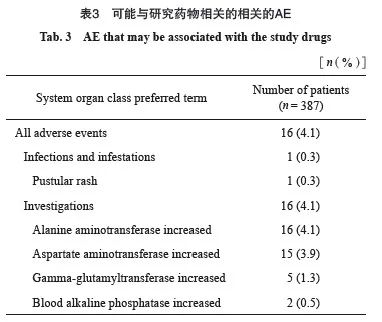
共有16例(4.1%)受试者发生可能与试验药物相关的AE(表3)。1例受试者(0.3%)发生感染和侵染。16例(4.1%)受试者中各项检查发现如下:丙氨酸氨基转移酶升高16例(4.1%),天门冬氨酸氨基转移酶升高15例(3.9%),γ-谷氨酰转移酶升高5例(1.3%),血碱性磷酸酶升高2例(0.5%)。
3 讨 论
SLNB主要用于判断预后、局部控制、指导治疗。SLNB的成功与示踪剂的选择有关。Li等[16]报道亚甲蓝SLN检出率为91%,FNR为13%。研究[17]表明,专利蓝的SLN检出率较高(>95%),FNR较低,为5%~10%。Guo等[18]报道单独ICG的SLN检出率为97%,ICG联合亚甲蓝的SLN检出率为99.5%。本研究评价了MHI作为一种新的染料示踪剂的SLN检出率并验证了其与核素之间的非劣效性。MHI单独示踪SLN的检出率高达96.9%,MHI联合核素使SLN的检出率进一步提高到99.5%。可见,MHI用于SLN检测具有高度准确性,可用于乳腺癌SLN的示踪。
SLNB保乳已成为早期乳腺癌患者的重要选择,示踪剂局部注射的安全性逐渐受到重视。然而,Lee等[19]报道了亚甲蓝毒性引起的皮肤坏死,局部注射后造成了患者血液紊乱和局部皮肤反应。研究[20]分析了蓝色染料的AE:患者对专利蓝的过敏反应发生率为0.2%,患者使用亚甲蓝和专利蓝时注射部位局部炎症发生率为0.3%,患者使用亚甲蓝和专利蓝时皮肤染色的发生率为3.2%。米托蒽醌用于化疗很少有报告外渗后发生蜂窝组织炎、囊泡形成或组织坏死[21]。剂型改良作为SLN示踪剂时,MHI富集于局部淋巴结随手术切除而难以进入血液循环。在Ⅰ期临床试验[13]中,接受2.0 mL剂量MHI的患者在血浆中检测到的浓度范围为26.0~79.4 ng/mL,全身不良反应轻微,未观察到药物不良反应。本研究中近一半的患者接受了保乳手术,药物注射部位在瘤周或腺体内。至随访期结束时,未发生注射部位皮肤坏死,1例接受乳房再造手术的患者发生了术后伤口感染,但该AE与MHI无关。本研究中最常见的与MHI相关的AE为肝功能相关生化指标异常,主要与MHI的药物代谢途径有关,可能提示我们对肝功能异常或既往有肝损害的患者应慎用本品进行SLN示踪。但需要注意的是,这些患者均在对症治疗后痊愈。
本研究存在一定的局限性:并非所有受试者均进行了腋窝淋巴结清扫,无法比较MHI和核素用于SLNB中的FNR。本研究也未纳入接受切除活检和新辅助化疗的患者,在这些患者中使用新型示踪剂的准确性还有待进一步研究证实。
这项前瞻性多中心研究表明,MHI是一种有效且安全的理想示踪剂,其示踪效果与放射性核素相当,可单独使用或与放射性核素联用。我们期待MHI在乳腺癌领域的应用可以提高SLNB的可及性,为更多的患者带来良好的预后。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] 张雅聪, 吕章艳, 宋方方, 等. 全球及我国乳腺癌发病和死亡变化趋势[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 14-20.
ZHANG Y C, LYU Z Y, SONG F F, et al. Trends of incidence and mortality of breast cancer worldwide and in China[J]. J Multidiscip Cancer Manag Electron Version, 2021, 7(2): 14-20.
[3] VERONESI U, PAGANELLI G, VIALE G, et al. A randomized comparison of sentinel-node biopsy with routine axillary disp in breast cancer[J]. N Engl J Med, 2003, 349(6): 546-553.
[4] KIM T, GIULIANO A E, LYMAN G H. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma: a meta analysis[J]. Cancer, 2006, 106(1): 4-16.
[5] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary disp vs no axillary disp in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. JAMA, 2011, 305(6): 569-575.
[6] YANG B L, REN G S, SONG E W, et al. Current status and factors influencing surgical options for breast cancer in China: a nationwide cross-pal survey of 110 hospitals[J]. Oncologist, 2020, 25(10): e1473-e1480.
[7] TAGAYA N, TSUMURAYA M, NAKAGAWA A, et al. Indocyanine green (ICG) fluorescence imaging versus radioactive colloid for sentinel lymph node identification in patients with breast cancer[J]. J Clin Oncol, 2010, 28(15_suppl): 674.
[8] KARAKATSANIS A, CHRISTIANSEN P M, FISCHER L, et al. The Nordic SentiMag trial: a comparison of super paramagnetic iron oxide (SPIO) nanoparticles versus Tc(99) and patent blue in the detection of sentinel node (SN) in patients with breast cancer and a meta-analysis of earlier studies[J]. Breast Cancer Res Treat, 2016, 157(2): 281-294.
[9] KITAI T, INOMOTO T, MIWA M, et al. Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer[J]. Breast Cancer, 2005, 12(3): 211-215.
[10] RUBIO I T, DIAZ-BOTERO S, ESGUEVA A, et al. The superparamagnetic iron oxide is equivalent to the Tc99 radiotracer method for identifying the sentinel lymph node in breast cancer[J]. Eur J Surg Oncol, 2015, 41(1): 46-51.
[11] MAO Y L, LIU J, SHI T Y, et al. A novel self-assembly nanocrystal as lymph node-targeting delivery system: higher activity of lymph node targeting and longer efficacy against lymphatic metastasis[J]. AAPS PharmSciTech, 2019, 20(7): 292.
[12] 陈少博, 刘玮楠, 张圣洁, 等. 示踪用盐酸米托蒽醌注射液用于甲状腺癌前哨淋巴结示踪的临床疗效、安全性及药代动力学Ⅰ期试验[J]. 协和医学杂志, 2021, 12(5): 729-735.
CHEN S B, LIU W N, ZHANG S J, et al. Clinical efficacy, safety and pharmacokinetics of tracing injection of mitoxantrone hydrochloride for tracing sentinel lymph nodes in thyroid carcinoma: a phase Ⅰ clinical trial[J]. Med J Peking Union Med Coll Hosp, 2021, 12(5): 729-735.
[13] YANG B L, ZHENG S Y, HUANG X Y, et al. A singlecenter, self-controlled, phase Ⅰ clinical trial of mitoxantrone hydrochloride injection for lymph tracing for sentinel lymph node identification of breast cancer[J]. Gland Surg, 2021, 10(3): 992-1001.
[14] CLOPPER C J, PEARSON E S. The use of confidence or fiducial limits illustrated in the case of the binomial[J]. Biometrika, 1934, 26(4): 404-413.
[15] 刘玉秀, 徐晓莉, 郑 均. 配对二项数据等效性/非劣效性评价的样本含量估计和假设检验[J]. 中国临床药理学与治疗学, 2008, 13(3): 299-302.
LIU Y X, XU X L, ZHENG J. Sample size estimation and hypothesis testing of assessing equivalence/noninferiority for paired binary data[J]. Chin J Clin Pharmacol Ther, 2008, 13(3): 299-302.
[16] LI J Y, CHEN X, QI M, et al. Sentinel lymph node biopsy mapped with methylene blue dye alone in patients with breast cancer: a systematic review and meta-analysis[J]. PLoS One, 2018, 13(9): e0204364.
[17] VIDYA R, ATHWAL R, HUISSOON A P, et al. Diagnostic application of patent blue V in sentinel lymph node biopsy for breast cancer-is it time for a change? [J]. Indian J Cancer, 2019, 56(3): 269-270.
[18] GUO J J, YANG H P, WANG S, et al. Comparison of sentinel lymph node biopsy guided by indocyanine green, blue dye, and their combination in breast cancer patients: a prospective cohort study[J]. World J Surg Oncol, 2017, 15(1): 196.
[19] LEE J H, CHANG C H, PARK C H, et al. Methylene blue dyeinduced skin necrosis in immediate breast reconstruction: evaluation and management[J]. Arch Plast Surg, 2014, 41(3): 258-263.
[20] PEEK M C, CHARALAMPOUDIS P, ANNINGA B, et al. Blue dye for identification of sentinel nodes in breast cancer and malignant melanoma: a systematic review and meta-analysis[J]. Future Oncol, 2017, 13(5): 455-467.
[21] CROSSLEY R J. Clinical safety and tolerance of mitoxantrone[J]. Semin Oncol, 1984, 11(3 Suppl 1): 54-58.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







