【专家述评】| 2022年度肾细胞癌基础研究及临床诊疗新进展
2023-07-26 中国癌症杂志 中国癌症杂志 发表于上海
本文总结2022年度RCC研究和诊疗新进展,旨在为临床诊治提供新思路。
[摘要] 肾细胞癌(renal cell carcinoma,RCC)是泌尿系统三大肿瘤之一,随着生活方式的改变以及肥胖、高血压等系统疾病的增多,中国的RCC发病率也呈逐年上升趋势。RCC起病隐匿,大多数RCC患者是通过影像学检查偶然发现的,不少患者确诊时已是晚期。虽然靶向治疗和免疫治疗的出现显著延长了晚期RCC患者的生存时间,但RCC病理学类型众多,许多RCC患者仍难以从系统性治疗中获益。大量基础和临床研究致力于探索新的靶点及治疗药物,以进一步改善患者的预后。本文总结2022年度RCC研究和诊疗新进展,旨在为临床诊治提供新思路。
[关键词] 肾细胞癌;免疫治疗;靶向治疗;基础研究;临床研究
2020年全球新发431 288例肾肿瘤[1],90%的肾肿瘤为肾细胞癌(renal cell carcinoma,RCC)。在所有的RCC中,肾透明细胞癌(clear cell RCC,ccRCC)约占70%,乳头状RCC(papillary RCC,pRCC)占10%~15%,肾嫌色细胞癌(chromophobe RCC,chRCC)约占5%[2]。RCC患者中,男性与女性比例约为1.5∶1.0,患者年龄主要集中在60~70岁[3]。从全球范围来看,北美洲和欧洲的RCC发病率和死亡率最高[4]。近年来,随着生活方式的改变以及肥胖、高血压等系统疾病的增多,东亚地区的RCC发病率也呈逐年上升的趋势[4]。本文主要对2022年度肾癌研究领域的重大进展进行综述。
1、发病因素
国际癌症研究机构已将吸烟列为肾肿瘤发生的中度致癌风险因素[5]。研究[6]表明,吸烟者发生肾肿瘤的风险比不吸烟者高出39%,吸烟与肾肿瘤发病风险之间的关系呈剂量依赖性趋势,与不吸烟者相比,戒烟者的发病风险仍然高出20%,每天吸烟超过30支的人风险急剧增加。吸烟诱发肾肿瘤的确切机制尚未完全阐明,目前认为多环芳烃、芳香族胺、杂环芳香族胺和n-亚硝胺具有潜在的致癌作用[7]。
全世界约20%肾肿瘤的发生归因于超重和肥胖,且主要与腹型肥胖有关,这种相关性呈线性特征,体重指数(body mass index,BMI)每增加1,肾肿瘤的发生风险就会增加4%[8]。尽管BMI超标与肾肿瘤的发生有关,但其与肾肿瘤患者生存率的关系尚不清楚。根据“肥胖悖论”,虽然被诊断为肾肿瘤的风险随着BMI的增加而增加,但BMI越高,肾肿瘤患者的特异性生存率也越高[9]。因此,肥胖是肾肿瘤发生、发展的公认危险因素,但却与肾癌患者更长的生存期显著相关,而这背后的潜在机制仍需进一步探索。
高血压可通过缺氧诱导因子(hypoxia-inducible factor,HIF)失调、脂质过氧化和活性氧的形成增加肾肿瘤发生的风险[10]。一项meta分析[11]纳入了18项评估高血压患者肾肿瘤发病率的研究,其中包括10项纵向分析。在这10项研究中,有7项表明高血压的严重程度与肾肿瘤的发生、发展有关。有研究[12]表明,血压每升高10 mm Hg,肾肿瘤风险就会增加10%~22%。
饮酒是癌症的明确风险因素,世界卫生组织在30多年前便将乙醇视为致癌物。但与吸烟不同,前瞻性研究[13]发现,轻度至中度饮酒以剂量效应的方式对肾肿瘤的发展具有保护作用。总的来说,饮酒量达到15 g,与肾肿瘤的发展呈负相关,肿瘤风险可减少28%[13]。Bagnardi等[14]的一项meta分析同样指出,肾肿瘤与饮酒之间呈显著负相关,但仍需进一步研究验证。
2、基础研究进展
2.1 ccRCC基础研究进展
2.1.1 多组学研究进展
2022年,复旦大学附属肿瘤医院泌尿外科团队利用多组学测序首次绘制了中国ccRCC的基因组-蛋白质组图谱[15]。该研究发现中国人群中ccRCC突变率最高的基因是VHL和PBRM1,并揭示ccRCC具有广泛的代谢及免疫异质性。通过分子分层可将ccRCC分为GP1、GP2和GP3三种亚型,其中GP1表现为免疫浸润型,GP2为代谢重塑型,GP3为间质成分型。GP1亚型表现出最强的侵袭性,最容易发生转移,因此预后也最差。进一步研究发现,烟酰胺N-甲基转移酶可以增强DNA依赖蛋白激酶催化亚基的活性,并提高DNA修复效率,进而促进ccRCC的发生、发展。
肿瘤异质性是近年来备受关注的话题,肿瘤间和肿瘤内的异质性均会导致不同的预后及不同的治疗响应。有研究[16]对213例RCC患者的305例癌组织和166例癌旁正常组织进行了组织病理学、蛋白质组学和代谢组学的综合分析,对侵袭性组织病理学亚型进行了分子层面的探索,可能有助于确立新的治疗策略。高度瘤内异质性是ccRCC的标志性特点,反映了ccRCC的复杂演变轨迹,这种异质性将会影响临床预后。
肿瘤的生物学行为取决于癌细胞的恶性特征及其与肿瘤微环境中多细胞间的相互作用。为了在更广泛的微环境中探索细胞间的相关性,维康桑格研究所[17]利用单细胞转录组、空间转录组以及基于显微切割的全外显子测序技术探索了肾癌的瘤内异质性,发现CD8+ T细胞克隆亚群具有决定性影响,肿瘤内的空间异质性不能很好地用体细胞异质性来解释。该研究定义了6个可以区分肿瘤细胞行为的保守驱动事件,并发现在肿瘤和正常组织交界处存在丰富的上皮-间充质转化驱动事件,且这种驱动事件与IL1B阳性的巨噬细胞共定位,可能作为潜在的治疗靶点。
有研究[18]使用基因表达反卷积分析,发现单个肾癌可以表现为各种病理学亚型的混合模式并定义了新的病理学分子亚型。该研究预测的病理学分子亚型与癌症基因组图谱(The Cancer Genome Atlas,TCGA)队列中的癌症特异性生存相关,并在242个独立的RCC样本中得到验证。该研究表明,病理学分子亚型可以预测RCC患者的预后,有助于实施个性化的治疗。
2.1.2 致癌靶点研究进展
英国剑桥大学[19]利用全基因组关联分析和实验模型验证,证实谱系转录因子PAX8是ccRCC的两种基因改变(11q13.3处的遗传变异rs7948643和VHL的体细胞失活)发挥致癌作用所必需的,该研究揭示了PAX8在ccRCC发生、发展中的关键作用,提示PAX8可能是ccRCC潜在可行的治疗靶点。
ccRCC因其癌组织中存在大量的脂滴呈透明状而得名,近期的一项研究[20]表明,Jumonji结构域蛋白6(Jumonji domain-containing 6,JMJD6)在ccRCC发生、发展中起着关键作用,并与脂滴的形成关系密切。该研究发现JMJD6的沉默可降低二酰甘油-O-酰基转移酶同源物1 (diacylglycerol O-acyltransferase 1,DGAT1)的表达,从而抑制脂滴形成和肿瘤生长。用药物抑制DGAT1在体外可减少脂滴的形成,在体内可抑制ccRCC的形成。因此,JMJD6-DGAT1轴可能是ccRCC新的治疗靶点。
STDE2是ccRCC常见的突变之一,基因组图谱显示,SETD2突变与肾癌转移呈正相关。然而,SETD2缺失是否以及如何促进肿瘤转移仍不清楚。近期的一项研究[21]利用异种移植模型以及染色质免疫共沉淀测序、染色质转座酶可及性测序等技术探索了SETD2促进肿瘤转移的潜在机制,发现SETD2缺失可以通过调控染色质可及性来驱动肿瘤细胞转录表达,进而促进肿瘤生长。同时,通过靶向特定的组蛋白复合体(包括ASF1A/ASF1B和SPT16)可以针对性地治疗STED2缺失肾癌。
2.1.3 生物标志物研究进展
免疫检查点抑制剂已成为治疗转移性ccRCC的关键药物,但其获益有限,也缺少可靠的生物标志物。
液体活检为探索治疗响应和药物耐受的分子机制提供了独特的途径。一项多中心研究[22]收集了104例转移性肾癌患者的血液标本,使用一种新的循环肿瘤细胞(circulating tumor cell,CTC)捕获系统,分析了CTC计数和人类白细胞抗原Ⅰ类分子以及程序性死亡[蛋白]配体-1 (programmed death ligand-1,PD-L1)的表达。该研究证实CTC计数有助于预测患者预后,并为预测转移性肾癌患者对免疫治疗的反应提供了潜在的生物标志物。
有研究[23]利用311例肾癌的RNA测序数据探索了多腺苷二磷酸核糖聚合酶1[poly (ADP-ribose) polymerase 1,PARP1]表达预测PBRM1突变的ccRCC免疫治疗响应的潜在作用,发现在具有PBRM1基因突变的ccRCC患者中,PARP1蛋白水平与免疫治疗后的生存时间及免疫治疗响应有关,提示PARP1可作为预测PBRM1突变RCC患者免疫治疗响应的生物标志物。
美国纪念斯隆-凯特琳癌症中心完成了一项单中心研究[24],以评估纳武单抗辅助治疗在局限性高危肾癌患者中的安全性和有效性。随后,该研究分析了29例肾癌患者的基因组和免疫表型特征,并对这29例患者在免疫治疗前后的不同时间点进行了深部多区域全外显子组和转录组测序。这项研究描述了免疫治疗后肿瘤演变的重要特征,表明遗传和免疫异质性可以影响RCC对免疫治疗的反应,有助于发现预测肾癌免疫治疗响应的生物标志物。
2.2 非透明细胞RCC(non-clear cell RCC,nccRCC)基础研究进展
小眼畸形转录因子(microphthalmia transcription factor,MiTF)家族易位RCC (translocational RCC,tRCC)是一种罕见的肾癌,其恶性程度高,且好发于年轻人。有研究[25]利用基因组、转录组、蛋白质组及蛋白磷酸化组测序探索了tRCC的多组学分子图谱,发现DNA损伤修复、氧化磷酸化、细胞自噬等与tRCC的发生、发展关系密切,tRCC表现出显著的代谢紊乱,蛋白质组和蛋白磷酸化组数据表明,mTOR信号转导通路是tRCC潜在的治疗靶点。分子分型和免疫浸润分析也提示tRCC具有显著的肿瘤异质性,该研究为探索tRCC发生、发展机制及疾病诊断提供了重要信息。
pRCC是异质性最高的肾癌亚型,既往研究[26]认为pRCC主要起源于肾小管上皮细胞。而最近的一项研究通过使用单细胞染色质可及性测序发现,除了肾小管上皮细胞,pRCC还可以起源于肾脏集合管主细胞。该研究结果表明,确定肿瘤细胞起源并监测肿瘤代谢重编程可能有助于pRCC的早期诊断和治疗。
富马酸水合酶(fumarate hydratase,FH)缺陷性肾癌具有高度侵袭性,然而富马酸导致肿瘤发生的机制仍不清楚。有研究[27]以2型pRCC(pRCC2)为模型,发现富马酸在FH缺陷的细胞中积聚,并抑制10号染色体上缺失的磷酸酯酶与张力蛋白同源物基因(phosphatase and tensin homolog deleted on chremosome ten,PTEN)激活磷脂酰肌醇3激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/AKT)信号转导通路。在功能上,重新表达FH或PTEN C211S可抑制肿瘤生长并增强pRCC2对舒尼替尼的药物敏感性。临床标本分析表明,pRCC2中PTEN C211的琥珀酸化水平与AKT活性呈正相关。该研究首次发现PTEN存在半胱氨酸琥珀酸化修饰,并且这种修饰与pRCC2的发生、发展关系密切,这为开辟pRCC2治疗的新途径提供了参考。
3、临床研究进展
3.1 诊断方面
3.1.1 症状和体征
许多RCC患者仅在疾病晚期出现症状[28],大多数RCC是通过非侵入性成像检查各种非特异性症状和其他腹部疾病时偶然检测到的。最近的一项队列研究[29]显示,87%的Ⅰa期患者和36%的Ⅲ或Ⅳ期RCC患者是体检时偶然发现的。典型的腹痛、血尿和腹部肿块三联征很少出现,通常与高度侵袭性疾病相关[3]。
3.1.2 影像学检查
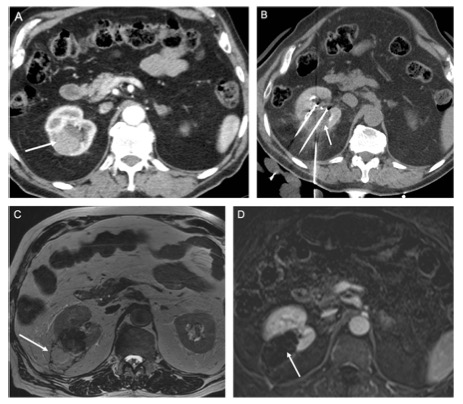
计算机体层成像(computed tomography,CT)、超声和磁共振成像(magnetic resonance imaging,MRI)是用于检查肾实质性或囊性肿块的常用方法[30]。CT、超声及MRI均可以有效地识别肾脏占位性病变并辅助判断肿瘤良恶性[31]。此外,正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)越来越多地用于辅助诊断pRCC,但目前PET/CT不是ccRCC患者的首选检查[32]。胸部CT是诊断肺转移瘤或纵隔淋巴结肿大最准确的检查方法,但cT1a期肾肿瘤胸部CT阳性概率较低[33]。大多数骨和脑转移在诊断时都有症状,因此如果需要,可以进行骨或脑成像检查[34]。
Bosniak分类根据CT或MRI检查结果将肾囊性肿块分为5级病变,该分类可预测恶性肿瘤风险,并为治疗提供指导[35]。Bosniak Ⅰ、 Bosniak Ⅱ、Bosniak ⅡF、Bosniak Ⅲ和Bosniak Ⅳ级囊肿,恶性潜能逐渐上升,Bosniak Ⅲ级囊肿的恶性概率接近50%[36]。但对Bosniak Ⅲ级囊肿进行谨慎监测也是一种合理的选择,因为对Bosniak Ⅲ级囊肿的手术在49%的病例中可能出现过度治疗,这些病例中仍存在一些良性病变[36]。
3.1.3 穿刺活检
经皮穿刺活检越来越多地用于组织学诊断,以避免良性病变的不必要的手术。对于转移性患者,可在初次全身治疗前进行穿刺以明确病理学诊断[37]。如果活检无法诊断,则应考虑再次活检或手术切除[38]。由于囊性占位性病变的恶性潜能较低,不建议对其进行穿刺活检,除非是Bosniak Ⅳ级囊肿[38]。
3.1.4 病理学诊断
世界卫生组织(World Health Organization,WHO)于2022年出版的第5版泌尿生殖系统肿瘤分类[39]对肾癌分类进行了重大修订。基于分子层面的变化,第5版WHO分类中定义了一些新的肾肿瘤,包括SMARCB1缺失的肾髓质癌、TFEB突变肾癌、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排肾癌、ELOC突变肾癌及FH缺陷性肾癌。同时,基于病理学形态,WHO定义了一种新的肿瘤实体:嗜酸性实性和囊性RCC(eosinophilic solid and cystic RCC,ESC RCC)[39]。以下简述2022年新增的肾癌病理学亚型。
发生于肾髓质区的肾癌较为罕见,包括集合管癌和肾髓质癌。集合管癌中SMARCB1的作用一般正常,而肾髓质癌通常表现出SMARCB1缺失[40]。因此,这些肿瘤被命名为SMARCB1缺失的肾髓质癌。这种肾癌具有很强的侵袭性,常发生在伴有镰状细胞贫血的年轻患者中。临床上一些具有肾髓质癌特征的未分类肾癌可表现出SMARCB1的完全缺失,但与血红蛋白病无相关性,说明镰状细胞贫血并不是提示这种基因变异的先决条件[41]。在诊断该肿瘤时,需要考虑其他肾癌亚型可能存在继发性的SMARCB1缺失,如伴有肉瘤样分化的肾癌、易位肾癌及FH缺陷性肾癌[42]。
第4版WHO泌尿肿瘤分类将TFEB易位肾癌纳入了MiTF易位肾癌的家族。除了TFEB易位之外,近年来的研究[43]也报道了TFEB扩增引起的肾癌,因此将这些因TFEB基因改变引起的肾癌均定义为TFEB突变肾癌。相比于TFE3重排肾癌,TFEB突变肾癌更加罕见。TFEB易位肾癌比TFE3易位肾癌更偏惰性,而TFEB扩增的肾癌则表现更强的侵袭性。
ALK重排肾癌是一种非常罕见的肾癌亚型[44],具有丰富的嗜酸性细胞质,典型的空泡化,但其形态学表现变化较大,有时可见黏液状沉积物。这是一种排除性诊断,在将形态异常混合的病例判定为“未分类肾癌”之前,应进行ALK免疫组织化学和(或)荧光原位杂交检测。ALK重排肾癌可出现多种不同的临床表现,但一些患者对靶向ALK抑制剂有显著的反应[45]。
ELOC突变肾癌有多种形态,需要与ccRCC或透明细胞pRCC进行鉴别。既往曾将一部分ELOC突变肾癌诊断为伴平滑肌瘤样间质的RCC[46]。ELOC突变肾癌是一种基于分子诊断的肾癌亚型,无明确分子检测则不能诊断该肿瘤。
在2016年WHO分类中,遗传性平滑肌瘤病和RCC(hereditary leiomyomatosis and RCC,HLRCC)被定义为单独的肿瘤实体(诊断性胚系FH基因缺失)。而在2016年以后,研究发现许多被描述为“未分类的高级别肾癌”、“病灶去分化的小管囊性癌”、“2型乳头状癌”、“集合管癌”的病例均出现了FH基因缺失[43,47]。因此,对于形态符合、FH免疫组织化学染色阴性、2SC免疫组织化学染色阳性和(或)肿瘤中发现致病性FH突变的肾癌,当没有HLRCC综合征相关典型临床症状且家族史和遗传信息未知时,FH缺陷型肾癌是首选的命名术语[48]。在家族性病例中,将患者诊断为HLRCC综合征相关的肾癌仍然是可以接受的。
ESC RCC已被认为是一个独立实体,具有“经典”的组织学特征,免疫组织化学染色可见特征性的CK20表达,同时具有结节性硬化症(tuberous sclerosis,TSC)相关基因的改变[49]。首次报道的ESC RCC表现为惰性肿瘤,几乎没有临床症状[50],而鉴于ESC RCC具有TSC相关基因变异及潜在的mTOR信号转导通路激活,提示ESC RCC患者可能受益于mTOR抑制剂。
3.2 治疗方面
3.2.1 局限性RCC
对于局限性RCC,手术仍是首选的治疗方法。T1期RCC最好采用部分肾切除术(partial nephrectomy,PN)而非根治性肾切除术(radical nephrectomy,RN)。研究[51]表明,采用PN和RN的患者总体生存率相当。但PN可比RN更好地保护肾功能,从而降低发生代谢或心血管疾病的风险[52]。对于<4 cm的肿瘤,回顾性研究[53]表明,RN与心血管不良反应的发生率和任何原因的死亡率升高相关。此外,针对T1b期RCC的研究[54]表明,PN和RN无显著生存差异。
3.2.2 晚期ccRCC
转移性肾癌患者接受系统性药物治疗前是否应行减瘤性手术一直以来备受争议,2022年一项回顾性研究[55]纳入了4 639例转移性肾癌患者,其中2 326例患者在用药前接受了减瘤性手术,1 876例患者在用药前没有接受减瘤性手术。多因素回归分析显示,无论患者接受何种系统性药物治疗,用药前行减瘤性手术均可显著延长患者的总生存期(overall survival,OS),表明减瘤性手术可以使转移性肾癌患者生存获益。
就晚期ccRCC的系统性治疗而言,已经完成的多项Ⅲ期临床试验(KEYNOTE-581[56]、 KEYNOTE-426[57]及CheckMate-9ER[58]等)均表明目前最优的一线方案仍然是靶向药物联合程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂。下面主要对2022年的晚期ccRCC治疗方案新进展进行总结。
2022年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)大会报道了COSMIC-313研究[59]结果,该研究旨在对比三药联合(卡博替尼、纳武单抗、伊匹单抗)与双免疫治疗(纳武单抗、伊匹单抗)在晚期ccRCC一线治疗中的效果,并评估三药联合的安全性。结果显示,卡博替尼联合纳武单抗、伊匹单抗可以显著改善国际转移性肾细胞癌数据库联盟(International Metastatic Renal Cell Carcinoma Database Consortium,IMDC)中高危患者的无进展生存期(progression-free survival,PFS),尤其是IMDC中危患者。相比于双免疫治疗,三药联合方案的疾病控制率(disease control rate,DCR)和客观缓解率(objective response rate,ORR)更高,但不良反应发生率也相对更高,主要不良反应包括肝毒性和皮肤毒性,需进一步随访以获取OS数据。
LITESPARK-001研究[60]旨在探索HIF-2α抑制剂belzutifan用于晚期ccRCC患者的疗效,共纳入55例患者,每天给予belzutifan单药治疗,主要终点是安全性评价,中位随访时间为41.2个月,22例患者经历了3级不良反应,常见不良反应为贫血和缺氧。总体人群的ORR为25%,各亚组均观察到治疗获益,包括既往接受过免疫治疗和血管内皮生长因子(vascular endothelial growth factor,VEGF)靶向治疗的患者,患者总体中位PFS为14.5个月。该研究表明,belzutifan单药治疗在既往接受过治疗的晚期ccRCC 患者中继续显示出较高的DCR,且belzutifan表现出良好的安全性,belzutifan可能作为免疫治疗失败后晚期ccRCC患者的后线治疗选择。
LITESPARK-003研究[61]旨在探索HIF-2α抑制剂belzutifan联合卡博替尼在晚期ccRCC中的潜在作用。该研究包含两个队列,队列1为探索belzutifan联合卡博替尼作为晚期ccRCC一线用药的疗效与安全性,队列2为探索belzutifan联合卡博替尼在既往经过系统性靶向治疗和(或)免疫治疗的晚期ccRCC中的疗效和安全性。2022年ESMO大会公布了该研究最新的随访数据。结果显示,队列1中belzutifan联合卡博替尼一线治疗晚期ccRCC的ORR达57%,中位PFS达30.3个月。队列2中belzutifan联合卡博替尼作为后线治疗晚期ccRCC的ORR为31%,中位PFS超过1年,不良反应可控。总体来看belzutifan联合卡博替尼方案疗效确切,需进一步随访以获取更多数据。
CBM588是一种活性益生菌产品,Dizman等[62]的一项前瞻性试验纳入了29例转移性RCC患者,以2∶1的比例随机分配成2组,在接受双免疫治疗(纳武单抗、伊匹单抗)的同时,每日口服或不口服CBM588,并对粪便多次采样测定两组双歧杆菌的丰度。结果显示,与单独使用双免疫治疗相比,同时使用CBM588可以显著增加双免疫治疗患者的PFS。但该临床试验目前样本量较少,有必要进行更大规模的研究来证实这一发现,并阐明其潜在作用机制以及CBM588对微生物群和免疫功能的影响。
Bempegaldesleukin是一种白细胞介素-2(interleukin-2,IL-2)激动剂,可以刺激机体的抗肿瘤免疫反应。PIVOT-09研究是一项Ⅲ期临床试验[63],旨在评估bempegaldesleukin联合纳武单抗对比舒尼替尼或卡博替尼在晚期RCC一线治疗中的疗效,从ORR来看,与酪氨酸激酶抑制剂对照组相比,联合治疗未达到预期的效果。
3.2.3 nccRCC
nccRCC约占所有肾癌的25%,对于转移性nccRCC,目前没有标准的一线治疗方案,既往也没有成功开展的Ⅲ期临床试验。有研究表明,舒尼替尼[64]和卡博替尼[65]可以延长nccRCC患者的PFS,但总体来说单药靶向治疗的获益有 限。
Lee等[66]开展的临床试验探索了卡博替尼联合纳武单抗在nccRCC中的疗效,共有47例患者接受治疗,平均随访时间为13.1个月。队列1(n=40)的客观有效率为47.5%,中位PFS为12.5个月,中位OS为28.0个月,表明卡博替尼联合纳武单抗对大多数nccRCC特别是具有明显乳头样特征的肾癌具有显著的疗效。
KEYNOTE-B61研究[67]是一项单臂、Ⅱ期临床试验,旨在探索帕博利珠单抗联合仑伐替尼一线治疗晚期nccRCC患者的有效性和安全性。基于既往KEYNOTE-581研究中帕博利珠单抗联合仑伐替尼对晚期RCC患者OS的改善,进一步探讨了该联合治疗在nccRCC中的疗效和安全性,结果显示,帕博利珠单抗联合仑伐替尼一线治疗晚期nccRCC的ORR达47.6%,DCR达79.3%,86.5%的患者靶病灶缩小。PFS和OS还需进一步随访。该研究结果表明,帕博利珠单抗联合仑伐替尼在nccRCC中显示出令人鼓舞的抗肿瘤活性和可控的安全性,可能延长晚期nccRCC患者的OS。
ALTER-UC-001研究是一项安罗替尼联合依维莫司作为晚期nccRCC一线治疗的Ⅱ期临床试验,由复旦大学附属肿瘤医院泌尿外科团队发起。该研究计划入组30例nccRCC患者,均接受安罗替尼联合依维莫司治疗,持续至多1年或直到疾病进展、不可耐受的毒性出现或撤回知情同意。主要终点是ORR,次要终点包括DCR、PFS、OS及安全性等。该研究是国内外首个安罗替尼联合依维莫司一线治疗晚期nccRCC的临床试验,研究设计更具有针对中国患者的临床指导价值,研究结果有望填补国内外转移性nccRCC一线治疗的空白。
4、总结与展望
近年来,随着基础研究的不断深入及各类高质量临床研究的不断开展,靶向治疗和免疫治疗得以广泛应用,晚期肾癌患者的生存期也不断延长。然而,仍有部分晚期肾癌患者无法从系统治疗中获益,特别是部分晚期nccRCC患者。HIF-2α抑制剂及CBM588等新型药物的出现使晚期肾癌患者的用药选择更加丰富,也给靶向治疗和免疫治疗耐药的晚期肾癌患者带来新希望。未来仍需进一步研究,以使更多患者受益。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] MOCH H, CUBILLA A L, HUMPHREY P A, et al . The 2016 WHO classification of tumours of the urinary system and male genital organs-part A: renal, penile, and testicular tumours[J]. Eur Urol, 2016, 70(1): 93-105.
[3] THORSTENSON A, BERGMAN M, SCHERMAN-PLOGELL A H, et al. Tumour characteristics and surgical treatment of renal cell carcinoma in Sweden 2005-2010: a population-based study from the national Swedish kidney cancer register[J]. Scand J Urol, 2014, 48(3): 231-238.
[4] BUKAVINA L, BENSALAH K, BRAY F, et al. Epidemiology of renal cell carcinoma: 2022 update[J]. Eur Urol, 2022, 82(5): 529-542.
[5] ROGER V L, GO A S, LLOYD-JONES D M, et al. Heart disease and stroke statistics: 2011 update: a report from the American Heart Association[J]. Circulation, 2011, 123(4): e18-e209.
[6] LIU X Q, PEVERI G, BOSETTI C, et al. Dose-response relationships between cigarette smoking and kidney cancer: a systematic review and meta-analysis[J]. Crit Rev Oncol Hematol, 2019, 142: 86-93.
[7] EHDAIE B, FURBERG H, ZABOR E C, et al. Comprehensive assessment of the impact of cigarette smoking on survival of clear cell kidney cancer[J]. J Urol, 2014, 191(3): 597-602.
[8] BHASKARAN K, DOUGLAS I, FORBES H, et al. Body-mass index and risk of 22 specific cancers: a population-based cohort study of 5.24 million UK adults[J]. Lancet, 2014, 384(9945): 755-765.
[9] CHOI Y, PARK B, JEONG B C, et al. Body mass index and survival in patients with renal cell carcinoma: a clinical-based cohort and meta-analysis[J]. Int J Cancer, 2013, 132(3): 625-634.
[10] KAELIN W G JR. The VHL tumor suppressor gene: insights into oxygen sensing and cancer[J]. Trans Am Clin Climatol Assoc, 2017, 128: 298-307.
[11] AL-BAYATI O, HASAN A, PRUTHI D, et al. Systematic review of modifiable risk factors for kidney cancer[J]. Urol Oncol, 2019, 37(6): 359-371.
[12] HIDAYAT K, DU X, ZOU S Y, et al. Blood pressure and kidney cancer risk: meta-analysis of prospective studies[J]. J Hypertens, 2017, 35(7): 1333-1344.
[13] LEE J E, HUNTER D J, SPIEGELMAN D, et al. Alcohol intake and renal cell cancer in a pooled analysis of 12 prospective studies[J]. J Natl Cancer Inst, 2007, 99(10): 801-810.
[14] BAGNARDI V, ROTA M, BOTTERI E, et al. Alcohol consumption and site-specific cancer risk: a comprehensive dose-response meta-analysis[J]. Br J Cancer, 2015, 112(3): 580-593.
[15] QU Y Y, FENG J W, WU X H, et al. A proteogenomic analysis of clear cell renal cell carcinoma in a Chinese population[J]. Nat Commun, 2022, 13(1): 2052.
[16] LI Y, LIH T M, DHANASEKARAN S M, et al. Histopathologic and proteogenomic heterogeneity reveals features of clear cell renal cell carcinoma aggressiveness[J]. Cancer Cell, 2023, 41(1): 139-163.e17.
[17] LI R Y, FERDINAND J R, LOUDON K W, et al. Mapping single-cell transcriptomes in the intra-tumoral and associated territories of kidney cancer[J]. Cancer Cell, 2022, 40(12): 1583-1599.e10.
[18] BÜTTNER F A, WINTER S, STÜHLER V, et al. A novel molecular signature identifies mixed subtypes in renal cell carcinoma with poor prognosis and independent response to immunotherapy[J]. Genome Med, 2022, 14(1): 105.
[19] PATEL S A, HIROSUE S, RODRIGUES P, et al. The renal lineage factor PAX8 controls oncogenic signalling in kidney cancer[J]. Nature, 2022, 606(7916): 999-1006.
[20] ZHOU J, SIMON J M, LIAO C, et al . An oncogenic JMJD6- DGAT1 axis tunes the epigenetic regulation of lipid droplet formation in clear cell renal cell carcinoma[J]. Mol Cell, 2022, 82(16): 3030-3044. e8.
[21] XIE Y C, SAHIN M, SINHA S, et al. SETD2 loss perturbs the kidney cancer epigenetic landscape to promote metastasis and engenders actionable dependencies on histone chaperone complexes[J]. Nat Cancer, 2022, 3(2): 188-202.
[22] BOOTSMA M, MCKAY R R, EMAMEKHOO H, et al. Longitudinal molecular profiling of circulating tumor cells in metastatic renal cell carcinoma[J]. J Clin Oncol, 2022, 40(31): 3633-3641.
[23] HAGIWARA M, FUSHIMI A, MATSUMOTO K, et al . The significance of PARP1 as a biomarker for predicting the response to PD-L1 blockade in patients with PBRM1-mutated clear cell renal cell carcinoma[J]. Eur Urol, 2022, 81(2): 145-148.
[24] GOLKARAM M, KUO F S, GUPTA S, et al. Spatiotemporal evolution of the clear cell renal cell carcinoma microenvironment links intra-tumoral heterogeneity to immune escape[J]. Genome Med, 2022, 14(1): 143.
[25] QU Y Y, WU X H, ANWAIER A, et al. Proteogenomic characterization of MiT family translocation renal cell carcinoma[J]. Nat Commun, 2022, 13(1): 7494.
[26] WANG Q, ZHANG Y, ZHANG B L, et al. Single-cell chromatin accessibility landscape in kidney identifies additional cell-oforigin in heterogenous papillary renal cell carcinoma[J]. Nat Commun, 2022, 13(1): 31.
[27] GE X, LI M D, YIN J X, et al. Fumarate inhibits PTEN to promote tumorigenesis and therapeutic resistance of type2 papillary renal cell carcinoma[J]. Mol Cell, 2022, 82(7): 1249-1260.e7.
[28] SUN R, BREAU R H, MALLICK R, et al. Prognostic impact of paraneoplastic syndromes on patients with non-metastatic renal cell carcinoma undergoing surgery: results from Canadian kidney cancer information system[J]. Can Urol Assoc J, 2021, 15(4): 132-137.
[29] VASUDEV N S, WILSON M, STEWART G D, et al. Challenges of early renal cancer detection: symptom patterns and incidental diagnosis rate in a multicentre prospective UK cohort of patients presenting with suspected renal cancer[J]. BMJ Open, 2020, 10(5): e035938.
[30] VOGEL C, ZIEGELMÜLLER B, LJUNGBERG B, et al. Imaging in suspected renal-cell carcinoma: systematic review[J]. Clin Genitourin Cancer, 2019, 17(2): e345-e355.
[31] ROSSI S H, PREZZI D, KELLY-MORLAND C, et al. Imaging for the diagnosis and response assessment of renal tumours[J]. World J Urol, 2018, 36(12): 1927-1942.
[32] MA H, SHEN G H, LIU B, et al. Diagnostic performance of 18F-FDG PET or PET/CT in restaging renal cell carcinoma: a systematic review and meta-analysis[J]. Nucl Med Commun, 2017, 38(2): 156-163.
[33] VOSS J, DRAKE T, MATTHEWS H, et al. Chest computed tomography for staging renal tumours: validation and simplification of a risk prediction model from a large contemporary retrospective cohort[J]. BJU Int, 2020, 125(4): 561-567.
[34] KOTECHA R R, FLIPPOT R, NORTMAN T, et al. Prognosis of incidental brain metastases in patients with advanced renal cell carcinoma[J]. J Natl Compr Canc Netw, 2021, 19(4): 432-438.
[35] SILVERMAN S G, PEDROSA I, ELLIS J H, et al. Bosniak classification of cystic renal masses, version 2019: an update proposal and needs assessment[J]. Radiology, 2019, 292(2): 475-488.
[36] CHANDRASEKAR T, AHMAD A E, FADAAK K, et al . Natural history of complex renal cysts: clinical evidence supporting active surveillance[J]. J Urol, 2018, 199(3): 633-640.
[37] LJUNGBERG B, ALBIGES L, ABU-GHANEM Y, et al. European association of urology guidelines on renal cell carcinoma: the 2022 update[J]. Eur Urol, 2022, 82(4): 399-410.
[38] LEVERIDGE M J, FINELLI A, KACHURA J R, et al. Outcomes of small renal mass needle core biopsy, nondiagnostic percutaneous biopsy, and the role of repeat biopsy[J]. Eur Urol, 2011, 60(3): 578-584.
[39] MOCH H, AMIN M B, BERNEY D M, et al. The 2022 World Health Organization classification of tumours of the urinary system and male genital organs-part A: renal, penile, and testicular tumours[J]. Eur Urol, 2022, 82(5): 458-468.
[40] JIA L, CARLO M I, KHAN H, et al . Distinctive mechanisms underlie the loss of SMARCB1 protein expression in renal medullary carcinoma: morphologic and molecular analysis of 20 cases[J]. Mod Pathol, 2019, 32(9): 1329-1343.
[41] COLOMBO P, SMITH S C, MASSA S, et al . Unclassified renal cell carcinoma with medullary phenotype versus renal medullary carcinoma: lessons from diagnosis in an Italian man found to harbor sickle cell trait[J]. Urol Case Rep, 2015, 3(6): 215-218.
[42] YU L, LI J, XU S P, et al. An Xp11.2 translocation renal cell carcinoma with SMARCB1 (INI1) inactivation in adult endstage renal disease: a case report[J]. Diagn Pathol, 2016, 11(1): 98.
[43] KRYVENKO O N. Tumor necrosis adds prognostically significant information to grade in clear cell renal cell carcinoma: a study of 842 consecutive cases from a single institution[J]. Urol Oncol, 2017, 35(6): 454-455.
[44] SUKOV W R, HODGE J C, LOHSE C M, et al. ALK alterations in adult renal cell carcinoma: frequency, clinicopathologic features and outcome in a large series of consecutively treated patients[J]. Mod Pathol, 2012, 25(11): 1516-1525.
[45] TAO J J, WEI G, PATEL R, et al. ALK fusions in renal cell carcinoma: response to entrectinib[J]. JCO Precis Oncol, 2018, 2: 1-8.
[46] SHAH R B, STOHR B A, TU Z J, et al. Renal cell carcinoma with leiomyomatous stroma harbor somatic mutations of TSC1, TSC2, MTOR, and/or ELOC (TCEB1): clinicopathologic and molecular characterization of 18 sporadic tumors supports a distinct entity[J]. Am J Surg Pathol, 2020, 44(5): 571-581.
[47] SMITH S C, SIROHI D, OHE C, et al. A distinctive, low-grade oncocytic fumarate hydratase-deficient renal cell carcinoma, morphologically reminiscent of succinate dehydrogenasedeficient renal cell carcinoma[J]. Histopathology, 2017, 71(1): 42-52.
[48] WYVEKENS N, VALTCHEVA N, MISCHO A, et al. Novel morphological and genetic features of fumarate hydratase deficient renal cell carcinoma in HLRCC syndrome patients with a tailored therapeutic approach[J]. Genes Chromosom Cancer, 2020, 59(11): 611-619.
[49] PALSGROVE D N, LI Y J, PRATILAS C A, et al. Eosinophilic solid and cystic (ESC) renal cell carcinomas harbor TSC mutations: molecular analysis supports an expanding clinicopathologic spectrum[J]. Am J Surg Pathol, 2018, 42(9): 1166-1181.
[50] TRPKOV K, ABOU-OUF H, HES O, et al. Eosinophilic solid and cystic renal cell carcinoma (ESC RCC): further morphologic and molecular characterization of ESC RCC as a distinct entity[J]. Am J Surg Pathol, 2017, 41(10): 1299-1308.
[51] MACLENNAN S, IMAMURA M, LAPITAN M C, et al. Systematic review of oncological outcomes following surgical management of localised renal cancer[J]. Eur Urol, 2012, 61(5): 972-993.
[52] CAPITANIO U, TERRONE C, ANTONELLI A, et al. Nephronsparing techniques independently decrease the risk of cardiovascular events relative to radical nephrectomy in patients with a T1a-T1b renal mass and normal preoperative renal function[J]. Eur Urol, 2015, 67(4): 683-689.
[53] ALAM R, PATEL H D, OSUMAH T, et al. Comparative effectiveness of management options for patients with small renal masses: a prospective cohort study[J]. BJU Int, 2019, 123(1): 42-50.
[54] SPRENKLE P C, POWER N, GHONEIM T, et al. Comparison of open and minimally invasive partial nephrectomy for renal tumors 4-7 centimeters[J]. Eur Urol, 2012, 61(3): 593-599.
[55] BAKOUNY Z, EL ZARIF T, DUDANI S, et al. Upfront cytoreductive nephrectomy for metastatic renal cell carcinoma treated with immune checkpoint inhibitors or targeted therapy: an observational study from the international metastatic renal cell carcinoma database consortium[J]. Eur Urol, 2023, 83(2): 145-151.
[56] MOTZER R, ALEKSEEV B, RHA S Y, et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma[J]. N Engl J Med, 2021, 384(14): 1289-1300.
[57] RINI B I, PLIMACK E R, STUS V, et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2019, 380(12): 1116-1127.
[58] CHOUEIRI T K, POWLES T, BUROTTO M, et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2021, 384(9): 829-841.
[59] CHOUEIRI T K, POWLES T B, ALBIGES L, et al. LBA8- phase Ⅲ study of cabozantinib (C) in combination with nivolumab (N) and ipilimumab (I) in previously untreated advanced renal cell carcinoma (aRCC) of IMDC intermediate or poor risk (COSMIC-313)[J]. Ann Oncol, 2022, 33(suppl_7): S808-S869.
[60] JONASCH E, MICHAEL BAUER T, PAPADOPOULOS K P, et al. Phase 1 LITESPARK-001 (MK-6482-001) study of belzutifan in advanced solid tumors: update of the clear cell renal cell carcinoma (ccRCC) cohort with more than 3 years of total follow-up[J]. J Clin Oncol, 2022, 40(suppl 16): Abstr 4509.
[61] MCDERMOTT D F, CHOUEIRI T K, TYKODI S, et al. 1453P-phase Ⅱ study of belzutifan plus cabozantinib for previously treated advanced renal cell carcinoma (RCC): update from cohort 2 of LITESPARK-003[J]. Ann Oncol, 2022, 33(suppl_7): S660-S680.
[62] DIZMAN N, MEZA L, BERGEROT P, et al. Nivolumab plus ipilimumab with or without live bacterial supplementation in metastatic renal cell carcinoma: a randomized phase 1 trial[J]. Nat Med, 2022, 28(4): 704-712.
[63] DIAB A, GOGAS H J, SANDHU S K, et al. 785O-PIVOT IO 001: first disclosure of efficacy and safety of bempegaldesleukin (BEMPEG) plus nivolumab (NIVO) vs NIVO monotherapy in advanced melanoma (MEL)[J]. Ann Oncol, 2022, 33 (suppl_7): S356-S409.
[64] ARMSTRONG A J, HALABI S, EISEN T, et al. Everolimus versus sunitinib for patients with metastatic non-clear cell renal cell carcinoma (ASPEN): a multicentre, open-label, randomised phase 2 trial[J]. Lancet Oncol, 2016, 17(3): 378-388.
[65] PAL S K, TANGEN C, THOMPSON I M JR, et al. A comparison of sunitinib with cabozantinib, crizotinib, and savolitinib for treatment of advanced papillary renal cell carcinoma: a randomised, open-label, phase 2 trial[J]. Lancet, 2021, 397(10275): 695-703.
[66] LEE C H, VOSS M H, CARLO M I, et al. Phase Ⅱ trial of cabozantinib plus nivolumab in patients with non-clear-cell renal cell carcinoma and genomic correlates[J]. J Clin Oncol, 2022, 40(21): 2333-2341.
[67] LEE C H, SHAH A Y, RASCO D, et al. Lenvatinib plus pembrolizumab in patients with either treatment-naive or previously treated metastatic renal cell carcinoma (study 111/ KEYNOTE-146): a phase 1b/2 study[J]. Lancet Oncol, 2021, 22(7): 946-958.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言